草甘膦对黑斑蛙主要器官中抗氧化酶的影响
高爱保
(晋中学院生物科学与技术学院,山西晋中 030600)
草甘膦,化学名为N-(磷酸甲基)甘氨酸,不溶于有机溶剂,极性很强,易溶于水,它是一种非选择性、无残留、内吸传导型广谱灭生性除草剂。虽然草甘膦对动物的毒性很低,但由于其消耗量过大、施用范围广,还可能通过食物链富集,因此其毒性不可忽视。一方面,它们可直接进入人和其他生物的体内,引起急性、慢性中毒或畸变;另一方面,通过径流、排污、挥发等途径进入土壤、水体和大气,引起各种生态环境下生物的死亡,并通过食物链的富集、传递,影响人类的食品安全[1]。这些污染物进入生物体内,可形成多种中间产物,其中许多中间产物可进入氧化还原循环,产生比母体污染物危害性更大的中间代谢产物,同时伴随着大量的活性氧自由基的产生[2]。这些活性氧自由基若不及时清除,就会引起DNA断裂、脂质过氧化、酶失活等损伤[3],对机体造成氧化胁迫。目前,国内对草甘膦的毒性研究已有不少报道。2007年,肖永红等在草甘膦对中华大蟾蜍的慢性毒性的研究中发现,亚致死剂量的草甘膦溶液对中华大蟾蜍蝌蚪的生长、发育和运动频率有抑制作用[4]。2010年,张彬彬研究的草甘膦对鲫鱼肝脏内膜系统和超氧化物歧化酶的影响表明,随草甘膦质量浓度增加,干细胞内膜系统中线粒体肿胀及空泡化、内质网空泡化,不同质量浓度的草甘膦处理对鲫鱼肝脏中超氧化物歧化酶(SOD)均起诱导作用,SOD活性随污染物质量浓度升高而升高,96 h处理SOD活性先被诱导,而后出现抑制效应[5]。
黑斑蛙(Rananigromaculata)是无尾目、蛙科、蛙属的两栖动物,成蛙常栖息于池溏、水沟边等近水域附近的草丛中。近年来,两栖类动物在全球范围内出现了严重的种群衰退现象,尤其是农药和除草剂使用后的负面影响已引起人们的重视[6-7]。同时,草甘膦对环境及有益生物的影响受到关注[8-9]。两栖类动物是生态群落的重要组成部分,因此它们的消亡和灭绝将会对生物多样性产生巨大的威胁。近年,随着环境污染的日益加重,两栖动物种类在世界各地正在急剧地衰减或消失[10]。国内外许多学者报道了常见杀虫剂和除草剂对两栖类的毒性及对两栖类种群衰退的影响,他们对常见的两栖类物种不明原因地衰减或消失进行了多次论证,认为两栖动物由于其皮肤的高渗透性、水陆两栖等生物学特性,对环境污染极其敏感,两栖动物种群的变化与环境污染物有密切的关系[11-13]。本试验用不同浓度的草甘膦研究其在不同时间内对黑斑蛙的肝脏、肾脏和皮肤中SOD活性及过氧化氢酶(CAT)活性的影响,了解草甘膦对其抗氧化系统的毒害,从而为合理使用草甘膦、保障生物多样性和提高生物安全性提供初步的试验依据。
1 材料与方法
1.1 试验材料
健康成年黑斑蛙平均体长为(74.5±4.5) mm,随机均分为对照组和染毒组,放在室内盛有3~5 cm 不同体积分数的草甘膦(41%草甘膦异丙胺盐水剂,南京华洲药业有限公司)溶液的小桶内养殖,对照组溶液为饮用水,每天更换1/2溶液,且投喂1次。试验组分为5个处理,每个处理3次重复,其体积分数梯度为0.82、1.23、1.64、2.05、2.87 mL/L;定时观察记录黑斑蛙外形及生理变化。
1.2 试验方法
每隔10 d以双毁髓法处死,取其皮肤、肝脏和肾脏测定超氧化物歧化酶(SOD)活力和过氧化氢酶(CAT)活性,并记录试验数据,采用SPSS进行统计分析。
2 结果与分析
2.1 草甘膦对黑斑蛙肝脏中SOD活性的影响
由图1可知,不同体积分数草甘膦处理后黑斑蛙肝脏中SOD活性发生变化,与对照组相比呈先增高后降低的趋势。10 d时,对照组肝脏中SOD活性与0.82、1.23 mL/L组无显著差异。SOD最高值33.35出现于2.87 mL/L组,其余体积分数组与对照组相比差异显著(P<0.05)。20、30 d对照组肝脏中SOD活性均与处理组有显著差异(P<0.05)。30 d处理SOD活性升高后,为降低,草甘膦体积分数为2.05 mL/L时,SOD活性出现最高值,为33.808 U/mg。

2.2 草甘膦对黑斑蛙肾脏中SOD活性的影响
由图2可知,不同体积分数草甘膦处理后,黑斑蛙肾脏中SOD活性变化。10 d时,肾脏SOD活性与对照相比,除最低体积分数0.82 mL/L组外,其他组均差异显著(P<0.05)。20、30 d时,所有处理组与对照组相比均有显著差异(P<0.05)。SOD活性最大值33.29 U/mg出现于2.05 mL/L处理 20 d 时。

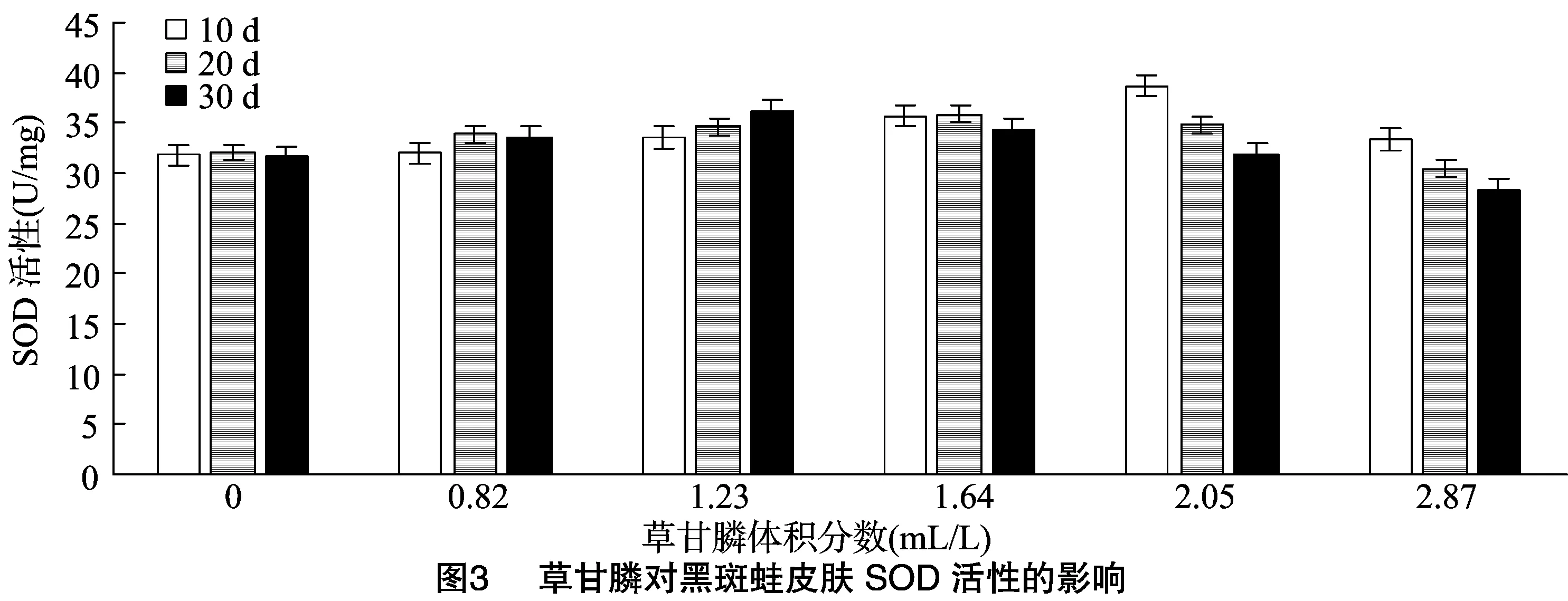
2.3 草甘膦对黑斑蛙皮肤中SOD活性的影响
由图3可知,不同体积分数草甘膦处理后,黑斑蛙皮肤中SOD活性变化。10 d时,肾脏SOD活性仅2.05 mL/L组与对照组有显著性差异(P<0.05)。在2.05 mL/L时,10、20 d所有处理与对照组均有显著差异(P<0.05)。SOD活性最大值 38.708 U/mg 出现于2.05 mL/L处理10 d时。
2.4 草甘膦对黑斑蛙肝脏中CAT活性的影响
由图4可知,不同体积分数草甘膦处理后,黑斑蛙肝脏中CAT活性与对照组相比有先增高后降低的趋势;肝脏中CAT活性与对照组相比均显著升高(P<0.05),但不同体积分数草甘膦对CAT活性间差异不显著。CAT最低值4.49 mg/(g·min)出现在 0.82 mL/L 处理10 d时,最高值4.52 mg/(g·min)出现在1.64 mL/L处理 30 d时。

2.5 草甘膦对黑斑蛙肾脏中CAT活性的影响
由图5可知,经过不同体积分数草甘膦处理后,黑斑蛙肾脏中CAT活性与对照组相比较有升高的趋势。处理10、20、30 d时,肾脏CAT活性与对照组比较差异显著(P<0.05),表明草甘膦处理后CAT活性发生了显著变化,从而对抗氧化损伤压力。CAT活性最低值1.81 mg/(g·min)出现在0.82 mL/L处理 10 d 时,最高值2.22 mg/(g·min)出现在1.64 mL/L处理30 d时。

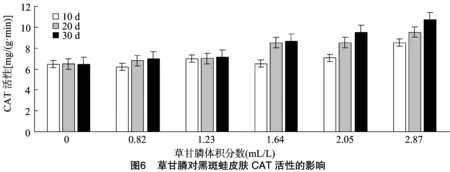
2.6 草甘膦对黑斑蛙皮肤中CAT活性时影响
由图6可见,经过不同体积分数草甘膦处理后,黑斑蛙皮肤中CAT活性与对照组相比较有升高的趋势,处理10、20、30 d时各体积分数组皮肤CAT活性与对照组比较差异显著(P<0.05),尤其是 2.87 mL/L 体积分数处理组,与对照差异极显著(P<0.01),表明草甘膦处理后皮肤中CAT活性很快发生显著变化,从而对抗氧化损伤压力。处理组CAT活性最低值 6.098 mg/(g·min) 出现在 0.82 mL/L 处理10 d时,最高值 10.728 mg/(g·min) 出现在1.64 mL/L处理 30 d 时。
3 讨论
近年来,除草剂草甘膦的使用所带来的危害已经引起越来越多的人的关注,而本身它作为一种潜在的生态危险源,已经被众多研究者探究,两栖类动物种群的消失与农药的使用有一定的相关性。草甘膦对植物的毒性作用机理被认为是低风险的除草剂,因此对它的使用得到了推广,使用量也逐年增加。但农药的使用不可能全部被杂草吸收,随着雨水的冲刷、液体的蒸发,使得部分草甘膦残留在土壤、大气以及水域系统中,这样再加上时间的积累、食物链的富集,有可能同样会威胁到人类的生存和健康。
在生物的抗氧化系统中,SOD和CAT均是重要的抗氧化剂。在草甘膦染毒后,组织中的SOD活性和CAT活性被诱导,不同体积分数的草甘膦溶液随着染毒时间延长,SOD活性和CAT活性总体呈现先增大后减少的趋势,这与张彬彬研究的草甘膦对鲫鱼肝脏内膜系统和超氧化物歧化酶活性的影响的结果[5]相似,但在1.64~2.87 mL/L体积分数范围内,0~20 d内SOD活性和CAT活性均增强,而在20~30 d 内其活性则在减弱,表现出剂量效应和时间效应,即随时间延长,出现氧化损伤加大、毒害程度加深的现象,并且在不同组织器官中差异显著,皮肤裸露在外,短时间就能作出反馈,而肾脏中反应相对滞后,因而SOD、CAT活性具有组织特异性。从本试验的结果可知,除草剂草甘膦对黑斑蛙具有一定的危害性,草甘膦对成年黑斑蛙的安全使用体积分数为1.64 mL/L。而农业上除草时使用的浓度均高于这一浓度,会使超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性受到抑制。
由于除草剂具有选择毒性,对天敌的致死率与杀虫剂相比普遍较低,因此人们以往并不太关注除草剂对天敌动物的影响,但实际上,农业耕作过程中所施用的除草剂仅有少部分被植物吸收,大部分被喷施在与作物同一生境的动物体表或残留在土壤和水体中,对水体和农业生态系统造成污染[14-15]。尽管草甘膦在被喷施到水体环境中时浓度会被水体有所稀释,但水面蒸发以及草甘膦积累可导致水环境中草甘膦浓度升高,即使按照草甘膦的常用浓度施用,也将会对黑斑蛙造成不同程度的危害。从本研究中黑斑蛙的生长状况来看,低体积分数草甘膦的使用可提高它的活跃性和运动频率;高体积分数的草甘膦使得它的生长缓慢、运动迟缓;但随着染毒时间延长,不论草甘膦为低体积分数还是高体积分数,都会导致黑斑蛙生长缓慢、运动迟缓。

