小牛脾提取物注射液对人肺癌细胞增殖及放射敏感性的影响
顾宏韬,赵远红,高国青,李琪
(1.天津市中医药研究院附属医院 肿瘤科,天津 300120;2.天津市中医药大学第一附属医院 肿瘤科,天津 300073)
放射治疗是临床治疗肺癌的主要手段之一,因存在较大的个体差异性,尤其是部分低分化癌对放射线敏感性较低[1],需要提高局部放射剂量以期获得良好的控制率及预后,可能导致毒副反应加重,影响患者生活质量。寻找高效低毒的放射治疗增敏剂一直是肿瘤领域的研究热点。小牛脾提取物注射液(calf spleen extraction injection,CSEI)是提取出生24 h 内乳牛脾脏的一类无菌注射水溶液,主要成分为多肽与核糖[2]。赵岩玲等[3]学者证实,CSEI 可以降低晚期非小细胞肺癌患者血清肿瘤标志物水平,提高机体免疫力,进而延长患者带瘤生存期。有学者提出,CSEI 可以降低乳腺癌、鼻咽癌等放射治疗后出现皮肤损伤或口腔黏膜炎症等不良反应的风险[4]。但其是否对放射线具有增敏作用,文献研究报道较少。多数放射治疗增敏剂的作用机制为改善肿瘤细胞乏氧状态、诱导肿瘤细胞凋亡、调节细胞周期等[5]。我国一直十分重视放射增敏剂的研究,虽然已投入大量时间和精力,但是研发成果并不理想,因此寻找新的放射增敏剂对抗癌治疗具有深远意义。本文首先从细胞层面探讨CSEI 对肺癌细胞放射治疗增敏的可能;其次进一步从蛋白分子层面分析CSEI 放射治疗增敏可能的作用机制,从而为寻找新的放射治疗增敏剂及开发CSEI 新的临床应用提供一定的理论支持,现报道如下。
1 材料与方法
1.1 材料
CSEI(吉林敖东洮南药业股份有限公司,国药准字H22026121,规格:2 ml/5 mg,多肽∶380μg 核糖),RPMI 1640培养基、D’Hank's 液及胎牛血清(法国Biowest公司),链-青(P/S)双抗(美国Gibco公司),MTT(美国Sigma公司),彗星检测试剂盒和Annexin V-FITC/PI双染试剂盒(上海碧云天生物技术有限公司),Bcl-2 抗体、Bax 抗体及MDR1(美国Santa-Cruz公司),Survivin 抗体(美国Abcam公司),JEM-100CX Ⅱ型透射电镜(日本电子公司)。FACS Canto Ⅱ流式细胞仪(美国BD公司)。
1.2 方法
人肺腺癌细胞系A549 购自中国科学院上海生命科学研究所细胞库,细胞培养体系:10%胎牛血清,100 u/ml P/S双抗,90% RPMI 1640培养液。调整细胞计数1×107个/ml,培养条件:37℃、5%二氧化碳CO2细胞培养箱。细胞毒性实验分组:空白对照组和CSEI组(0.01、0.10、1.00、10.00及100.00 mg/ml)。细胞增殖实验分组:待细胞贴壁后,分为空白对照组、放射线组(2、4、6、8及10 Gy)及放射线(2、4、6、8及10 Gy)+CSEI(1.0 mg/ml)组。彗星实验和凋亡实验分组:待细胞贴壁后,分为空白对照组、放射线组(5 Gy)及CSEI组(1.0 mg/ml)和放射线组(5 Gy)+CSEI(1.0 mg/ml)组。空白对照组细胞不接受任何特殊处理。放射条件:采用医用6MeV X 射线,照射剂量为5 Gy,剂量率为200 cGy/min,源靶距为100 cm,照射视野为20 cm×20 cm。
1.3 MTT 法
将对数期生长的A549细胞按1×103个/孔单层接种至96 孔板中,分为空白对照组、CSEI(0.01、0.10、1.00、10.00及100.00 mg/ml)组,每组设置8个平行孔,培养22 ~24 h后,CSEI组细胞分别接受不同梯度CSEI;继续培养48 h后,按照MTT 法检测490 nm 波长处的光密度(optical density,OD)值。计算细胞增殖抑制率:增殖抑制率(%)=1-OD 值(受试孔)/ OD 值(对照孔)×100%;另外采用相同方法检测CESI 对A549细胞放射线的增敏作用。将接种细胞分为空白对照组、放射线组(2、4、6、8及10 Gy)和放射线(2、4、6、8及10 Gy)+CSEI(1.0 mg/ml)组,每组设置8个平行孔,培养22 ~24 h后,放射线组+ CSEI组细胞加入1.0 mg/ml CSEI;2 h后,放射线组和放射线+CSEI组细胞分别接受不同梯度照射剂量,继续培养48 h后,按照MTT 法检测OD 值,计算细胞增殖抑制率和增敏比(sensitivity enhancement ratio,SER)。SER=放射线组D0/放射线+CSEI组D0。D0为细胞增殖活性下降50%时的放射剂量,即半数致死 剂量。
1.4 平板克隆实验
将对数期生长的A549细胞按1×103个/孔单层接种至6 孔板中,待细胞贴壁后分为空白对照组、放射 线组(5 Gy)、CSEI组(1.0 mg/ml)和放射线(5 Gy)+ CSEI(1.0 mg/ml)组,处理方式同MTT 法测定。培养10 ~14 d后,加入4%多聚甲醛固定,吉姆萨染色,统计各组细胞集落(≥50个细胞)形成数。
1.5 中性彗星实验检测DNA双链断裂损伤
取对数期生长的A549细胞,分为空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)和放射线组(5 Gy)+CSEI(1.0 mg/ml)组,处理方式同MTT 法。收集细胞,调整细胞浓度为1×107个/ml,采用彗星检测试剂盒检测DNA 修复。用溴化乙啶染色后,置于荧光显微镜下观察细胞核拖尾情况,并采用CASP软件进行分析。尾距越长,说明DNA双链断裂情况越严重。双链断裂程度(%)=受试组彗星拖尾长度/ 空白对照组彗星拖尾长度×100%。
1.6 流式细胞术检测细胞凋亡
取对数期生长的A549细胞,分为空白对照组、放射线组(5 Gy)、CSEI(1.0 mg/ml)组和放射线组(5 Gy)+CSEI(1.0 mg/ml)组,处理方式同MTT法。每组分别收集2 管细胞,调整细胞浓度为1× 107个/ml,第1 管加入20μl RNase A 溶液,37℃水浴30 min,加入400μl PI 染色,上机检测细胞周期变化;第2 管加入500μl Binding Buffer、5μl Annexin V-FITC,混匀,室温避光孵育4 h,上机前20 min 加入5μl PI,上机检测细胞凋亡情况。
1.7 Western blotting 检测相关蛋白
收集空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)和放射线(5 Gy)+CSEI(1.0 mg/ml)组,加入PMSF细胞裂解液,提取蛋白。采用BCA 蛋白测定试剂盒检测蛋白浓度。加热煮沸,使蛋白变性,10% SDS-PAGE 电泳分离,转膜,脱脂牛奶密闭,分别加入Bcl-2 抗体(1 ∶500 稀释)、Bax 抗体(1 ∶500稀释)、Survivin 抗体(1 ∶1 000 稀释)及MDR1 抗体(1 ∶1 000 稀释),置于4℃摇床上过夜。采用TBST 反复冲洗,加入二抗(1 ∶5 000 稀释)。ECL试剂显影,拍照。
1.8 统计学方法
数据分析采用SPSS 17.0统计软件和Graph Pad Prism7.0软件。计量资料以均数±标准差(±s)表示,比较用独立样本t检验或单因素方差分析或析因设计的方差分析,进一步两两比较用SNK-q法,P<0.05为差异有统计学意义。
2 结果
2.1 CSEI 对A549细胞的毒性作用
MTT 法检测显示,不同浓度CSEI(0.01、0.10、1.00、10.00及100.00 mg/ml)处理后,细胞增殖活性受到抑制,分别为(0.56±0.43)%、(0.88±0.74)%、(1.25±0.85)%、(23.42±4.75)%及(44.89±9.82)%。0.01、0.10及1.00 mg/ml CSEI 对A549细胞增殖抑制作用基本一致,经单因素方差分析,差异无统计学意义(F=1.967,P=0.165)。1.00、10.00及100.00 mg/ml CSEI 对A549细胞增殖抑制率比较,经单因素方差分析,差异有统计学意义(F=95.455,P=0.000),且进一步两两比较,均差异有统计学意义(P<0.05)。1.0 mg/ml是CESI 无毒的最高剂量。见图1。

图1 CESI 对A549细胞增殖的抑制作用(±s)
2.2 CSEI 对A549细胞照射后增殖活性的影响
MTT 法检测显示,不同放射剂量(2、4、6、8及10 Gy)照射后,细胞增殖活性受到抑制,D0为5.997 Gy。而不同放射组细胞给予CSEI(1.0 mg/ml)预处理后,各组细胞增殖抑制率比较,经析因设计的方差分析,处理因素CSEI的主效应比较,差异有统计学意义(F=136.124,P=0.000);处理因素放射线的主效应比较,差异有统计学意义(F=89.675,P=0.000)。两者交互作用比较,差异无统计学意义(F=2.145,P=0.196)。因而无论是否进行CSEI处理,经不同放射剂量(2、4、6、8及10 Gy)照射后,细胞增殖活性均受到抑制;而给予CSEI(1.0 mg/ml)预处理后,能够增强放射线对A549细胞增殖活性的抑制作用。放射线组D0为5.997 Gy,放射线+CSEI(1.0 mg/ml)组D0为4.216 Gy。SER 为(1.42±0.06)。见表1和图2。
表1 两组A549细胞经不同放射剂量照射后增殖抑制率的变化(±s)

表1 两组A549细胞经不同放射剂量照射后增殖抑制率的变化(±s)
组别 2 Gy 4 Gy 6 Gy 8 Gy 10 Gy放射线组 11.43±2.57 16.38±3.79 50.74±5.93 69.35±6.47 73.62±6.58放射线+CSEI(1.0 mg/ml)组 24.85±3.16 43.24±4.41 69.53±6.28 82.92±7.63 86.45±7.98
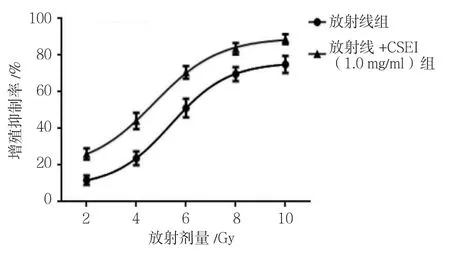
图2 两组A549细胞增殖率的变化趋势(±s)
2.3 CSEI 对A549细胞照射后集落形成的影响
平板克隆试验结果显示,空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)及放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞集落形成率分别为(48.88±8.37)%、(26.63±5.46)%、(30.50±7.12)%及(12.38±2.64)%,经单因素方差分析,差异有统计学意义(F=45.897,P=0.000),放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞集落形成率低于空白对照组、放射线组(5 Gy)及CSEI组(1.0 mg/ml)(P<0.05)。见图3、4。

图3 各组A549细胞克隆实验细胞集落
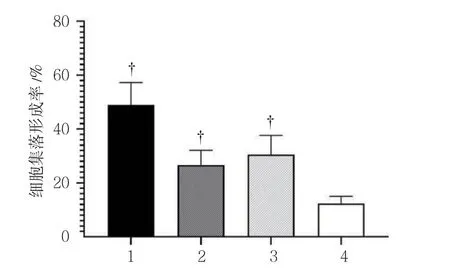
图4 各组A549细胞集落形成率比较(±s)
2.4 CSEI 对A549细胞照射后DNA双链断裂损伤的影响
中性彗星实验结果显示,空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)及放射线(5 Gy)+ CSEI(1.0 mg/ml)组细胞核拖尾细胞数、尾长及尾距,经单因素方差分析,差异有统计学意义(P<0.05),放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞核拖尾细胞数、尾长、尾距多于其他组(P<0.05)。见表2和图5。
2.5 CSEI 对A549细胞照射后凋亡活性的影响
流式细胞术结果显示,空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)、放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞凋亡率分别为(4.85±1.32)%、(38.76±6.53)%、(28.70±5.43)%、(56.74±8.79)%,经单因素方差分析,差异有统计学意义(F=99.198,P=0.000);放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞凋亡率高于其他组(P<0.05)。见图6、7。
表2 各组A549细胞的拖尾细胞数、尾长、尾距比较(n =200,±s)

表2 各组A549细胞的拖尾细胞数、尾长、尾距比较(n =200,±s)
注:①与空白对照组比较,P <0.05;②与放射线组(5 Gy)比较,P <0.05;③与CSEI(1.0 mg/ml)组比较,P <0.05。
组别 拖尾细胞数 尾长/μm 尾距/μm空白对照组 23.38±4.12 30.25±2.77 3.41±0.68放射线组(5 Gy)67.75±12.31 45.73±4.26 6.62±0.95 CSEI组(1.0 mg/ml)44.50±9.87 38.97±4.10 5.57±0.82放射线(5 Gy)+CSEI(1.0 mg/ml)组 120.63±27.65①②③ 72.58±4.73①②③ 26.34±1.76①②③F 值 54.359 164.159 715.423 P 值 0.000 0.000 0.000

图5 各组A549细胞的彗星图像(×400)
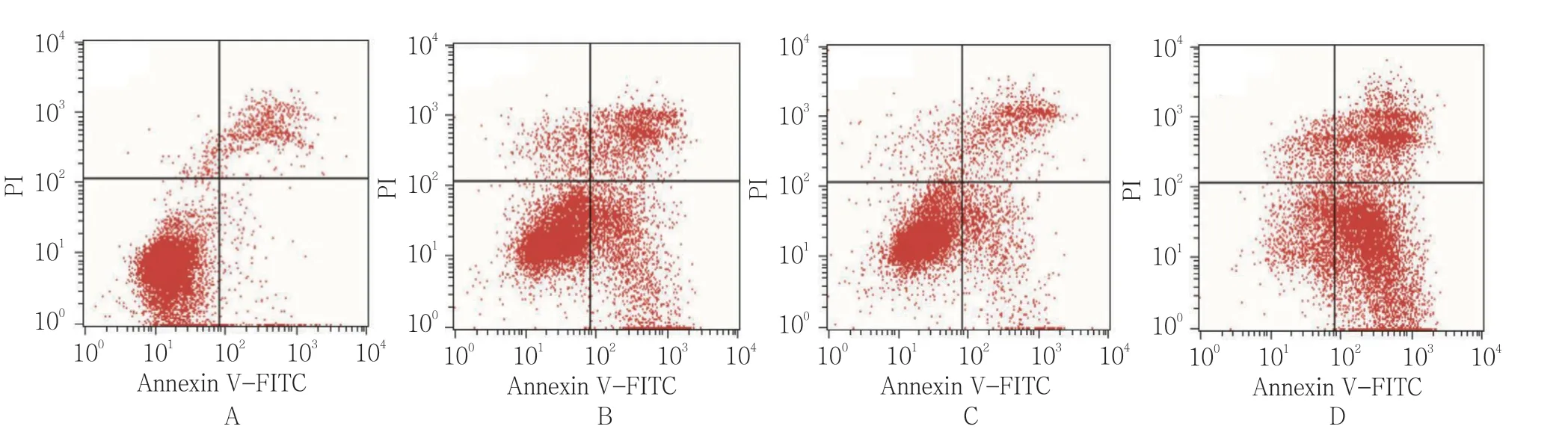
图6 CSEI和放射线对A549细胞凋亡活性的影响
2.6 CSEI 对A549细胞照射后细胞周期的影响
流式细胞术结果显示,空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)及 放 射 线(5 Gy)+ CSEI(1.0 mg/ml)组G1期、G2/M期和S期 细 胞比例比较,经单因素方差分析,差异有统计学意义(P<0.05),与空白对照组比较,放射线(5 Gy)+ CSEI(1.0 mg/ml)组G1期 细 胞和S期 细 胞 减 少(P<0.05);而G2/M期 细 胞 增 多(P<0.05)。见表3。
2.7 CSEI和放射线对A549细胞Bcl-2、Bax、Survivin及MDR1 蛋白表达的影响
Western blotting 检测结果显示,空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)及放射线(5 Gy)+CSEI(1.0 mg/ml)组 细 胞Bcl-2、Bax及Survivin 蛋白相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05),放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞Bcl-2和Survivin 蛋白相对表达量低于其他组(P<0.05);而Bax 蛋白相对表达量高于其他组(P<0.05)。空白对照组、放射线组(5 Gy)、CSEI组(1.0 mg/ml)及放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞MDR1 蛋白相对表达量比较,经单因素方差分析,差异无统计学意义(P>0.05)。见表4和图8。

图7 各组A549细胞凋亡率比较(±s)
表3 CESI和放射线对A549细胞周期的影响(±s)
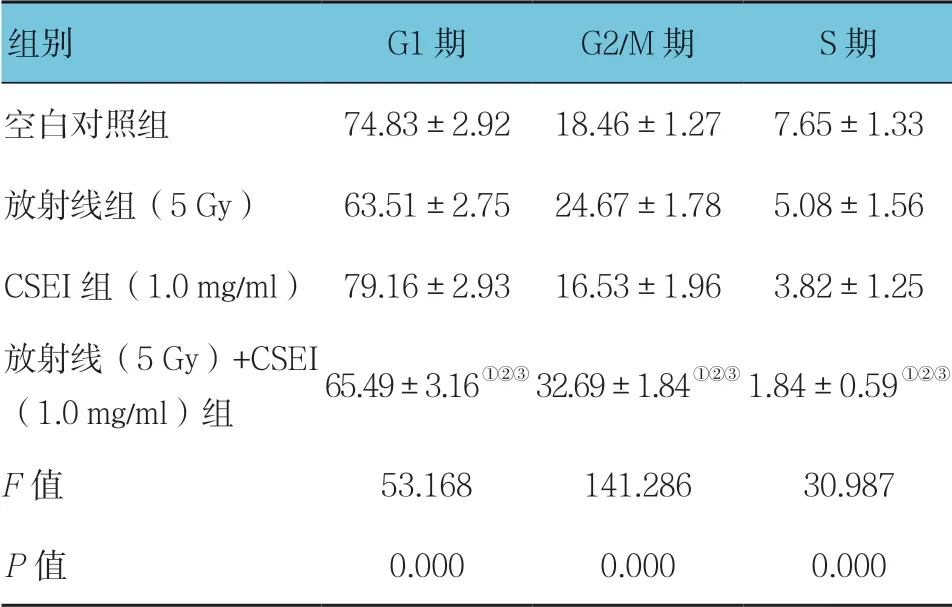
表3 CESI和放射线对A549细胞周期的影响(±s)
注:①与空白对照组比较,P <0.05;②与放射线组(5 Gy)比较,P <0.05;③与CSEI组(1.0 mg/ml)比较,P <0.05。
组别 G1期 G2/M期 S期空白对照组 74.83±2.92 18.46±1.27 7.65±1.33放射线组(5 Gy)63.51±2.75 24.67±1.78 5.08±1.56 CSEI组(1.0 mg/ml)79.16±2.93 16.53±1.96 3.82±1.25放射线(5 Gy)+CSEI(1.0 mg/ml)组 65.49±3.16①②③32.69±1.84①②③1.84±0.59①②③F 值 53.168 141.286 30.987 P 值 0.000 0.000 0.000
表4 各组A549细胞Bcl-2、Bax 、Survivin及MDR1 蛋白相对表达量比较(±s)

表4 各组A549细胞Bcl-2、Bax 、Survivin及MDR1 蛋白相对表达量比较(±s)
注:①与空白对照组比较,P <0.05;②与放射线组(5 Gy)比较,P <0.05;③与CSEI组(1.0 mg/ml)比较,P <0.05。
组别 Bcl-2 Bax Survivin MDR1空白对照组 1.35±0.26 0.36±0.10 0.94±0.23 0.86±0.17放射线组(5 Gy)0.78±0.15 0.47±0.12 0.59±0.16 0.94±0.25 CSEI组(1.0 mg/ml)0.69±0.20 0.65±0.17 0.60±0.18 0.94±0.24放射线(5 Gy)+CSEI(1.0 mg/ml)组 0.42±0.13①②③ 0.84±0.20①②③ 0.32±0.11①②③ 0.98±0.21 F 值 33.308 15.211 16.783 0.420 P 值 0.000 0.000 0.000 0.740
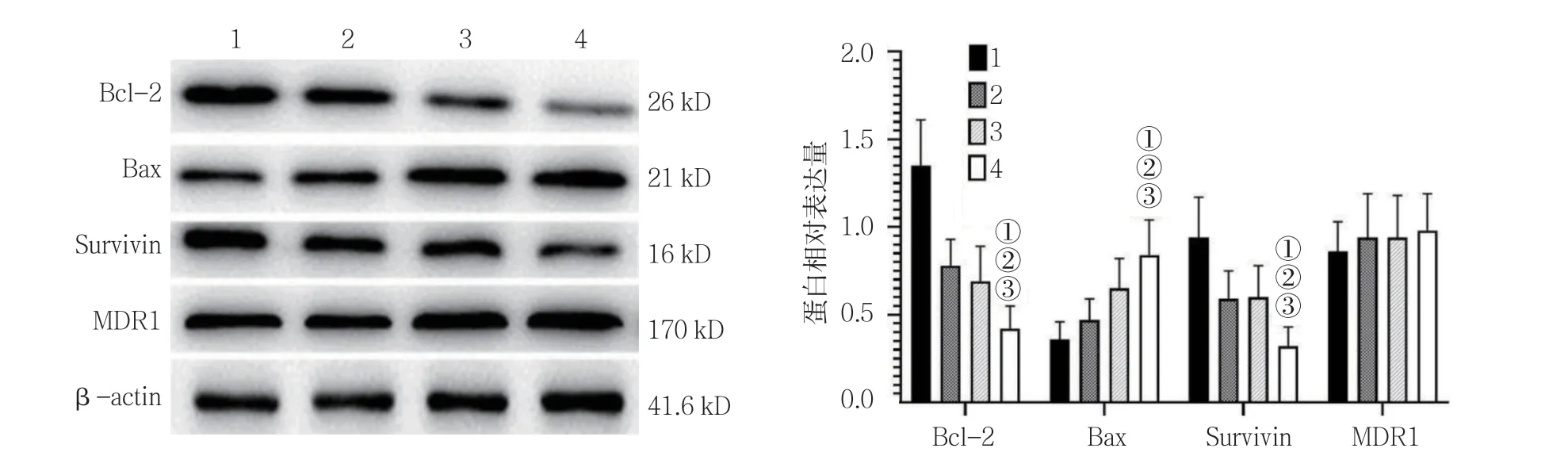
图8 各组细胞Bcl-2、Bax、Survivin及MDR1 蛋白的表达(±s)
3 讨论
放射治疗是肺癌最常用的治疗手段之一,基本原理是通过电离辐射诱导细胞核DNA 损伤,从而促进凋亡。多年临床实践证实,不同患者放射敏感性和耐受性差异较大,是影响患者预后,导致治疗失败的主要原因[6]。有学者提出放射治疗增敏剂的概念,主要为硝基咪唑类化合物及其衍生物[7]。但是由于化学合成制剂本身具有严重的毒副反应,从而限制其在临床的大力推广。CSEI在临床主要用于提高机体免疫力,同时可作为放射不良反应的辅助治疗用药。但是尚未有研究分析CSEI 可作为放射治疗增敏剂的可能。
理想的放射治疗增敏剂应该具有性质稳定、细胞毒性低、增敏作用可逆转等特点[8]。本研究中,首先通过MTT 法确定CSEI 最高无毒剂量为1.0 mg/ml。因此,笔者在后续实验中初步选定1.0 mg/ml 作为CSEI的用药剂量。进一步采用MTT 法,在放射线照射前2 h 先给予1.0 mg/ml CSEI 预处理,证实1.0 mg/ml CSEI可增加不同照射剂量对A549细胞增殖的抑制作用,辐射增敏比为(1.42±0.06);另外,放射线(5 Gy)+ CSEI(1.0 mg/ml)组细胞集落形成率低于空白对照组、放射线组(5 Gy)及CSEI组(1.0 mg/ml),从而推断1.0 mg/ml CSEI 对A549细胞具有放射增敏作用。
目前,关于放射增敏剂作用机制的研究主要集中在影响细胞周期、促进肿瘤细胞凋亡、靶向提高信号转导通路的敏感性及增加放射线对肿瘤细胞的原发性损伤等方面[9]。钱鹏飞等[10]学者通过临床研究证实,小牛脾提取物可提高晚期乳腺癌患者化学治疗的疗效,改善生活质量,减轻化学治疗相关的骨髓抑制毒副反应,增强机体的免疫功能,对晚期肿瘤患者临床化学治疗有积极地推进作用。程惠华等[11]学者也证实,CSEI 对接受同步放射治疗、化学治疗的宫颈癌患者在保护骨髓和提高生活质量等方面具有很好的作用。但是目前关于CSEI对放射治疗的增敏作用研究尚少。本研究中,关于CSEI 放射增敏机制的研究,首先通过中性彗星实验结果证实,放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞核拖尾细胞数、尾长及尾距较空白对照组、放射线组(5 Gy)及CSEI组(1.0 mg/ml)增加,说明1.0 mg/ml CSEI 增加A549细胞对放射线敏感性的机制可能与增加放射线诱导肿瘤细胞DNA 损伤有关。其次,通过流式细胞术检测还发现,放射线(5 Gy)+CSEI(1.0 mg/ml)组细胞凋亡率高于空白对照组、放射线组(5 Gy)或CSEI组(1.0 mg/ml),从而推断促进肿瘤细胞凋亡可能也是CSEI 放射治疗的增敏作用机制之一。另外有研究显示,处于不同细胞周期时相的细胞对放射线的敏感性不同,放射线主要是将细胞周期阻滞于M期和G1 末期,而对G0期细胞影响较小[12]。但是在本研究中,笔者发现CSEI组(1.0 mg/ml)G1期细胞增多,S期细胞数减少,说明CSEI 可特异性阻碍肿瘤细胞由G1/G0期向G2期和S期转化,而且放射线(5 Gy)+CSEI(1.0 mg/ml)组G1期细胞和S期细胞减少,G2/M期细胞增多,说明CSEI 可能与放射治疗产生协同作用,阻止肿瘤细胞向DNA 合成期(S期)转化,从而提高放射治疗的疗效。
笔者还进一步从蛋白分子水平分析CSEI 对A549细胞放射治疗增敏作用的主要机制。Bcl-2 家族蛋白和Survivin都属于重要的细胞凋亡相关蛋白,Bcl-2属于抗凋亡因子,主要通过调节细胞色素C的释放来促进Bax或抑制Bcl-2 诱导细胞凋亡[13]。当抗凋亡基因Bcl-2表达上调时,Bcl-2与Bax 形成异源二聚体,从而抑制细胞凋亡[14]。而Survivin 也属于凋亡抑制蛋白[15],在多数肺癌组织中呈高表达,是目前肿瘤治疗最重要的分子靶标之一[16]。余江涛等[17]学者证实,Survivin和Bcl-2 蛋白在肿瘤组织中的表达呈正相关。沉默Survivin基因表达后,可诱导肿瘤细胞凋亡和Bcl-2 蛋白表达下调。本研究中,CSEI与放射线联合作用,可抑制Bcl-2和Survivin 蛋白表达;同时上调Bax 蛋白表达水平。黎喜梅等[18]学者证实,放射治疗可诱导肿瘤组织中MDR1 蛋白表达上调,从而降低肿瘤细胞对放射线的敏感性。本研究中,通过Western blotting 并未发现CSEI 对MDR1 蛋白表达的影响,但是并不能说明MDR1 蛋白分子未参与CSEI和放射线对肿瘤细胞增殖的抑制作用。
综上所述,1.0 mg/ml CSEI 可增加人肺腺癌细胞系A549 对放射线的敏感性,其作用机制可能与影响肿瘤细胞周期、促进肿瘤细胞凋亡及细胞核DNA双链损伤等有关。从而为CSEI 用于放射治疗增敏提供一定的实验依据,但是是否可以作为放射治疗增敏剂用于临床,尚需要更全面、更系统的实验研究。

