基于光谱技术的维生素B12与大豆分离蛋白相互作用分析
李 杨 李明达 王中江 郑 丽 滕 飞
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
维生素B12又被称为钴胺素,是唯一含有金属元素的水溶性维生素,也是B族中最晚发现的一种。作为一种重要的营养因子,维生素B12参与叶酸转化、蛋氨酸合成等生化反应,维生素B12缺乏会导致恶性贫血和神经疾病等[1]。维生素B12的稳定性主要受到光、热、溶液pH值的影响,在食品加工过程中常转变为各种类似物[2]。根据《中国居民膳食营养素参考摄入量》[3],成人维生素B12推荐摄取量为2.4 μg/d,该营养素人体自身不能合成,必须从食物中摄取,动物性产品(如鱼或贝类、鸡蛋、动物肝脏等)是其主要摄取源[4]。由于维生素B12易损失、不稳定,构建天然保护机制是防止其被破坏的最直接手段,也是高效利用维生素B12、开发强化食品、防止维生素B12缺乏症的关键。
食品级蛋白质是生物活性化合物的潜在载体,大豆蛋白是目前唯一含有人体所需8种氨基酸、且含量满足人体需求的植物蛋白,因其高营养价值和良好的消化性和功能性能(乳化性、凝胶性、起泡性等)而被广泛应用于食品加工中[5]。同时,大豆蛋白分子肽链中含有丰富的疏水氨基酸残基和带电氨基酸残基,可通过疏水相互作用、静电作用和氢键作用等与水溶性营养成分结合,不仅能很好地传递和运载水溶性活性物质,还能够提高营养成分的生物利用率,甚至可以提高蛋白的某些功能特性[6]。文献[7]研究发现,热处理的大豆蛋白与花青素通过疏水作用结合后,提高了蛋白的消化率。文献[8]将大豆蛋白与叶酸复合制备纳米凝胶,可使叶酸维持天然结构及生物活性,并在肠道环境中迅速释放。文献[9]研究发现,季铵盐改性后的大豆蛋白与抗坏血酸复合,水溶性维生素表现出较高结合率,同时改善大豆蛋白的溶解性。
食品中的维生素B12以蛋白结合型存在,研究食源蛋白与维生素B12的相互作用对提高维生素B12稳定性至关重要。已有文献对维生素B12与蛋白质的相互作用进行了研究。文献[10]研究了维生素B12和牛血清白蛋白(BSA)复合物在不同pH值条件下的结合亲和性,结果表明:维生素B12在酸性和碱性(pH值2.5、3.5、5.0和9.0)条件下与BSA的结合能力低于模拟生理条件(pH值 7.4),并且相互作用使BSA的二级和三级结构发生了显著的变化。文献[11]通过荧光光谱法和紫外吸收光谱法研究了生理条件下维生素B12与牛血清白蛋白之间的相互作用,结果表明,维生素B12对牛血清白蛋白的荧光有猝灭作用,其猝灭过程属于静态猝灭并且二者的结合位点位于色氨酸附近。文献[12]将乳清蛋白与维生素B12复合,维生素B12的光热稳定性提高了10%~30%。可见,通过维生素B12与蛋白结合可提高维生素B12的稳定性,但具有代表性的食源蛋白(大豆分离蛋白)与维生素B12的相互作用研究尚未见相关报道。
本文利用光谱技术(荧光光谱、紫外光谱、红外光谱、圆二色谱)研究大豆分离蛋白与维生素B12的相互作用对大豆分离蛋白结构的影响,以期为提高维生素B12稳定性、开发维生素B12营养强化食品提供理论基础。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕,山东禹王生态食业有限公司;维生素B12,美国Sigma试剂公司;氢氧化钠、盐酸等为国产分析纯试剂。
1.2 仪器与设备
FD-1C型冷冻干燥机,北京德天佑科技发展有限公司;FJ-200型高速分散均质机,上海标本模型厂;LGR20-W型台式高速冷冻离心机,北京京立离心机有限公司;F-4500型荧光分光光度计,日本HITACHI公司;TU-1800型紫外可见分光光度计。
1.3 试验方法
1.3.1大豆分离蛋白制备
参照文献[13]的方法并稍作修改,将低温脱脂豆粕与去离子水按照液料比10 mL/g混合后,用2 mol/L NaOH溶液调pH 值至8.0,室温(20℃)搅拌2 h后,溶液于9 000g离心30 min,取上清液用2 mol/L HCl溶液调pH 值至4.5。溶液静置2 h后于7 500g离心30 min 得到蛋白沉淀,将蛋白沉淀溶于去离子水后洗涤3次,用2 mol/L NaOH调溶液的pH值至7.0。最后将蛋白溶液倒入平皿中冷冻干燥后得粉末状大豆分离蛋白,储藏备用。
1.3.2大豆分离蛋白-维生素B12复合物制备
参照文献[12]的方法并稍作修改,取1.2 mg大豆分离蛋白溶于磷酸盐缓冲溶液中(0.01 mol/L,pH值7.4),配制质量浓度为12 mg/mL的大豆分离蛋白溶液,于4℃下储存。取16 mg维生素B12溶于磷酸盐缓冲溶液中(0.01 mol/L,pH值7.4),配制质量浓度为0.4 mg/mL的维生素B12溶液,于4℃下储存。将大豆分离蛋白溶液稀释至300 μg/mL,分别与不同质量浓度的维生素B12(0、10、20、28、40、50 μg/mL)混合,室温下黑暗搅拌1 h,得到大豆分离蛋白-维生素B12复合物。
1.3.3荧光光谱测定
参照文献[14]的测定方法并稍作修改,大豆分离蛋白-维生素B12复合物的内源性荧光光谱采用F-4500型荧光分光光度计进行扫描。将复合物样品用0.01 mol/L的磷酸盐缓冲液(pH值7.4)配制成质量浓度为0.15 mg/mL的溶液。激发波长设定为290 nm,发散波长扫描范围为300~500 nm,激发狭缝宽度为5 nm,发射狭缝宽度也为5 nm,扫描速度为240 nm/min。同步荧光光谱:室温下,分别固定Δλ=15 nm和Δλ=60 nm,其中Δλ表示激发波长和发射波长彼此间保持固定的波长间隔。
1.3.4荧光猝灭机理
参照文献[15]的测定方法并稍作修改,将大豆分离蛋白-维生素B12复合物样品等分为3份,分别置于25、33、41℃的恒温水浴锅中保温10 min,利用荧光光谱仪连续扫描并记录测定样品的荧光强度。光谱参数同上,重复扫描3次。
1.3.5紫外光谱测定
参照文献[16]的测定方法并稍作修改,采用紫外分光光度计扫描大豆分离蛋白-维生素B12复合物的紫外光谱。用0.01 mol/L的磷酸盐缓冲液(pH值7.4)将复合物样品稀释为0.15 mg/mL后,于室温条件下进行紫外光谱扫描,扫描范围250~350 nm,扫描速度为200 nm/min,分辨率为2 nm。
1.3.6红外光谱测定
参照文献[17]的测定方法并稍作修改,称取大豆分离蛋白-维生素B12复合物1 mg,加入溴化钾100 mg,充分混匀压片后于室温进行红外光谱扫描。设定波谱的扫描范围:400~4 000 cm-1,分辨率:4 cm-1,扫描64次,利用Peakfit 4.2.0软件处理谱图并通过积分面积计算各二级结构的相对含量。
1.3.7圆二色谱测定
将大豆分离蛋白-维生素B12复合物溶解在磷酸盐缓冲溶液中,将蛋白质量浓度配制为0.5 mg/mL,将样品溶液在190~250 nm远紫外区进行扫描,扫描速度为 60 nm/min,分辨率为0.2 nm,响应时间为0.25 s,狭缝宽度为1 nm。使用CDpro软件拟合蛋白质二级结构的组成与含量。
1.4 数据处理
图表制作采用Origin Pro 8.5软件,使用SPSS 19.0进行ANOVA差异显著性分析和方差分析(P<0.05为显著性差异)。每个试验重复3次,结果表示为平均值±标准差。
2 结果与分析
2.1 荧光光谱分析
大豆蛋白内部因含有不同的发色基团如色氨酸(Trp),酪氨酸(Tyr)和苯丙氨酸(Phe)而表现出内源荧光特性[18]。在激发波长为290 nm时,主要考虑色氨酸和酪氨酸。文献[19]指出,蛋白的最大发射波长λmax与色氨酸等残基所处的微环境密切相关,当最大发射波长λmax超过330 nm时,残基处于外部极性环境中,相反,则表示残基处于内部非极性环境。大豆分离蛋白与维生素B12复合体系的荧光光谱如图1所示,当蛋白浓度固定时,随着维生素B12添加量的增大,大豆分离蛋白的荧光强度逐步降低,说明维生素B12对大豆蛋白的内源荧光产生了猝灭作用。并且大豆分离蛋白的最大发射波长λmax由340.6 nm蓝移至334.6 nm,蓝移了6 nm,以上现象说明维生素B12与大豆分离蛋白发生了结合,使其构象发生了变化,色氨酸和酪氨酸的内部微环境也趋向改变,表现出一种由极性环境向非极性环境转变的趋势,可能是由于维生素B12与蛋白表面的亲水性侧链残基相互作用,降低荧光强度,从而改变了色氨酸残基的微环境[20]。文献[21]在研究维生素B12与牛血清白蛋白(BSA)结合机理时也发现了最大发射波长蓝移现象,可能的原因为维生素B12与牛血清白蛋白表面第134位的色氨酸残基结合改变了其所处微环境的极性。而文献[22]报道花青素与大豆分离蛋白结合后,蛋白的最大发射波长λmax发生红移,肽链趋于伸展。这可能是由于维生素B12含有一个咕啉大环,分子量较大,结构复杂,与蛋白的结合方式不同,从而导致蛋白分子的结构变化差别较大。

图1 不同维生素B12质量浓度下大豆分离蛋白与维生素B12复合体系的荧光光谱谱图Fig.1 Fluorescence spectra of soybean protein isolate and vitamin B12 composite system
2.2 荧光猝灭机理
荧光猝灭机理一般可以分为静态猝灭和动态猝灭两种作用形式。静态猝灭主要是指猝灭剂与荧光物质之间相互作用形成复合物而导致荧光强度下降,温度升高后,猝灭常数(即Stern-Volmer曲线斜率)下降;动态猝灭则相反,主要是指猝灭剂与荧光物质间相互碰撞产生一定程度的电子转移或能量转移,导致荧光强度减弱,该过程与扩散效应相关,温度上升促进了分子碰撞的剧烈程度,因此随着温度上升,动态猝灭常数增大[23]。根据Stern-Volmer方程[24]计算不同温度条件下的猝灭常数,从而可以初步判断该反应的荧光猝灭机制[25]为

(1)
式中F0——大豆分离蛋白中未加入猝灭剂(维生素B12)时的荧光强度
F——加入猝灭剂时的荧光强度
Kq——双分子猝灭速率常数,L/(mol·s)
Ksv——猝灭常数,L/mol
Q——猝灭剂浓度,mol/L
τ0——无猝灭剂时生物大分子的平均荧光寿命,取10-8s
根据Stern-Volmer方程,以Q为自变量,以F0/F为因变量拟合一次函数方程,如图2所示。曲线斜率代表猝灭常数Ksv,进一步求解可得Kq。

图2 不同温度条件下大豆分离蛋白与维生素B12复合物的Stern-Volmer曲线Fig.2 Stern-Volmer plots of SPI interacting with vitamin B12 at three temperatures
由图2可知,Stern-Volmer方程的曲线斜率随着温度的上升而逐渐降低,可以推断维生素B12对大豆分离蛋白的荧光猝灭机理属于静态猝灭,一般来说,各类猝灭剂对生物大分子的最大猝灭速率常数Kq为2×1010L/(mol·s),而表1中维生素B12对大豆分离蛋白的荧光猝灭速率常数均大于2×1010L/(mol·s),并且随着温度上升,Kq逐渐降低,更有力地证明了维生素B12对大豆分离蛋白的猝灭方式是由于维生素B12与大豆分离蛋白相互作用形成了基态配合物而引发了静态猝灭[26]。
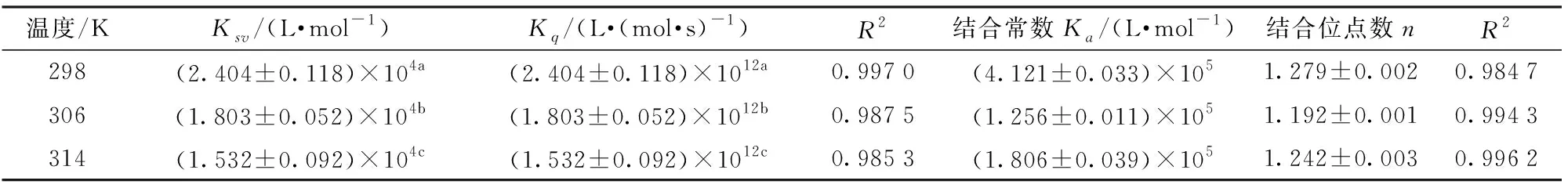
表1 维生素B12与大豆分离蛋白复合物的荧光猝灭速率常数、结合位点数、结合常数Tab.1 Fluorescence quenching constants, binding sites and apparent binding constants of vitamin B12-SPI complex
注:同列不同字母表示差异显著,下同。
由图2和表1已知维生素B12对大豆分离蛋白的猝灭机制为静态猝灭,二者的结合常数Ka和结合位点数n满足公式
(2)

图3 不同温度下维生素B12猝灭大豆分离蛋白的双对数曲线Fig.3 Double logarithmic curves of vitamin B12 quenched soybean protein isolate at different temperatures
以lg((F0-F)/F)对lgQ作图,不同温度下维生素B12猝灭大豆分离蛋白的双对数曲线如图3所示。所得的曲线斜率为维生素B12与大豆分离蛋白的结合位点数n,将截距换算为结合常数Ka。根据表1数据显示,维生素B12与大豆分离蛋白在298、306、314 K温度下作用时,二者间的结合常数为4.121×105、1.256×105、1.806×105L/mol,表明二者存在较强的相互作用。并且维生素B12与大豆分离蛋白在3种不同温度下的结合位点数都接近于1,说明维生素B12与大豆分离蛋白之间存在一个结合位点。文献[21]证明了维生素B12与牛血清白蛋白也存在一个结合位点。
小分子物质与蛋白质之间的作用力主要为疏水作用力、静电相互作用、氢键以及范德华力。通过Vant Hoff 方程,可计算出热力学参数值。维生素B12与大豆分离蛋白之间的相互作用符合热力学公式
(3)
ΔG=-RTlnKa=ΔH-TΔS
(4)
式中 ΔH——焓变,kJ/mol
ΔS——熵变,kJ/(mol·K)
ΔG——生成自由能变,kJ/mol
R——气体常数,取8.314 J/(mol·K)
T——温度,K
当温度变化不大时,反应的ΔH可看作常数。
根据文献[27]总结的小分子与生物大分子反应的热力学参数变化判断二者间主要作用力的类型规律:当ΔH>0且ΔS>0时,为疏水作用力;ΔH<0且ΔS<0时,为范德华力和氢键作用;ΔH<0且ΔS>0时,为静电相互作用。
由表2可知,维生素B12与大豆分离蛋白的自由能变小于0,说明这是一个自由能降低的自发过程,ΔH<0且ΔS<0,表明维生素B12与大豆分离蛋白之间的主要作用力是范德华力和氢键。文献[28]在研究花青素与小麦蛋白的相互作用机理发现,中性条件下黑豆皮中的花青素(矢车菊素-3-O-葡萄糖苷,C3G)与麦谷蛋白主要通过范德华力和氢键作用结合。

表2 维生素B12与大豆分离蛋白复合物的热力学参数值Tab.2 Thermodynamic parameters of complex of vitamin B12 and soybean protein isolate
2.3 同步荧光光谱分析
同步荧光光谱通常应用于小分子和生物大分子相互作用的研究中,通过测量发射波长偏移研究对应氨基酸附近环境的极性情况从而反映小分子对生物大分子物质构象变化的影响[29]。通过将激发波长和发射波长之差Δλ固定在15 nm或60 nm,分别对大豆分离蛋白中的酪氨酸和色氨酸残基周围的极性变化进行分析[30]。

图4 不同维生素B12质量浓度下大豆分离蛋白与维生素B12复合体系的同步荧光光谱Fig.4 Synchronous fluorescence spectra of soybean protein isolate and vitamin B12 complex system
维生素B12与大豆分离蛋白相互作用的同步荧光光谱如图4所示,随着维生素B12质量浓度的增加,酪氨酸残基和色氨酸残基的荧光强度逐渐降低,在Δλ=60 nm的情况下,同步荧光峰有轻微的蓝移,从282 nm蓝移至279 nm,而在Δλ=15 nm时,同步荧光峰无明显移动,可判断维生素B12对酪氨酸残基的微环境无明显改变,而色氨酸残基所处的微环境疏水性增加,极性降低,表明维生素B12与大豆分离蛋白结合位点更接近于色氨酸残基,推测可能的原因为维生素B12与大豆分离蛋白的相互作用可能诱导色氨酸附近的多肽链形成折叠,从而微环境疏水性进一步增加[21]。文献[11]在研究维生素B12与牛血清白蛋白的相互作用时也得出了相似的结论。
2.4 紫外光谱分析
根据蛋白质的色氨酸、酪氨酸和苯丙氨酸残基的紫外吸收峰不同,可以通过紫外光谱仪分析蛋白三级结构的变化[18]。由图5可知,大豆分离蛋白在280 nm附近存在紫外吸收峰,而维生素B12在361、520、550 nm处存在紫外吸收峰,随着维生素B12质量浓度的增大,大豆分离蛋白和维生素B12复合体系的紫外最大吸收峰由288 nm蓝移到284 nm,说明维生素B12对大豆分离蛋白的结构产生了影响,色氨酸所处的微环境疏水性增强,这与荧光光谱分析中蛋白结构变化结果一致。并且大豆分离蛋白和维生素B12均为芳香族化合物,这种结构变化可能会促使其参与非共价的π-π堆积作用,文献[31]也报道了大豆分离蛋白构象的变化与分子中色氨酸残基和酪氨酸残基芳香杂环的π-π*跃迁有关。

图5 大豆分离蛋白与维生素B12复合体系的紫外光谱图Fig.5 UV spectra of soybean protein isolate and vitamin B12 composite system
2.5 红外光谱分析
红外光谱是一种分析蛋白质二级结构的光谱技术[32]。通过红外光谱可以进一步考察蛋白质构象的变化。加入不同质量浓度维生素B12的大豆分离蛋白红外光谱如图6所示。酰胺Ⅰ带红外吸收峰的变化主要反映了蛋白质二级结构的变化。根据已有的研究表明:蛋白质二级结构与各子峰间的对应关系为:波数1 646~1 664 cm-1处对应的结构为α-螺旋;波数1 615~1 637 cm-1和1 682~1 700 cm-1处对应的结构为β-折叠;波数1 664~1 681 cm-1处对应的结构为β-转角;波数1 637~1 645 cm-1处对应的结构为无规则卷曲[33]。由图6可知,维生素B12加入后,大豆分离蛋白的酰胺I带发生轻微红移(由1 633.3 cm-1红移到1 635.8 cm-1)而酰胺Ⅱ带基本没有移动,可能是因为维生素B12与大豆蛋白发生了相互作用,通过氢键结合形成复合物,导致大豆分离蛋白肽链重排,最终导致二级结构的变化[34]。此外,大豆蛋白酰胺Ⅰ带的强度有所减弱,说明α-螺旋的含量在加入维生素B12后明显增加。文献[31]研究大豆分离蛋白与花青素的相互作用发现,蛋白的酰胺I带发生了红移引起二级结构发生改变。

图6 不同维生素B12质量浓度下大豆分离蛋白-维生素B12复合物中大豆分离蛋白的红外光谱图Fig.6 Infrared spectra of SPI in soybean protein isolate and vitamin B12 complex
2.6 圆二色谱分析
圆二色谱是一种通过检测水溶性蛋白进而计算各种蛋白质二级结构含量的技术。加入维生素B12前后,大豆蛋白的二级结构含量如表3所示。随着维生素B12质量浓度的增大,大豆蛋白二级结构含量均发生了明显的变化。α-螺旋和β-转角相对含量逐渐升高,β-折叠和无规则卷曲相对含量逐渐降低,这表明β-折叠和无规则卷曲结构逐渐向α-螺旋和β-转角结构转变,可能是由于维生素B12与大豆蛋白表面的亲水性侧链结合,改变了蛋白的构象,一定程度上提高了蛋白质聚合程度[35]。圆二色谱的结果证明了维生素B12的结合改变了大豆蛋白的构象,改变了荧光基团周围的局部微环境,形成了更有组织的构象,与红外光谱得出的结果相一致。

表3 大豆分离蛋白-维生素B12复合物中大豆分离蛋白二级结构相对含量Tab.3 Relative content of SPI secondary structure in soybean protein isolate and vitamin B12 complex
3 结论
(1)荧光光谱分析表明,维生素B12对大豆分离蛋白具有荧光猝灭作用,猝灭机制为静态猝灭,二者主要通过范德华力和氢键作用结合,结合位点数为1。
(2)同步荧光光谱分析表明,维生素B12与大豆分离蛋白的结合位点更接近色氨酸残基;紫外吸收
光谱分析表明,维生素B12使得大豆蛋白中色氨酸残基所处微环境发生变化,疏水性增强,改变了大豆蛋白的构象。
(3)红外光谱和圆二光谱分析表明,维生素B12的加入改变了大豆分离蛋白的二级结构,具体表现为β-折叠和无规则卷曲相对含量减少、α-螺旋和β-转角相对含量增加。

