双酚芴暴露于MCF-7乳腺癌细胞可引起细胞全基因组表达谱改变
齐香荣,黄苑,李桐,王培龙,苏晓鸥
中国农业科学院 农业质量标准与检测技术研究所,北京 100081
内分泌干扰物是干扰人类和动物生殖和发育的化学物质[1-2]。近年来,双酚A(bisphenol A,BPA)已广泛用于聚碳酸酯塑料和环氧树脂的制造,并成为应用最广泛的内分泌干扰物之一[3-4]。研究发现,BPA可以通过各种途径进入人和动物体内[5-6],通过发挥类雌激素活性干扰机体的正常生理活动,对机体产生广泛的毒性作用,包括对生殖系统和神经系统等,尤其对婴幼儿的生长发育存在潜在危害[7-9]。这些缺点使得BPA在各个国家和地区的应用受到限制。部分国家已经禁止了BPA在婴幼儿奶瓶以及食品包装材料中的使用[10]。在这种情况下,一些BPA替代品在商业生产中引起了越来越多的关注。
双酚芴,学名9,9-双(4-羟苯基)芴[9,9-bis(4-hydroxyphenyl)fluorene,BHPF],是BPA的替代物之一,因其特殊的化学结构可以提升聚合物的耐热性,从而被广泛用于新型聚碳酸酯塑料产品的合成,在航空航天、汽车制造、电子和医疗器械等行业中得到普遍应用。此外,BHPF也用于与食物接触材料或容器的生产,用于生产所谓的“不含BPA”的塑料产品。然而,近几年的研究结果显示该化合物也对人体有潜在危害。Zhang等发现BHPF存在于“不含BPA”的塑料瓶和人的血清中[11]。此外,BHPF能减轻子宫重量,引起子宫内膜萎缩,对妊娠有不良影响,提示BHPF具有抗雌激素作用;急性接触BHPF会导致一系列不良影响,如干扰卵母细胞成熟、降低卵母细胞质量等[12],并对不同物种的卵母细胞具有广泛的毒性作用[13];改变斑马鱼幼鱼的睡眠/觉醒行为[14],引起发育异常,延缓心脏形态发生,损害心脏收缩力,BHPF对水生生物的安全构成不可忽视的威胁[15];小鼠暴露于BHPF,可在不同阶段对小鼠的神经行为造成不同程度的破坏[16]。这些结果说明动物和人类能够暴露于双酚芴,且双酚芴可能会对生物体健康产生潜在危害。因此,有必要进一步评价BHPF在体内外的毒性效应及毒性机制,评估其对人体的潜在风险,以指导其在工业生产中的合理应用。
常用的毒性评价方法有动物模型和体外模型2种。体外研究中的细胞培养实验相比于动物模型,具有高通量、低成本的优点,并可通过化合物诱导的细胞增殖情况探讨其雌激素效应[17]。MCF-7乳腺癌细胞雌激素受体表达阳性而且对雌激素敏感,广泛应用于环境雌激素(例如双酚类、类固醇类、多氯联苯类、二噁英类等化合物)的检测与评价。MCF-7细胞增殖试验是国外最常用的检测环境雌激素的方法之一,具有灵敏度高、可同时检测多种环境雌激素、快速简便的特点。因此,本研究选用经典的模式细胞MCF-7对双酚芴进行体外研究,旨在阐明双酚芴对MCF-7细胞的毒性效应及毒性机制。分析了不同浓度双酚芴对细胞存活率、细胞内活性氧(reactive oxygen species,ROS)及细胞全基因组mRNA表达谱的影响;并通过对差异基因进行KEGG富集通路分析,将差异表达基因富集到相应的细胞信号通路,探讨双酚芴对细胞的分子毒性机制,为进一步验证双酚芴对细胞的毒性机制提供参考依据。
1 材料与方法
1.1 材料
人乳腺癌细胞MCF-7购自商城北纳创联生物科技公司(BNCC);双酚芴、雌二醇(17-β-estradiol,E2)购自Sigma公司;胰酶、青链霉素双抗、碳吸附血清、DMEM高糖培养基均购自中科迈晨(北京)科技有限公司;CellTiter 96 Aqueous One Solution Cell Proliferation Assay(MTS)及 TRIzol试剂购自Promega公司;活性氧检测试剂盒(DCFHDA探针)购自上海碧云天生物技术有限公司;人类4×44K基因表达微阵列v2芯片购自Agilent公司;RNeasy Mini Kit购自Qiagen公司。
1.2 细胞增殖实验
MCF-7细胞消化后按10 000/孔接种96孔细胞培养板,于37℃、5% CO2细胞培养箱中培养24 h,至约80%成片。弃掉培养基,用PBS轻轻洗一次,加入含10%碳吸附血清的无酚红DMEM培养基及不同浓度的双酚芴进行处理,分别设置10-5~10-12mol/L 的双酚芴、阳性对照 E2(10-9mol/L)以及不加药阴性对照,每个浓度双酚芴及对照均设置6个复孔。继续培养24 h后,加入20 μL/孔CellTiter 96 Aqueous One Solution Cell Proliferation Assay试剂盒中的MTS试剂,于细胞培养箱中37℃孵育3 h,酶标仪测定D490nm值,计算各组平均D值和细胞相对存活率。细胞相对存活率(%)=(D暴露组-D空白对照)/(D对照组-D空白对照)×100%。实验数据以x±SD表示,采用t检验,双样本等方差假设进行统计分析,设定检验水准α=0.05。
1.3 ROS检测
MCF-7细胞消化后接种6孔细胞培养板,于37℃、5% CO2细胞培养箱内培养24 h至约80%成片。弃掉培养基,用PBS轻轻洗一次,加入含10%胎牛血清的DMEM培养基及不同浓度的双酚芴进行处理,分别设置10-5~10-10mol/L的双酚芴及不加药阴性对照,每个浓度双酚芴及对照均设置3个复孔。继续培养24 h,弃掉培养基,收集细胞,用无血清培养基洗涤一次。采用ROS检测试剂盒,流式细胞仪检测。实验数据以x±SD表示,采用t检验,双样本等方差假设进行统计分析。
1.4 全基因组表达谱分析
1.4.1 BHPF细胞暴露及细胞收获 MCF-7细胞消化后接种75 cm2细胞瓶,传代后24 h(约80%成片)弃掉培养基,加入不同浓度的双酚芴进行处理,设置不加药对照。继续培养24 h后弃掉培养液,加入10 mL/瓶TRIzol试剂,反复吹打几次后收获细胞,-70℃保存备用。
1.4.2 芯片杂交 收获细胞,提取总RNA,用Nano Drop ND-1000定量RNA,标准变性凝胶电泳评估RNA的完整性。样品标记和芯片杂交根据Agilent One-Color Microarray-Based Gene Expression Analysis实验方案(AgilentTechnology)执行。每个样品的总RNA被线性扩增,使用Cy3-UTP 标记;用 RNeasy Mini Kit(Qiagen)纯化标记的cRNAs,并用Nano Drop ND-1000检测浓度和活性;用人类4×44K基因表达微阵列v2芯片杂交后进行洗涤、固定并扫描。
1.4.3 数据分析 用Agilent Feature Extraction软件(v11.0.1.1)获得芯片图并读值,得到原始数据;用Gene Spring GXv12.1软件(Agilent Technologies)对原始数据进行Quantile标准化和数据处理;原始数据标准化后经过筛选高质量探针进行进一步分析。2组样品间具有统计学意义的差异表达基因通过散点图筛选;2个样品间差异表达基因通过Fold Change筛选;用R脚本进行层次聚类;用标准的富集计算方法进行Pathway分析。
2 结果
2.1 细胞增殖实验
不同浓度(10-5~10-12mol/L)的BHPF作用于MCF-7细胞24 h后,对细胞存活率的影响见图1。10-5mol/L的BHPF作用于MCF-7细胞,与对照组相比可以显著降低细胞的存活率(P=0.002);E2阳性对照组具有增殖效应,与对照组相比具有统计学差异(P=0.023);其他浓度组与对照组相比无统计学差异。
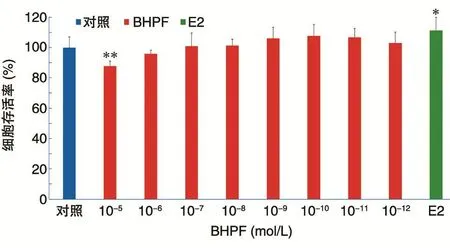
图1 不同浓度的BHPF作用MCF-7细胞24 h后的细胞存活率
2.2 细胞内ROS检测
不同浓度(10-5~10-10mol/L)的 BHPF作用于MCF-7细胞24 h后检测细胞内ROS水平,结果如图 2。与对照组相比,10-5、10-6mol/L BHPF 组ROS 水平显著降低;10-7、10-8、10-9、10-10mol/L BHPF组ROS水平均显著升高。
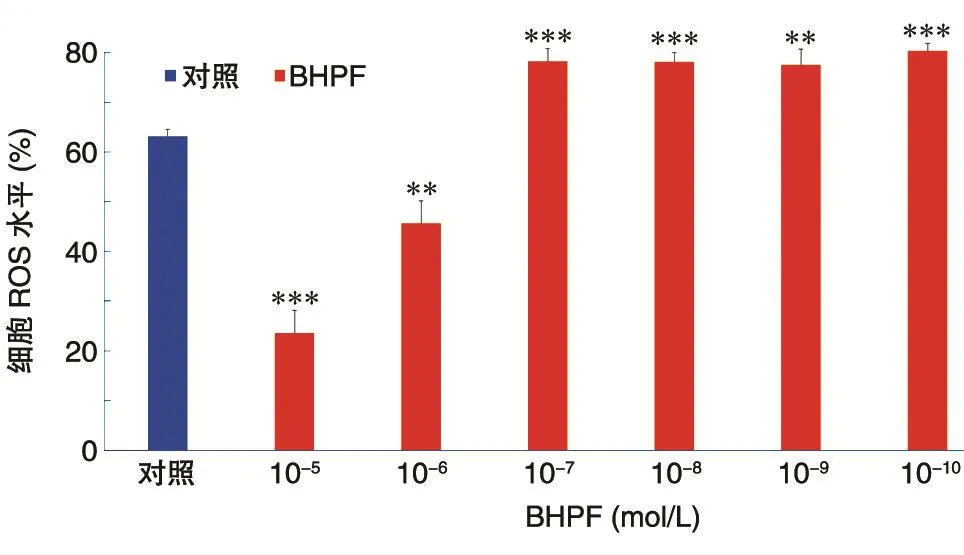
图2 不同浓度的BHPF作用于MCF-7细胞24 h后细胞ROS水平
2.3 BHPF引起MCF-7细胞全基因组mRNA表达谱改变
2.3.1 差异表达mRNA分析 总计检测到30 908条mRNA,用t检验进行差异mRNAs筛选,以差异倍数≥2.0为筛选标准,各浓度筛选出表达上调、下调及无明显差异的mRNA数详见图3。利用实验组与对照组的差异倍数>2为横纵坐标的设定值,给出差异表达mRNA的散点图(图3)。
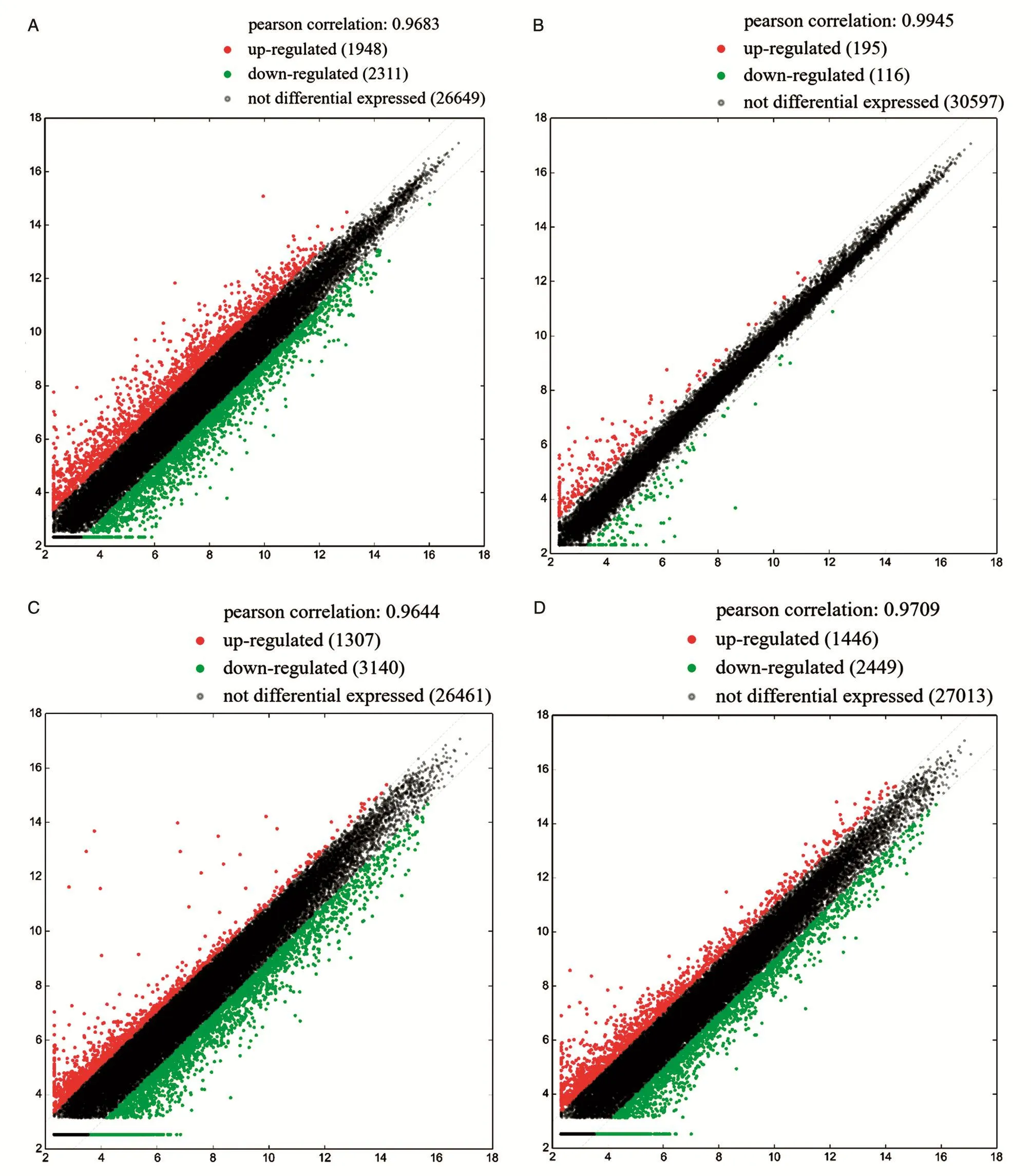
图3 BHPF各浓度组与对照组相比差异表达mRNA散点图
2.3.2 差异表达mRNA聚类分析 一般来说,同一类样品能通过聚类出现在同一个簇中,聚在同一个簇的样品可能具有相似的生物学性质。本研究所展示的聚类图的上方分枝结构代表样本的聚类情况,聚类图下方代表样本的分组信息,中间的每一个条形代表检测到的mRNA,其中红色代表相对高的表达量,绿色代表相对低的表达量。根据芯片检测到的mRNA数及差异表达的mRNA数,分别做出对应的聚类图,详见图4。

图4 BHPF各浓度组与对照组相比差异表达mRNA聚类分析图
2.3.3 差异表达mRNA KEGG Pathway分析 根据分子参与的功能,KEGG Pathway以Pathway Map形式展示每个通路中基因(蛋白质)、小分子等网络,对上调和下调差异表达基因进行综合分析以推断它们参与的通路。差异表达的mRNA通过FISH精确检验的计算方法,以P<0.05作为筛选标准,结果显示 10-5、10-7、10-9、10-10mol/L 双酚芴组分别富集到78、7、32、17条通路。挑选P值最小的前10个显著富集的条目进行图形化展示,若不足10个,则全部展示(图5)。

图5 BHPF各浓度组与对照组差异表达mRNA参与的细胞信号通路
3 讨论
传统毒理学研究认为,污染物达到一定暴露剂量即可对生物体产生毒性效应,而低于安全阈值则不具有相应的毒性。MCF-7细胞增殖方法可以设定化合物的不同浓度对细胞进行暴露,被测物质的浓度可以低至10-11mol/L级水平就可能有明显的生物效应,是一种比较灵敏且经济的生物评价方法,而且重现性好。本研究中,BHPF暴露MCF-7细胞24 h后显示高浓度10-5mol/L可以显著降低细胞存活率,具有统计学差异。其他浓度组与对照组相比虽没有统计学差异,但3次重复实验都显示10-6mol/L组对细胞生长也具有一定的抑制作用。该实验表明高于10-6mol/L浓度的BHPF对MCF-7细胞生长具有抑制作用,低于10-6mol/L浓度的BHPF对MCF-7细胞生长无显著影响。
真核细胞在有氧呼吸过程中,有少量氧不能被完全还原,从而生成了具有较强氧化作用的ROS,包括超氧阴离子(O2-)、羟自由基(HO)及过氧化氢(H2O2)等。正常生命过程中,适量的ROS具有一定的免疫和信号转导功能,是机体的有效防御系统[18]。但过多的ROS则会使机体产生氧化应激反应,对机体造成损害。大量研究表明内源性雌激素或外源雌激素活性物质暴露可诱导ROS生成,并最终调节细胞增殖/凋亡过程[19-20]。本研究中,10-7、10-8、10-9及 10-10mol/L BHPF 作用于细胞后ROS水平均显著升高,10-5及10-6mol/L组ROS水平显著降低。由于10-5及10-6mol/L组的细胞生长被抑制,ROS水平降低也可能是受到细胞生长状态及细胞数量的影响。
用不同浓度的双酚芴作用于MCF-7细胞24 h后,发现各浓度的双酚芴均能引起细胞全基因组mRNA表达谱发生改变,10-5、10-9、10-10mol/L浓度组差异变化较大,10-7mol/L组差异变化较小。对差异表达的上调、下调mRNA进行KEGG Pathway聚类分析,可以将差异基因富集到相应的细胞信号通路,双酚芴作用于MCF-7细胞可能通过这些细胞信号通路参与对细胞的内分泌干扰效应及毒性效应。根据初步分析结果,后续研究将重点针对NOD受体信号通路、雌激素信号通路、自噬、神经活性配体-受体相互作用信号通路以及磷脂酰肌醇-3-羟激酶等信号通路上的相关基因及蛋白做进一步验证,为双酚芴对MCF-7细胞的毒性机制提供理论基础。

