炭疽芽孢杆菌新抗原NlpC的重组表达与免疫评价
胡凯,宰晓东,殷瑛,李汭桦,王美荣,李耀辉,张跃,李玉杰,辜彦霏,徐俊杰
军事医学研究院 生物工程研究所,北京 100071
[关键字] 炭疽芽孢杆菌;NlpC蛋白;原核表达;免疫评价;芽孢萌发
炭疽芽孢杆菌(Bacillus anthracis)是人畜共患急性传染病——炭疽病的病原体。人类可通过破损皮肤直接接触、食用受污染的肉类、呼吸道吸入等途径感染炭疽病。炭疽杆菌的芽孢具有极强的存活能力,对阳光、高温和消毒剂均有一定的抵抗力,而且炭疽芽孢易于制备、成本低廉,多年来一直被视作潜在的生物武器进行管控,被列为A类生物战剂[1]。
疫苗是预防炭疽的有效手段,传统的人用炭疽疫苗主要分为减毒活疫苗和培养上清吸附疫苗。减毒活疫苗以中国的A16R株和俄罗斯的STI株为代表,吸附疫苗以美国的AVA疫苗和英国的AVP疫苗为代表。这2类疫苗均存在有效保护力持续时间较短,对吸入性炭疽感染保护不佳等问题[2]。因此,研发更加安全有效的新型人用炭疽疫苗,对炭疽的预防和控制具有重要意义。
炭疽杆菌感染人体后,通过淋巴和血液循环系统扩散,并分泌大量的外毒素[3]。其外毒素由3种无毒蛋白组成,即保护性抗原(protective antigen,PA)、水肿因子(edema factor,EF)和致死因子(lethal factor,LF)。PA分别与LF或EF结合形成致死毒素和水肿毒素,进而导致水肿和器官衰竭。PA是已知能够发挥免疫保护作用的最主要成分,基于PA的重组蛋白疫苗显示了较好的安全性和免疫原性,是当前新型炭疽疫苗研究的重点方向[4-5]。但据文献报道,采用毒素质粒pXO1和荚膜质粒pXO2均缺失的炭疽减毒菌株作为疫苗仍具有一定的保护效果,证明炭疽的其他抗原成分对免疫保护同样发挥重要作用[6]。其中S层蛋白EA1[7]、芽孢表面蛋白BclA和BxpB[8-9]、热激蛋白 GroEL[10]、血红素转运蛋白(NEAT)[11]均可以不同程度地提供保护,有望作为炭疽新型亚单位疫苗的候选组分。
NlpC(new lipoprotein C)是炭疽杆菌中的一种细胞壁水解酶,缺失后可导致炭疽杆菌芽孢萌发速度减缓[12]。但NlpC作为抗原是否能够对炭疽杆菌提供保护国内外尚无报道。本研究中,我们运用生物信息学软件对NlpC蛋白的常规理化性质进行了分析,在此基础上构建了NlpC蛋白原核表达质粒,表达纯化了NlpC重组蛋白,并对其免疫原性与免疫保护性进行了初步评价,为新型炭疽亚单位疫苗的研发提供参考。
1 材料与方法
1.1 材料
6~8周龄雌性BALB/c小鼠、DBA/2小鼠购自北京维通利华实验动物技术有限公司;大肠杆菌感受态TOP10、BL21(DE3)购自天根生化有限公司;炭疽杆菌A16R株、质粒pTIG为实验室保存;2×Easy Tap PCR supermix购自北京全式金生物技术有限公司;限制性内切酶NotⅠ、EcoRⅠ,T4DNA连接酶购自NEB公司;核酸凝胶回收试剂盒及小量质粒提取试剂盒购自TaKaRa公司;BCA蛋白定量检测试剂盒、Western印迹显影液购自赛默飞世尔科技公司;HRP标记的羊抗鼠IgG、anti-6×His tag购自Abcam公司;His-tag亲和层析纯化柱购自通用电气公司;TMB单组分显色液终止液购自北京索莱宝科技有限公司;SDS-PAGE预制胶购自金斯瑞生物科技股份有限公司。
1.2 NlpC生物信息学分析
应用ProtParam软件(https://web.expasy.org/protparam/)预测NlpC常规理化性质;应用SignalP-5.0 Server软件(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;应用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜区;应用ProtScale软件(https://web.expasy.org/protscale/)分析蛋白疏水性;从NCBI数据库(https://www.ncbi.nih.gov/)下载炭疽杆菌基因组序列,应用BLAST软件比对NlpC氨基酸序列,分析抗原保守性。
1.3 NlpC原核表达载体的构建
以NCBI数据库中炭疽杆菌A16R株NlpC的基因序列(AHE83353.1)为依据,去除其信号肽区域,并在C端加入His标签。结合表达载体pTIG的序列特点,在上下游分别添加EcoRⅠ、NotⅠ酶切位点构建引物nlpc-F、nlpc-R。在nlpc基因序列上游和pTIG载体酶切位点下游选取20 bp序列构建鉴定引物对A-nlpc-F、A-pTIG-R。本研究所用引物均在上海生工生物技术服务有限公司合成(表1)。
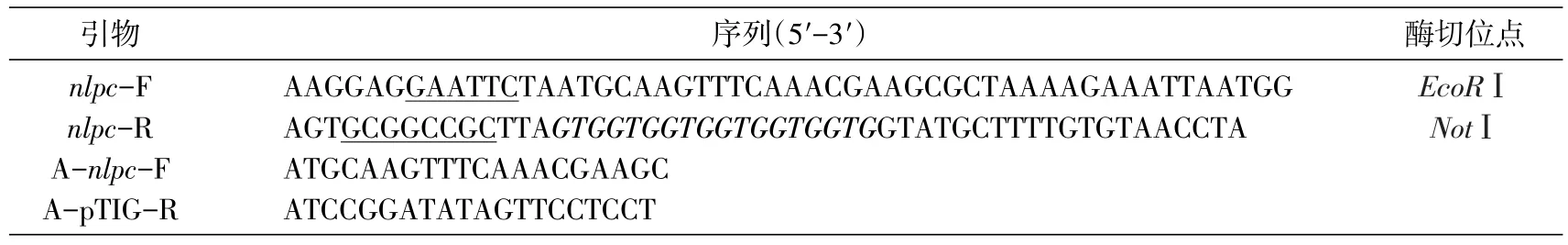
表1 NlpC原核表达载体构建及鉴定引物
以炭疽杆菌A16R株基因组为模板,用nlpc-F、nlpc-R引物进行PCR扩增nlpc基因(反应条件:98℃ 2 min;98℃ 20 s,56℃ 20 s,延伸 72℃ 1 min,40个循环),所得产物经1%琼脂糖凝胶电泳检测回收后用NotⅠ、EcoRⅠ限制性内切酶双酶切,酶切片段通过T4DNA连接酶连接到pTIG载体,获得NlpC表达载体pTIG-nlpc。
1.4 NlpC重组蛋白的表达
将pTIG-nlpc转化大肠杆菌TOP10感受态,挑取单克隆菌接种至5 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37℃、220 r/min过夜振荡培养;次日用小量质粒提取试剂盒提取质粒pTIG-nlpc,转化大肠杆菌 BL21(DE3)感受态,挑取单克隆菌接种至5 mL含100 μg/mL氨苄青霉素的LB液体培养基中,37℃、220 r/min过夜振荡培养;次日按1∶100的比例转接至新的LB培养基中,37℃、220 r/min振摇至菌液D600nm为0.6~0.8时加入终浓度为1 mmol/L的IPTG,37℃诱导表达5 h;离心收集菌体,进行SDS-PAGE分析。
1.5 NlpC重组蛋白的纯化
8000 r/min离心5 min收集IPTG诱导表达菌液的菌体沉淀,用50 mL缓冲液(20 mmol/L Tris,500 mmol/L NaCl,50 mmol/L咪唑,pH8.0)重悬,冰上超声10 min,12 000 r/min离心10 min收集上清,经0.22 μm针头滤器过滤。用His亲和层析柱,以梯度洗脱(洗脱液为20 mmol/L Tris,500 mmol/L NaCl,500 mmol/L 咪唑,pH8.0)方式纯化目的蛋白。SDS-PAGE鉴定纯化蛋白并分析蛋白纯度,BCA法定量检测蛋白浓度。
1.6 NlpC蛋白的免疫原性评价
35只6~8周龄雌性BALB/c小鼠随机分为7组(每组5只),经皮下注射方式,分别联合Al(OH)3佐剂或Al(OH)3+CpG佐剂,免疫不同剂量的NlpC(5、10、20 μg/只),设置PBS为对照组。各组于0、14、28 d进行免疫,0、14、28、35 d采血,离心收集血清,ELISA法检测血清中针对NlpC的特异性IgG抗体。大于阴性血清D值(D=D450nm-D630nm)2.1倍的最大稀释度作为该样品的抗体滴度。
1.7 炭疽芽孢的制备
将炭疽杆菌A16R株划线法接种至LB平板,37℃过夜孵育;挑取单克隆转接至5 mL LB液体培养基中,37℃、220 r/min摇床中过夜培养;菌液接种至若干LB斜面培养基上,37℃孵育至菌膜基本铺满斜面;用1 mL生理盐水洗下菌体,转接至装有LB固体培养基的T75罗氏瓶内,使菌液均匀平铺在培养基上,37℃正置培养2 h后吸出残留的液体,倒置培养48 h;28℃继续倒置培养10 d,用5 mL生理盐水将菌膜洗下,再经无菌棉片过滤后,65℃处理30 min灭活繁殖体,稀释后涂平板计数。
1.8 芽孢萌发抑制实验
将炭疽杆菌A16R芽孢浓度稀释至5×105/mL,分别取10 μL芽孢加入不同稀释度(1/1、1/5、1/20)的NlpC免疫血清(40 μL)中,未免疫血清为阴性对照。4℃孵育1 h,取5 μL菌液稀释并灭活繁殖体后,涂LB平板计数;37℃孵箱中萌发5 min;取5 μL菌液稀释并灭活繁殖体后,涂LB平板计数。萌发比率=阳性血清芽孢萌发率/阴性血清芽孢萌发率。
1.9 免疫攻毒实验
32只6~8周龄雌性DBA/2小鼠随机分为4组(每组8只),经皮下注射方式分别免疫NlpC抗原联合Al(OH)3+CpG佐剂或PBS(各2组)。于0、14 d进行免疫,0、14、21 d采血,离心收集血清,ELISA法检测血清中针对NlpC的特异性IgG抗体。首免后28 d分别用炭疽杆菌A16R株芽孢和繁殖体进行腹腔攻毒,观察小鼠生存情况(表2)。

表2 NlpC免疫攻毒实验方案
1.10 统计学方法
显著性分析采用单因素方差分析或t检验,生存曲线显著性分析采用Gehan-Breslow-Wilcoxon检验,P<0.05为有统计学差异。数据统计分析及制图均采用GraphPad Prism 8.0完成。
2 结果
2.1 炭疽杆菌NlpC蛋白理化性质分析
应用ProtParam软件对NlpC蛋白常规理化性质进行预测,NlpC蛋白全长为420个氨基酸,相对分子质量43 926.74,理论等电点9.69,平均疏水指数(GRAVY)为-0.348,不稳定系数(Ⅱ)为8.81。应用SignalP-5.0 Server软件预测信号肽,其N端前26个氨基酸为其信号肽(图1A);应用TMHMM软件预测跨膜区,显示NlpC蛋白无跨膜区(图1B),提示NlpC是一种分泌蛋白;应用ProtScale软件分析蛋白疏水性,其亲水性峰明显多于疏水性峰(图1C,小于0表示亲水,大于0表示疏水),推测此蛋白为亲水蛋白。对293株炭疽杆菌基因组中NlpC氨基酸进行比对,所有氨基酸序列的相似性均在90%以上,291株序列相似性大于95%,其中完全一致的有212条(图1D),表明NlpC具有很高的保守性。
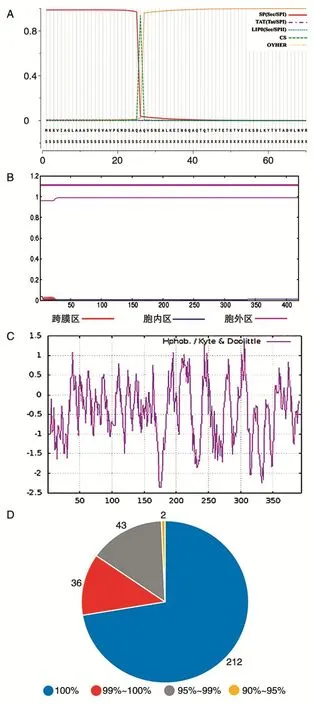
图1 炭疽NlpC蛋白理化性质分析
2.2 NlpC表达质粒pTIG-nlpc的构建
以炭疽杆菌A16R基因组为模板扩增nlpc基因片段,1%琼脂糖凝胶电泳显示扩增片段大小约1200 bp,与理论值相符(图2A)。回收目的基因后用限制性内切酶EcoRⅠ、NotⅠ对片段和pTIG载体进行双酶切,酶切后的pTIG质粒在1%琼脂糖凝胶电泳中的移动距离比未酶切质粒短,提示载体质粒被双酶切为链状(图2A)。酶切后的片段和载体经T4DNA连接酶连接,获得NlpC表达质粒pTIG-nlpc(图2B)。转化大肠杆菌TOP10,涂板培养后挑单克隆进行PCR菌落鉴定(图2A),测序结果显示插入片段序列与nlpc基因的编码序列完全一致。
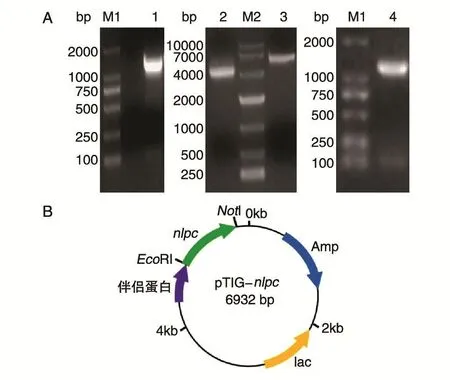
图2 pTIG-nlpc质粒的构建
2.3 NlpC蛋白的表达与鉴定
将构建的质粒pTIG-nlpc转化大肠杆菌BL21(DE3),经IPTG诱导表达,SDS-PAGE鉴定结果提示NlpC实现了较好的可溶性表达(图3A)。采用His亲和层析柱纯化NlpC蛋白后行SDS-PAGE和Western印迹鉴定,结果显示纯化的NlpC蛋白条带单一,大小符合预期,提示获得了NlpC蛋白,纯度大于95%,可用于后续免疫评价实验(图3B)。
图3 NlpC蛋白的表达与鉴定
2.4 NlpC免疫原性评价
BALB/c小鼠经3次免疫后取血,ELISA法检测针对NlpC的特异性抗体水平。结果显示,单独使用Al(OH)3佐剂时,低、中、高剂量组一免后产生的抗体水平较低,且低剂量组抗体水平低于中、高剂量组;二免和三免后产生的针对NlpC的特异性抗体水平较一免后有显著提升(图4A)。用Al(OH)3+CpG佐剂免疫后产生的针对NlpC的抗体水平显著高于单独使用铝佐剂组;二免和三免后的抗体水平较一免后有显著提升(图4B)。
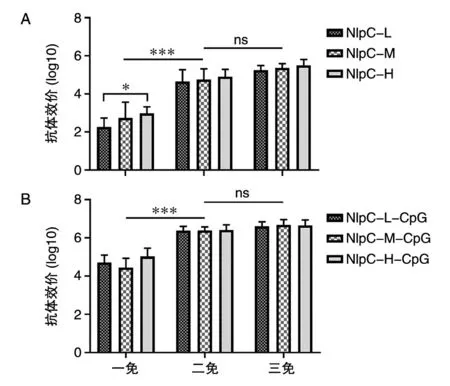
图4 BALB/c小鼠NlpC特异性抗体水平
2.5 芽孢萌发抑制实验
为了验证NlpC免疫血清抑制炭疽芽孢萌发的效果,用阴性血清将NlpC免疫血清稀释至不同浓度,与A16R株芽孢于4℃孵育,移至37℃萌发5 min,65℃处理25 min灭火繁殖体。比较不同组间萌发前后芽孢的数量,分析NlpC免疫血清对炭疽芽孢萌发的抑制情况。结果显示,经未稀释的NlpC免疫血清孵育的芽孢萌发比率较阴性血清组低约50%,1/5稀释的NlpC血清萌发比率与未稀释NlpC血清萌发比率无差异,1/20稀释后的NlpC血清无明显抑制现象(图5)。
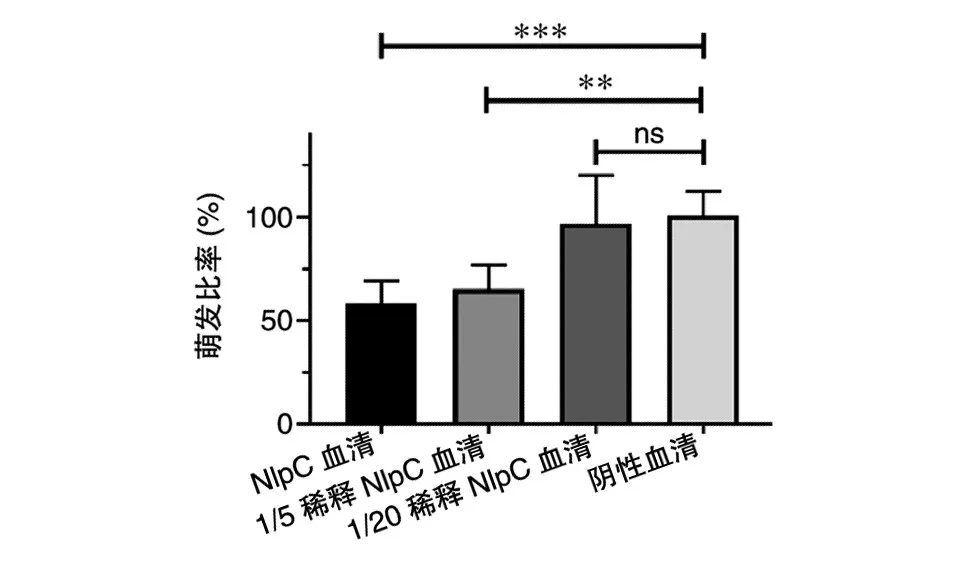
图5 芽孢萌发抑制实验
2.6 免疫攻毒实验
为了评价NlpC对炭疽的免疫保护效果,选用DBA/2小鼠为动物模型开展免疫攻毒实验。分别于0、14 d免疫NlpC和PBS,首免后14、21 d检测特异性抗体水平,28 d分别用炭疽杆菌A16R株芽孢和繁殖体进行攻毒,观察小鼠的生存情况。结果显示,NlpC抗原在DBA/2小鼠中激发了显著的体液免疫反应,二免后抗体水平显著高于一免,抗体效价达7.5×105(图6A)。用炭疽杆菌A16R株繁殖体攻毒,NlpC免疫组与阴性对照组小鼠集中在1.5 d死亡(图6B),总体平均死亡时间无统计学差异;用炭疽杆菌A16R株芽孢攻毒,阴性对照组的小鼠集中在2.5 d死亡,NlpC免疫组小鼠总体平均死亡时间较未免疫组推迟约24 h(图6C),有显著差异(P<0.05)。
图6 DBA/2小鼠免疫攻毒实验
3 讨论
疫苗是预防和控制炭疽的重要手段。我国上市使用的人用炭疽疫苗为无荚膜减毒株A16R,免疫方式为皮上划痕接种,接种量难以控制,接受度普遍较低。亚单位疫苗是目前炭疽疫苗重要的研究方向,基于保护性抗原的重组疫苗显示了较好的安全性和有效性。PA是亚单位疫苗的必要成分,但其他抗原也会以某种尚不明确的方式起着重要的保护作用,包含多种抗原的疫苗可能会提供更有效的保护[13]。炭疽杆菌NlpC蛋白是一种细胞壁水解酶,参与维持细胞壁的完整性,与炭疽芽孢的形成和萌发相关。NlpC缺失会导致炭疽杆菌肽聚糖的降解能力降低,芽孢萌发时间延长[12],但NlpC作为抗原蛋白是否对炭疽杆菌具有免疫保护作用还须进一步探究。
本研究应用多个生物信息学软件对NlpC蛋白进行分析,结果显示NlpC是一种稳定的亲水性蛋白,有利于后续表达纯化。用双酶切方法构建了NlpC原核表达质粒,经原核系统表达并纯化后获得了纯度大于95%的NlpC蛋白。用纯化后的NlpC蛋白联合佐剂免疫小鼠,评价了免疫后产生的特异性抗体水平,发现NlpC具有较好的免疫原性。单独使用Al(OH)3佐剂时,一免后产生的抗体水平较低,二免和三免后产生的特异性抗体水有显著提升,用Al(OH)3+CpG佐剂能够进一步提升抗原免疫后激发的特异性抗体水平。
本研究评价了NlpC免疫血清对A16R株芽孢萌发的抑制作用,在芽孢萌发5 min时,与NlpC免疫血清孵育过的A16R株芽孢的萌发率降低了50%,证实了NlpC免疫血清对A16R株芽孢萌发具有显著抑制作用。进一步用免疫攻毒实验评价NlpC诱导的免疫保护效果。由于所选用的炭疽攻毒菌株A16R为减毒疫苗株,仅保留表达毒素的质粒pXO1,因此本实验选用对毒素更为敏感的DBA/2小鼠(补体C5缺失)用于免疫攻毒评价。NlpC在DBA/2小鼠模型中也显示了较好的免疫原性,可激发较高的特异性抗体水平。二免后用A16R株芽孢攻毒,小鼠的死亡时间推迟了24 h,用相同剂量的A16R株繁殖体攻毒,未发现死亡时间推迟现象。结果表明NlpC免疫后小鼠生存时间延长的现象可能与芽孢萌发过程受到抑制相关。
不同感染途径中,炭疽芽孢的萌发是炭疽杆菌入侵人体后至炭疽病产生过程的必要环节。本研究观察到NlpC免疫血清能够抑制炭疽芽孢萌发的速度,推迟了用芽孢攻毒后小鼠的死亡时间,是一种潜在的炭疽保护性抗原。但是NlpC免疫小鼠攻毒后仍全部死亡,推测NlpC免疫后能够推迟芽孢萌发的时间,但无法完全抑制芽孢的萌发。NlpC虽然作为单一抗原对炭疽的保护效果有限,但推迟芽孢萌发可能会为其他保护性抗原发挥作用争取更多的时间。此外,本研究中攻毒所用的A16R株为毒力减毒株,采用的攻毒剂量较高,现实感染时入侵芽孢数量更少,NlpC可能会发挥更加有效的作用。本研究为NlpC作为一种新型炭疽亚单位疫苗的有效组分研究提供了参考,NlpC联合PA的免疫效果有待进一步开展评价。

