低温环境下秸秆降解菌的筛选与性能检测*
张国盛,颜婉茹,陈春亮,李掌印,李亚男,何新超
(哈尔滨理工大学,黑龙江 哈尔滨 150040)
秸秆是我国东北地区农田中随处可见的废弃物,据有关调查数据显示,2017年我国秸秆理论资源量为8.84亿t,2018年秸秆理论资源量预计达8.86亿t左右。黑、吉、辽三省作为我国粮食主产地年秸秆资源量较大,而常见的露天焚烧等原始处理方法不但造成资源浪费,更会引发空气污染、火灾等严重后果。秸秆堆腐还田技术在我国南方等地早有应用,但由于东北地区冬季寒冷,此项技术一直无法开展[1]。
本研究以农田废弃的秸秆为主要原料,进行了低温环境下秸秆降解菌的筛选与特性研究,以期为低温下农田废弃物的有效治理提供帮助。
1 实验部分
1.1 材料与方法
1.1.1 菌落及样品来源 取样地址位于哈尔滨市平房区某玉米农田,室外平均温度为10℃,取玉米根部5~8cm处湿润土壤1000g,经浸泡、富集、筛选、驯化,得到所需的低温纤维素降解菌,并对其肥力进行检测。秸秆废弃物样品来源为玉米田收获后残余秸秆。
1.1.2 培养基 富集液体培养基:蛋白胨5g,K2HPO40.5g,Na2CO32.5g,MgSO4·7H2O 0.05g,FeSO4·7H2O 0.008g,MnSO40.025g,酵母膏 5g,定容至 500mL,调pH值为6.0;
初筛(刚果红)培养基:CMC-Na 5g,(NH4)2SO40.5g,MgSO4·7H2O 0.125g,KH2PO20.25g,NaCl 0.125g,刚果红 0.05g,琼脂 5g,,定容至250mL,调pH 值为7.2;
复筛(滤纸条崩解)培养基:(NH4)2SO41g,Mg-SO4·7H2O 0.5g,KH2PO41g,酵母膏 0.1g,定容至1000mL;
羧甲基纤维素钠培养基(g·L-1):CMC-Na 15g,NaCl 5g,KH2PO41g,MgSO40.2g,蛋白胨 10g,酵母粉 5g,琼脂 18g,调pH 值为 7.2;
LB固体培养基:蛋白胨10g,酵母5g,NaCl 10g,pH值为7.0,定容至1L,再加入15g琼脂。
淀粉培养基:可溶性淀粉2g,蛋白胨10g,牛肉膏 5g,NaCl 5g,琼脂 20g,定容至 1L。
1.1.3 试剂
0.1 mol·L-1HAc-NaAc缓冲溶液(pH 值为4.6):将 49.0mL 0.2mol·L-1NaAc 溶液和 51.0mL 0.2mol·L-1HAc溶液混合后定容至100mL。
3,5-二硝基水杨酸(DNS)试剂:称取 6.3g 3,5-二硝基水杨酸用水溶解,加入21g NaOH,182g酒石酸钾钠,加水500mL,加热溶解后再加入5.0g重蒸酚和5.0g NaNO2,搅拌溶解,冷却,定容至1000mL,存于棕色瓶中,放置7d后使用。
葡萄糖标准溶液(1.0mg·mL-1):称取 1.000g 葡萄糖(AR)(105℃干燥至恒重)用蒸馏水溶解后定容至1000mL,冰箱保存备用。
羧甲基纤维素溶液:称2.0g CMC-Na溶于200mL蒸馏水中,加HAc缓冲溶液100mL,混合均匀后存于冰箱内备用,配后隔天使用。
HAc-NaAc 缓冲溶液:将 49.0mL 0.2mol·L-1醋酸钠溶液和51.0mL 0.2mol·L-1醋酸溶液混合后定容至1L。
1.2 实验方法
1.2.1 秸秆降解菌的筛选驯化 将所取土样均分成4份,每份各60g于1000mL烧杯中加入蒸馏水,NaCl 1g,牛肉膏1g,蛋白胨2g于20℃下培养1d。取出后曝气30min,同样温度培养1d。加入富集培养基90mL,在15℃的温度下培养2d,两天后降温至10℃,继续培养 3d,再升温 15、20℃各培养 2d,温度升降反复循环2次,驯化期间保证富集培养基量不少于90mL。
采用稀释法将富集培养液接种于CMC培养基平板上,每个梯度设置3个平等样,放入10℃的培养箱中培养并记录各平板菌株生长状况,反复使用平板划线法分离纯化后,从中筛选出长势较好的39株纤维素降解菌。
1.2.2 刚果红初筛 将分离纯化后的每个菌株接种于刚果红培养基平板,培养3d。测量各菌株菌落直径(d)及其产生的透明圈直径(D)大小,以D/d值作为判断依据,进行初筛,留下D/d值较大菌株进一步研究[1]。最终选择7株菌进行复筛及其他秸秆降解效果测定。
1.2.3 滤纸条复筛 将上述实验中效果较好的7株菌株分别接种至加入新华滤纸条的崩解培养基中,以不接种菌只加滤纸条的崩解培养基作为对照,15℃培养2周,观察滤纸条的溃烂和崩解情况,根据滤纸条的降解重量来判断菌株降解纤维素能力的强弱[2]。
1.2.4 秸秆降解效果测定 准确称取质量为10g的玉米秸秆,将其粉碎,向其中加入20mL无机盐营养液,并搅拌均匀,将其平铺于浅盘中,向其中接种0.3%的菌液48mL,盖上湿布,恒温20℃培养15d,期间保持盖布湿润。15d后将残留物置于105℃烘箱中烘干至恒重,并称量其的质量,按下面公式计算其秸秆降解率。

1.2.5 生化特性测定实验
1.2.5.1 淀粉水解能力测定 在以2%可溶性淀粉为唯一碳源的淀粉培养基上分别接种7株菌株,置于15℃培养箱中培养72h。在平板上滴入碘液,根据水解圈的有无与大小,初筛淀粉酶产生菌。通过计算水解圈面积与接种菌落面积之比,判断淀粉酶降解能力。
1.2.5.2 滤纸条酶活能力测定
(1)标准曲线绘制 取25mL具塞刻度试管6支,加入1.0mg·mL-1的葡萄糖标准溶液0.0、0.4、0.8、1.2、1.6、2.0mL,加蒸馏水 2.0、1.6、1.2、0.8、0.4、0.0mL,加DNS试剂1.5mL,混匀后在沸水浴中加热5min,取出立即用冷水冷却,定容至25mL,摇匀,测吸光度A,以吸光度为纵坐标,葡萄糖含量为横坐标,绘制标准曲线。
(2)待测酶液制备 将酶液倒入离心试管中,离心5min,用移液枪吸取1mL上清液移至比色管中。
(3)准备 待用滤纸放入干燥器中平衡24h;将平衡后的滤纸制成宽1cm、质量为(50±5)mg的滤纸条,折成M备用。
(4)测定 取0.5mL稀释酶液,加入HAc-NaAc缓冲溶液1mL。再加入折好滤纸于50℃保温酶解反应1h。再加入DNS显色剂3mL,放入沸水浴中10min,流水冷却后,在540nm波长下测吸光度。同时用100℃煮沸10min后失活的酶液作对比,扣除本底值[3]。
1.2.5.3 CMC酶活能力测定
(1)标准曲线绘制 绘制方法如1.2.5.2(1)。
(2)待测酶液制备 制备方法如1.2.5.2(2)。
(3)测定 取1.5mL CMC-Na溶液与0.5mL适当稀释的酶液于25mL试管中,40℃水浴保温30min后即加1.5mL DNS显色剂,沸水煮沸5min,取出即冷却,定容至25mL,在540mm波长下测吸光度。
2 结果与讨论
2.1 秸秆降解菌的筛选
2.1.1 秸秆降解菌的初筛 经过土壤富集及CMC培养基筛选后,筛选出7株降解纤维素的细菌,并将这些菌株进一步培养观察,在CMC培养基上的菌落形态见图1。

图1 在CMC培养基上的菌落形态Fig.1 Olony morphology on CMC medium
在15℃下,刚果红培养基中培养48h后测定水解圈直径和菌落直径,照片见图2,数据见表1。

图2 在刚果红培养基上的水解圈Fig.2 Hydrolysis circle on Congo red medium
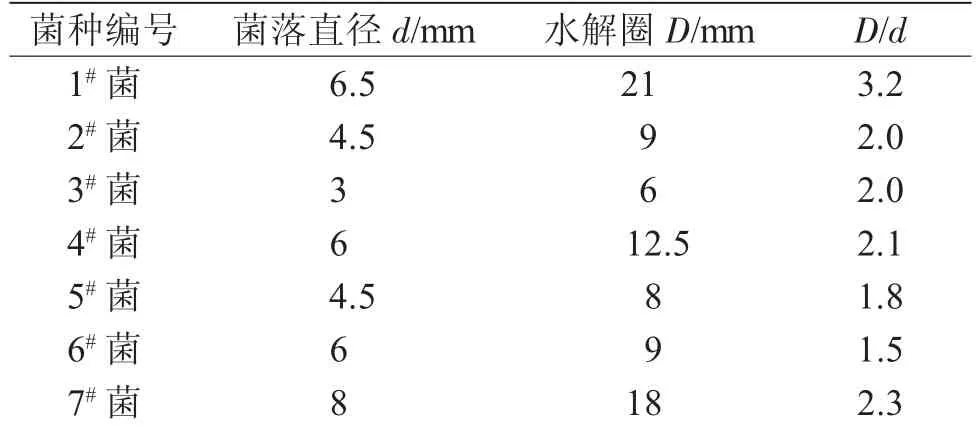
表1 纤维素-刚果红水解实验Tab.1 Hydrolysis experiment of cellulose Congo red
由图1,2可见,7株菌均能在刚果红培养基中的进行水解,水解程度不同,水解圈大小不同,由水解圈的直径与菌落的直径的比值,可表明该菌株对纤维素降解能力的强弱。实验表明,7株菌在低温下都能利用纤维素为唯一碳源生长,其中1#的菌株产生的水解圈直径与菌落直径的比值最大,显示出其对纤维素降解效果最为明显,其次为7#菌株。
2.1.2 秸秆降解菌的复筛 利用滤纸条崩解培养基在15℃下培养2周,观察滤纸崩解情况,滤纸崩解实验前后对比见图3,并记录滤纸前后重量。表2为滤纸条崩解实验数据。

图3 滤纸崩解实验前后对比Fig.3 Comparison of filter paper disintegration experiments

表2 滤纸条崩解实验Tab.2 Disintegration test of filter strip
结果显示,滤纸崩解实验2周后,各供试滤纸均有5%以上的失重率,其中5#和7#试样菌株降解前后滤纸质量变化最大,达到14%以上的失重率,其次是6#和3#试样,失重率达10%以上。
2.2 秸秆降解效果测定
以农田秸秆粉碎物为样品,进行秸秆低温条件下降解实验,来测定各菌株其对秸秆的降解能力。

表3 秸秆降解效果测定Tab.3 Determination of straw degradation effect
实验结果显示,各菌株在低温条件下,对秸秆均有一定的降解能力,反应15d后,7#菌和1#菌的降解率都在4%以上,其次是4#菌。
2.3 生化特性的测定
2.3.1 淀粉水解能力测定 淀粉有遇碘变蓝的特性,在淀粉为唯一碳源的培养基中滴入碘液可使培养基变色。而具有淀粉降解能力的细菌在分解淀粉时会产生葡萄糖或者是麦芽糖,破坏掉淀粉的结构,形成水解圈,淀粉被水解,此时滴入碘液后则不变色。菌株对淀粉的分解能力越强,水解圈越大,所以可通过水解圈D与菌落直径d的比值来确定细菌对淀粉的水解能力的大小。
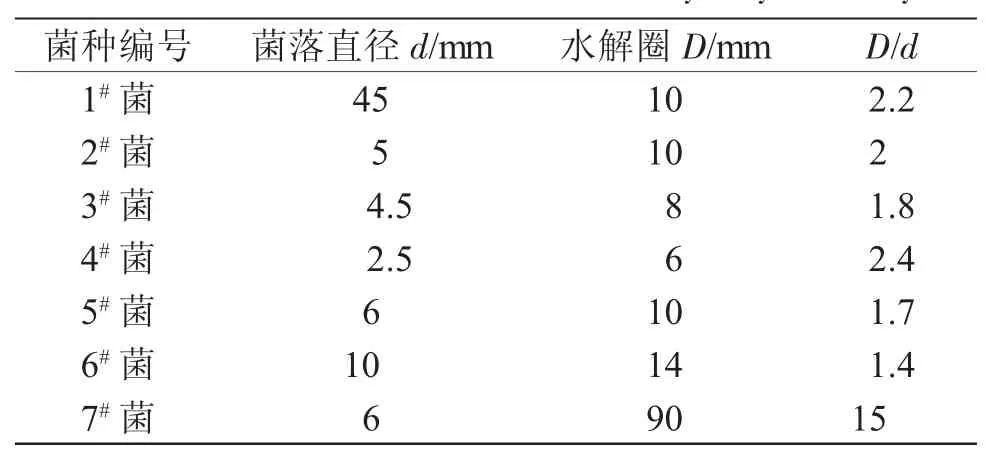
表4 淀粉水解能力的测定结果Tab.4 Determination results of starch hydrolysis ability
实验表明,筛选出的7株菌对淀粉均有一定的降解能力,其中7#菌的菌落的淀粉降解能力远远要大于其他菌落,其次是4#菌、1#菌和2#菌。
2.3.2 滤纸条酶活能力测定 分别对在15和30℃下培养的菌液进行滤纸条酶活测定,结果见表5。

表5 滤纸条酶活能力测定Tab.5 Determination of enzyme activity of filter paper
实验表明,7株菌在15和30℃下,均具有滤纸酶活,且在15℃下酶的活性明显高于30℃下酶的活性,显示出良好的低温特性。其中,1#菌、5#菌在15和30℃条件下酶的活性好于其它菌株,4#菌、7#菌在15℃时酶的活性也比较好。
2.3.3 CMC酶活能力测定 采用DNS法分别对在15和30℃下培养的7株菌液进行CMC酶活测定。

表6 CMC酶活测定Tab.6 CMC enzyme activity determination
测定结果表明,7株菌在15和30℃下,均有CMC酶活,且在15℃下酶的活性明显高于30℃下酶的活性,显示出良好的低温特性。2#菌在15℃下对羧甲基纤维素的降解效果更为突出,为23U·mL-1,30℃最大值为 2#菌株的 0.13U·mL-1。
3 结论
本研究根据东北地区春、秋、冬季节寒冷的特点,在低温条件下,经过驯化和富集,刚果红培养基初步筛选得到低温秸秆降解菌7株。利用滤纸条复筛,通过计算失重率得知5#和7#菌株降解纤维素能力最强。在秸秆降解效果测试实验中,5#和7#菌株降解秸秆的效果相比之下也最为明显。
对筛选出来的7株菌株进行了生化特性的测定。淀粉水解能力最强的是7#菌株,D/d为15,远远大于其他菌株。在滤纸条酶活和CMC酶活实验中,7株菌在15℃下酶的活性明显高于30℃下酶的活性,显示了它们显著的低温菌的特性。
在实际的秸秆降解过程中,更多的是多种菌的协同作用,所以需要进一步进行混合菌群的实效研究,来提高秸秆类农田废弃物的降解效率。

