先天性心脏病开胸手术和介入治疗血浆炎性因子及神经损伤标志物的变化
王 舰,邬晓臣,刘敬臻,岳 琴,刘小燕,高 峰,辛 梅,丁 盛,张近宝
目前,先天性心脏病(先心病)的发病率仍然较高,据估算我国先心病发病率约占出生人口的11.3‰左右[1]。 当前先心病的治疗主要包括外科开胸心内直视修补手术和介入治疗两大类,尽管外科手术及心肺转流(cardiopulmonary bypass,CPB)技术已取得长足的进步,但是因CPB 所产生炎症反应及潜在的脑损伤风险仍然是造成术后预后不良的主要原因之一。 CPB 所诱发的神经炎症反应可能是造成术后脑损伤的重要原因[2]。 同时由于血脑屏障受到破坏使原本血浆中表达量很低的神经损伤标志物升高,而异常升高的神经元特异性烯醇化酶(neuron-specific enolase,NSE)和S100β 可以反应神经损伤的严重程度[3]。 由于介入治疗不依赖CPB,本实验拟通过观察和对比先心病开胸手术与介入治疗间,两组患者血浆肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、C 反应蛋白(c-reactive protein,CRP)、NSE 及S100β的变化,探讨两者对炎症反应及脑损伤的影响。
1 资料与方法
1.1 研究对象 本实验为一项前瞻性观察研究,经医院伦理委员会批准(批准文号2019ky84)并与家属签署知情同意书,选择2019 年1 月至9 月在本院住院择期行先心病开胸手术或介入治疗的先心病患儿。 纳入标准:术前经胸彩色超声心动图检查诊断为先心病房间隔缺损(atrial septal defect,ASD)和/或室间隔缺损(ventricular septal defect,VSD)患儿。排除标准:严重感染,合并中度及以上肺动脉高压,存在神经、精神系统、免疫系统疾病或肿瘤疾病史者。 符合纳入标准患儿共54 例,其中3 例诊断严重肺部感染,10 例合并中~重度肺动脉高压,5 例存在临床资料缺失,最终36 例患儿纳入本研究。 根据是否适合行经导管介入治疗,将其分为CPB 下开胸组(n =18)和经导管介入组(n =18),年龄2 ~4岁, 体重8 ~18.5 kg。
1.2 研究方法
1.2.1 开胸组麻醉、CPB 及手术 入手术室后采用咪达唑仑(0.2 mg/kg)、丙泊酚(1 mg/kg)、芬太尼(20 μg/kg)、维库溴铵(0.1 mg/kg)进行麻醉诱导后行机械通气, 术中间断静脉滴注舒芬太尼并吸入异氟烷维持麻醉。 桡动脉及颈内静脉穿刺置管监测有创动脉血压及中心静脉压。 CPB 采用Stockert C 型人工心肺机(德国Stockert 公司)和膜式氧合器(Polystan micro & mini)。 主动脉插管前,2 ~3 mg/kg 肝素全身肝素化,监测活化凝血时间(activated clotting time,ACT),维持ACT≥480 s。 预充液以胶体为主,主要成分为血浆和白蛋白,少量复方醋酸钠注射液,同时加入20%甘露醇(2 ml/kg)和5% NaHCO3(2 ml/kg)。 根据患儿血红蛋白计算加入适量的新鲜浓缩红细胞,使CPB 中血细胞比容达到0.25~0.30。 转流期间温度控制30 ~32℃。 冷含血心脏停搏液行心肌保护。 术中平均动脉灌注压维持在40~60 mm Hg。 采用胸骨正中切口,常规主动脉及上、下腔静脉插管建立CPB,心内直视矫治心脏畸形。 术后予以鱼精蛋白1.2 ∶1 中和肝素。
1.2.2 介入组麻醉及手术 入手术室后采用咪达唑仑(0.1 mg/kg)、丙泊酚(1 mg/kg)、芬太尼(2 μg/kg)进行麻醉诱导后行喉罩通气,术中间断静脉滴注芬太尼并喉罩吸入异氟烷维持麻醉。 常规股血管插管并行心导管测压,根据多普勒经食道心脏彩超和X 线造影结果选择大小合适封堵器,反复检测确认缺损关闭无残余分流后释放。
1.2.3 标本收集及检测 分别于术前(T0)、术后即刻(T1)、术后6 h(T2)、12 h(T3)和24 h(T4)抽血并离心收集血浆。 严格按ELISA 试剂盒(美国R&D Systems 公司)说明书,测定各时间点血浆中TNFα、IL-6、CRP、NSE 及S100β 的表达水平。
1.2.4 临床资料收集 记录患儿性别、年龄、体重和疾病诊断名称等一般临床资料,记录患儿主动脉阻闭时间、CPB 持续时间及手术时间,以及患儿ICU住院时间和总住院时间。
1.3 统计分析 数据分析采用SPSS 22.0 软件,计量资料以±标准差()表示,t 检验用于比较正态分布的计量资料,非参数检验用于非正态分布数据。组间均数比较采用单因素方差分析(One-way ANOVA),并进行方差齐性检验,如方差不齐则采用秩和检验。 计数资料比较采用χ2检验。 采用线性回归分析检验两变量间相关性。 P <0.05 认为差异具有统计学意义。
2 结 果
2.1 临床资料及手术结果 本研究共纳入36 例患儿,其临床特征及手术结果见表1,两组间年龄、体重、性别、病种相比较无差异无统计学意义( P >0.05)。 开胸组手术持续时间明显长于介入组,差异具有统计学意义( P <0.001),且ICU 住院时间和总住院时间均长于介入组,差异具有统计学意义( P <0.05)。
2.2 两组患者血浆炎性因子及神经损伤标志物的表达变化 开胸组患者血浆TNF-α、IL-6 及CRP在T1~T4 较T0 时显著升高( P <0.05),且其在T1~T4 时的表达明显高于介入组,组间比较具有统计学差异( P <0.05)。 除T4 时CRP 的表达较T0 增高( P <0.05),介入组各时间点组内无显著变化( P >0.05)。 见图1。

表1 两组临床资料及手术结果比较(n=18)
开胸组血浆NSE 表达在T1 ~T4 时较T0 时显著升高( P <0.05),同时其表达也明显高于介入组,组间比较具有统计学差异( P <0.05)。 开胸组S100β 的表达在T1 时达峰并逐渐降低,在T1 ~T3明显高于介入组( P <0.05),T4 时其表达降至T0 时水平( P >0.05)。 介入组NSE 和S100β 各时间点组内无显著变化( P >0.05)。 见图1。
2.3 开胸组NSE 和S100β 与近期临床预后的相关性 如图2 所示,开胸组患者术后即刻(T1)血浆NSE 及S100β 浓度的高低并不能明显影响患者的近期临床预后,与ICU 住院时间及总住院日间无明显相关性( P >0.05)。
3 讨 论
尽管先心病经导管介入治疗技术已日趋成熟,但是复杂先心病或无法行介入治疗的患儿仍然需要在CPB 下行开胸心内直视心脏手术。 而开胸心脏手术后一项潜在严重并发症即脑损伤,包括智力和认知功能障碍、注意力缺陷、多动症等[4]。 目前认为造成神经损伤的可能原因包括:术中脑部微栓子栓塞,脑缺血缺氧,低体温等[5]。 有研究显示神经炎症反应在创伤性脑外伤和脑缺血等许多中枢神经系统损伤过程发挥重要作用[6]。 CPB 后中枢神经系统的神经炎症反应可能也参与了术后脑损伤的产生[2]。 本研究观察到开胸组中炎性因子TNF-α、IL-6 及CRP 在术后明显升高,且在各时间点均明显高于介入组,说明产生了较明显的炎症反应。 除CRP 在术后24 h(T4)轻度升高外,介入组TNF-α、IL-6 和CRP 在手术前后未发生明显改变,提示介入治疗接近生理情况,未明显破坏机体内环境,对患者的应激更小,有利于避免全身炎症反应。
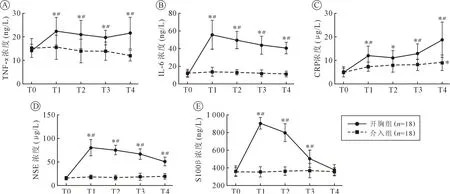
图1 开胸组与介入组血浆TNF-α、IL-6、CRP、NSE 及S100β 的表达变化

图2 NSE 和S100β 的表达与临床预后的相关性
神经损伤标志物如NSE 和S100β 被发现参与了许多中枢神经系统损伤过程[9],其中NSE 是一种主要表达在中枢神经系统神经元中的糖酵解蛋白。当神经元受损后,NSE 从神经元内释放进入脑脊液和血液中;而S100β 则是表达于神经系统内胶质细胞中的酸性钙结合蛋白。 在脑损伤早期,胶质细胞激活同时S100β 被释放入血。 因此神经元损伤和胶质细胞异常激活分别造成NSE 和S100β 的释放可以作为神经系统损伤的重要标志物。 本研究观察到介入组NSE 和S100β 的表达在手术前后无明显变化,提示无明显神经系统损伤。 然而开胸组NSE和S100β 在术后明显升高,且持续至少12 h,提示开胸组存在潜在脑损伤,且较介入组风险高。 同时本研究也观察到开胸组术后即刻血浆中NSE 和S100β 表达量最高,随时间推移两者均逐渐降低,S100β 在术后24 h(T4)降至术前水平,可能与S100β 半衰期较短有关[3]。 既往有研究指出S100β与NSE 的变化升高存在先后顺序[8],然而本研究并未在开胸组术后最初几个时间节点观察到两者表达的差异性,即两者均在术后即刻(T1)达峰,这可能与观察时间点设计不同有关。 此外,笔者分析了NSE 和S100β 表达量最高时,即术后即刻(T1)时与术后近期临床预后的相关性,结果显示NSE 和S100β 与ICU 住院时间及总住院日均无明显相关性。 该结果与以往文献报道类似[9],NSE 和S100β的升高并不改变近期临床预后,但其与远期脑损伤如认知功能或学习记忆能力的减退很可能密切相关。 有研究显示冠心病患者行停跳下冠状动脉旁路移植术其NSE 及S100β 的表达明显较不停跳下冠状动脉旁路移植者高,且与术后远期认知功能损伤密切相关[10],但在婴幼儿或儿童患者中究竟是否如此仍需要更长时间的随访与进一步分析研究。
综上,相比于先心病介入治疗,开胸心脏手术明显增加炎症反应的程度和脑损伤的风险,这可能与CPB 有关。 然而本研究依然存在局限性,如纳入的病例数较少,且为一项单中心研究,因此仍需多中心前瞻性随机对照研究进一步验证。

