术前MRI增强扫描对脑胶质瘤病理分级诊断及其与微血管密度的相关性*
陕西省西安市第四医院放射影像科 (陕西 西安 710003)
徐 华 彭 东 鲁龙龙
脑胶质瘤(BG)属于临床最常见颅内原发性神经上皮性肿瘤,各病例恶性程度及生物学行为特征异质性较大,其中低级别胶质瘤手术切除后通常可获得痊愈,而高级别胶质瘤则在术后需辅以放化疗,且预后效果相对较差[1]。然而脑组织活检目前仍在立体定位、有创性等方面存在较大局限,虽可作出准确诊断但实用性极低,因此仍有赖于术前影像学检查协助判定[2]。磁共振成像(MRI)作为临床广泛应用的颅脑无创检查方案,可在时间、空间维度提供较高分辨率,且借助多序列、多方位、多参数特点,提供丰富的解剖与形态学信息,其中尤其以动态对比增强扫描序列尤为突出,对定量描述瘤体血供特点有积极意义,尽管在BG诊断中已应用较多[3-4],但仍未将其与组织学微血管密度(MVD)之间建立起联系。对此,本研究旨在探索DCE-MRI分级诊断BG的加之及其与MVD相关性,取得成果报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2016年10月~2018年9月期间,于我院接受手术治疗的84例BG患者临床资料,其中男性50例,女性34例;年龄为22~68岁,平均(43.70±12.57)岁;星形细胞瘤42例,胶质母细胞瘤27例,少突胶质细胞瘤15例;位于颞叶43例,额叶15例,颞枕部15例,其他部位11例。
纳入标准:(1)术中组织学病理检查结果符合BG相关诊断标准且具备手术治疗指征者[5];(2)年龄在18~70岁之间者;(3)已证实血脑屏障被破坏者;(4)初次诊断且检查后2周内择期实施手术者。排除标准:(1)合并颅内高压、脑疝等其他颅内病变特征者;(2)肝肾功能障碍或对对比剂有过敏反应者;(3)全身健康状况较差或存在精神异常而无法配合检查者;(4)体内有金属植入物或伴幽闭恐惧症者。现以术中组织学病理检查结果为“金标准”,将其分为Ⅱ级组(n=35)、Ⅲ级组(n=21)与Ⅳ级组(n=28)。
1.2 仪器与检查方法
1.2.1 DCE-MRI检查方法:应用德国原装进口SIEMENS MAGNETOM Prisma 3.0T磁共振成像系统,患者取仰卧位头先进,佩戴64通道头颈联合专用线圈,以胼胝体下缘为中心,定位线平行于前后联合连线,范围自头顶至颅底,平扫序列如下,T1WI轴位:TR/TE=250ms/2.46ms,T2WI轴位:TR/TE=4090ms/99ms,T2-FLAIR轴位:TR/TE=8900ms/89ms,矩阵256×256,视野250mm,扫描层厚5.0mm;DCE采用T1-twist序列:TR/TE=4.09ms/4.42ms,矩阵265×265,视野260mm,扫描层厚3.50mm,行75期不间断动态扫描,第6期开始时团注钆喷酸葡胺注射液(生产企业:德国拜耳先灵医药股份有限公司,规格10mmol/20mL,国药准字J20080065)0.1mmol/kg,注射速率4mL/s,再以速率注射20mL生理盐水推进循环。
1.2.2 组织学病理检查方法:术中所获肿瘤组织液氮处理后-80℃低温保存,福尔马林固定并予以常规石蜡包埋切片,经由亲和素-生物素-过氧化物酶(SABC)免疫组化染色法,镜下观察瘤体细胞组织学形态,根据世界卫生组织(WHO)相关标准进行分级。另取切片,以CD43为血管内皮细胞特异性标记物,相同方法染色后低倍镜寻找微血管密集处,×200高倍镜下对阳性染色血管进行计数,选取5个视野取平均值计算为MVD。
1.3 图像处理与评估 图像数据离线拷贝至专用Syngo后处理工作站,通过平扫图像确立面积约为25~40mm2的兴趣区域(ROI),以两室交换模型构建时间-信号强度变化曲线,避开钙化、坏死、囊变区域,选定至少20个像素进行转运常数(Ktrans)、血管外细胞间隙体积分数(Ve)参数测量,取平均值后纳入统计。
1.4 统计学方法 将数据录入统计学软件SPSS 19.0进行分析,计数资料以例数或百分率(%)表示;计量资料先采取方差齐性与正态性检验,均确认具备方差齐性且近似服从正态分布,以(χ-±s)表示,组间整体比较采用单因素ANOVA方差分析,对差异有统计学意义指标,进一步实施LSD-t检验予以两两组间比较;相关性分析采用Spearman相关系数模型,组别赋值Ⅱ级组=2、Ⅲ级组=3、Ⅳ级组=4;上述方法均以双侧检验为准,当P<0.05时表明检验结果有统计学意义。
2 结 果
2.1 三组DCE-MRI定量参数及MVD比较 Ktrans比较结果显示,Ⅱ级组<Ⅲ级组<Ⅳ级组,差异均有统计学意义(均P<0.05);Ⅱ级组Ve、MVD水平均明显低于Ⅲ级组与Ⅳ级组,差异均有统计学意义(均P<0.05),而Ⅲ级组、Ⅳ级组间比较则均无统计学意义(均P>0.05),见表1。
2.2 相关性分析结果 Ktrans、Ve、MVD水平与BG病理分级均呈显著正相关性(均r>0且P<0.05),见表2。
3 讨 论
低级别BG通常表现出高分化肿瘤细胞的增殖性,细胞排列较为紧密,体积增大后对周围组织形成明显压迫,故特定神经压迫性体征尤为明显;而高级别BG多表现为低分化肿瘤细胞的浸润性,通常沿脑白质纤维束生长,弥漫性较强且外科手术难以将其完全切除,术后需实施辅助放化疗,且复发率偏高[6]。DCE-MRI可通过快速静脉注射顺磁性对比剂,通过血运使其分布于MRI扫描范围内的胞外组织液中,影响邻近质子共振、弛豫情况,影响程度取决于毛细血管分布、血管壁通透性及血管外间隙大小[7]。针对BG而言,脑部毛细血管通透性主要由脑血屏障完整性决定,血脑屏障破坏程度又与肿瘤恶性程度紧密相关[8],因此DCE-MRI中BG级别差异可获得良好呈现。既往已有研究报道高级别胶质瘤Ktrans、Ve水平均明显高于低级别胶质瘤,其临界值分别为0.035min-1与0.130min-1。本研究则从相关性角度进行分析,发现Ktrans、Ve与BG病理分级表现为显著正相关性,这表明BG级别越高则在DCE-MRI下显示Ktrans、Ve水平也越高,初步猜测认为高级别BG由于分化不成熟,新生血管基底膜因存在缺陷而通透性异常高,加之肿瘤细胞排列缺乏秩序,细胞间间隙较大,进而对Ktrans、Ve均可产生较大贡献。
表1 三组Ktrans、Ve、MVD水平比较
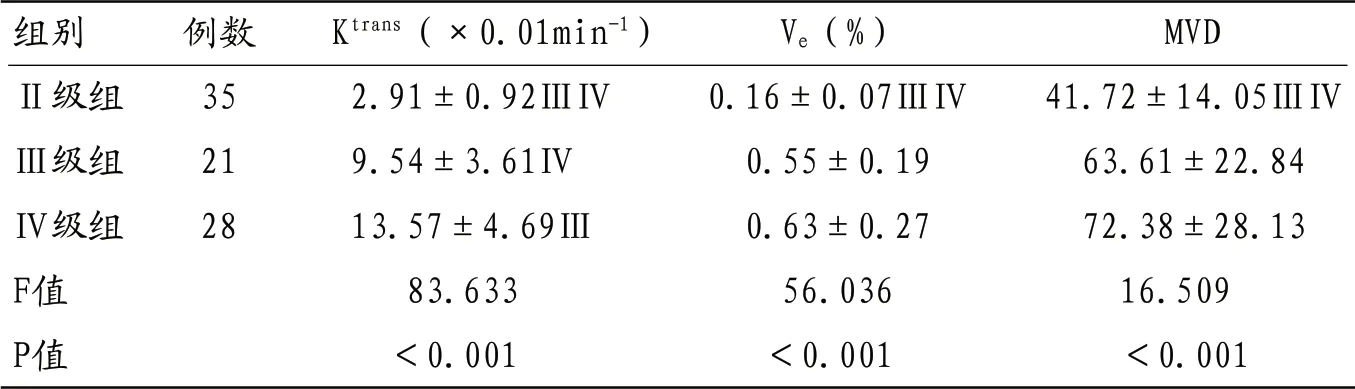
表1 三组Ktrans、Ve、MVD水平比较
注:与Ⅲ级组比较,ⅢP<0.05;与Ⅳ级组比较,ⅣP<0.05
组别 例数 Ktrans(×0.01min-1) Ve(%) MVDⅡ级组 35 2.91±0.92ⅢⅣ 0.16±0.07ⅢⅣ 41.72±14.05ⅢⅣⅢ级组 21 9.54±3.61Ⅳ 0.55±0.19 63.61±22.84Ⅳ级组 28 13.57±4.69Ⅲ 0.63±0.27 72.38±28.13 F值 83.633 56.036 16.509 P值 <0.001 <0.001 <0.001

表2 Ktrans、Ve、MVD水平与BG病理分级相关性统计值

图1-2 Ⅲ级组患者男,62岁,左侧颞叶受累,图1为T1-FLAIR轴位,图2为DCE-MRI增强峰值期图像,Ktrans=0.102min-1、Ve=0.54min-1、MVD=57.20。图3-4 Ⅱ级组患者男,47岁,右侧额叶受累,图3为T1-FLAIR轴位,图4为DCE-MRI增强峰值期图像,Ktrans=0.025min-1、Ve=0.12min-1、MVD=38.45。
肿瘤血管增生病理过程较为复杂,但高MVD水平无疑是肿瘤生长、浸润、转移的必备物质供应条件,也是目前抗肿瘤治疗的全新策略[9],DCE-MRI图像中则反映在兴趣区域早期增强方面。本研究发现,MVD与BG病理分级呈现明显正相关性,这表明BG瘤体血管增生活跃度越高,则BG达到级别越高,究其原因,与正常脑部毛细血管不同,低级别BG微血管通过窦状扩张增加血流供应,但高级别BG则选择通过芽状或细索状增生提高微血管密度以代偿瘤体高代谢效应。杨利民等[10]认为,BG的DCE-MRI诊断是以血脑屏障破坏为前提条件,部分恶性程度较高BG并未伴随脑血屏障破坏进则在DCE-MRI下显示为假阴性,这种情况下仍需借助弥散加权成像(DWI)、弥散张量成像(DTI)等序列规避对比剂影响以充分校正诊断结果。
综上所述,术前DCE-MRI能通过定量参数将BG病理学分级与解剖学MVD联系在一起,可准确反映肿瘤状态,有利于手术顺利施行,并通过制定早期干预措施改善患者预后。

