EAMG大鼠动物模型肾上腺免疫相关性研究
王 静,方丽洁,刘 颖,姜 雄, 况时祥
重症肌无力(myasthenia gravis,MG)是由乙酰胆碱受体抗体(AchR-Ab)介导的、细胞免疫依赖的、补体参与的、神经-肌肉接头传递功能障碍的、获得性自身免疫性疾病。该病在世界范围内的年发病率为8~20/10万,我国为0.5~2.5/10万,且呈渐进性升高趋势,初步估计,我国目前有重症肌无力患者60万人。MG病情易于反复,迁延难愈,严重者可累及呼吸肌而危及生命。肾上腺皮质激素是治疗MG的有效手段。近年来兴起的神经免疫内分泌网络学说认为,神经内分泌系统的下丘脑-垂体-肾上腺(hypothalamus-pituitary-adrenal axis,HPA)轴是脑调控免疫系统的主要传出通路。HPA轴通过分泌多种神经递质和细胞因子作用于免疫细胞上的相应受体及细胞因子。推测内分泌系统肾上腺皮质的功能失调或许在MG的发病与复发的机制中发挥了重要作用,而针对肾上腺细胞因子的干预或许能够在MG的治疗上有所突破。我们前期的研究表明,EAMG(experimental autoimmune myasthenia gravis,EAMG)大鼠下丘脑促肾上腺皮质激素释放激素CRH mRNA(corticotrpin releasing Hormone,CRH)表达明显异常,且HPA轴的损伤与EAMG发病有密切联系[1]。为了进一步探究MG发病内分泌相关免疫机制,本研究拟用Lewis大鼠与EAMG大鼠经典模型比较,并通过各组大鼠肾上腺中免疫相关性细胞因子蛋白的表达异常,如干扰素-γ(interferon-γ,IFN-γ)、转化生长因子-β(transforming growth factor-β,TGF-β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-2(interleukin-2,IL-2)、白细胞介素(interleukin-4,IL-4)、白细胞介素-17(interleukin-17,IL-17)等以期阐明其发病机制中的部分环节,为寻找MG治疗的作用新靶点提供依据。
1 实验材料和实验方法
1.1 实验动物 SPF级Lewis大鼠36只,雌性,6~8 w龄,体重100~150 g,由北京维通利华实验动物有限责任公司提供,许可证号:SCXK(京)2012-0001,检疫后送贵阳中医学院实验动物中心,标准大鼠颗粒饲料喂养。
1.2 主要试剂 鼠源性AchR-α亚基97-116肽段序列(R97-116),Sigma公司;完全福氏佐剂(CFA),Sigma公司;不完全福氏佐剂(IFA),Sigma公司;强的松片(规格5 mg/片)(国药准字H33021027),浙江仙琚制药股份;大鼠AchR-AbElisa测定试剂盒,上海蓝基生物科技有限公司(批号:E02A0203);动物组织总RNA提取试剂盒,天根生化科技有限公司;PrimescriptTM RTreagent Kit、SYBR Premix Ex TaqTMⅡ,引物设计,大连宝生物工程有限公司;Golview Ⅱ核酸染料,北京索莱宝科技有限公司;6×DNA Loading Buffer、DNA Marker,北京康润诚业生物科技有限公司;单抗3G10和1F3武汉博士德生物工程有限公司;HRP反应底物OPD Amerseco公司;ELISA封闭液(1%BSA),福州迈新生物技术有限公司;兔多克隆抗体(IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17),北京博奥森生物技术有限公司;抗原抗体稀释液(0.01 mol PBS,pH 7.4) ,福州迈新生物技术有限公司;苏木素、乙醇伊红,福州迈新生物技术有限公司;中性树胶,北京索宝来科技有限公司。
1.3 主要设备仪器 Σ960型全自动酶标仪,美国Metertech公司;T-500型电子天平,美国双杰兄弟集团有限公司;GS-15R 低温高速离心机,美国Beckman公司; HJ-2 二联磁力加热搅拌器,金坛市亿通电子有限公司;玻璃匀浆器,海门市三和建华玻塑仪器厂;DYY-6D型电泳仪,北京市六一仪器厂;Thermo NanoDrop2000紫外分光光度计,美国赛默飞公司;7500Real Time PCR system,美国赛默飞公司;Eio-rad T100PCR仪,美国赛默飞公司;SIM凝胶成像分析系统,美国GOLD-SIM公司;光学显微镜,日本OLYMPUS公司。
2 实验方法
2.1 实验分组 健康SPF级雌性Lewis大鼠36只,随机选取24只大鼠进行EAMG造模,另外12只作为对照组,将确定造模成功的大鼠再随机分为两组,每组各12只,分别为模型组、强的松组。造模成功2 w后各组分别予以灌胃治疗,模型组及对照组(等体积生理盐水)、强的松组(强的松5.4 mg/kg),大鼠灌胃给药体积为10 ml/kg,每日一次,连续4 w。
2.2 实验造模 首先将鼠源性AchR-α亚基97-116肽段序列(R97-116)、完全福氏佐剂(CFA)、磷酸缓冲液(PBS)三者按1∶1.5∶1.5的比例充分混匀制成免疫乳剂;首次免疫:取乳剂200 μl(含R97-116:100 μg)于造模鼠足垫、腹部、背部多点皮下注射,对照组皮下注射等量PBS;首次免疫后30 d及45 d,将R97-116、不完全福氏佐剂(IFA)、PBS三者按1∶3∶3的比例充分混匀制成免疫乳剂后,再取乳剂200 μl(含R97-116:50 μg)强化接种,对照组同样注射等量PBS。
2.3 各组大鼠的Lennon评分 给药前和给药4 w后分别进行行为学观察,各组大鼠肌力按Lennon分级法将其分为4级:0级:没有肯定肌无力表现;1级:撕咬无力,四肢力量较差,在光滑地面上前肢打滑,活动减少且易疲劳;2级:明显无力,休息时脊背呈隆起姿势,头尾下垂,大腿外展,前肢趾弯曲,动作笨拙,行走不稳;3级:严重无力表现,无嘶咬动作,肌肉震颤,呼吸困难,濒死或死亡。症状居中间者,分别评为0.5、1.5、2.5级。
2.4 EAMG大鼠造模成功的评价 造模结束后,灌胃前,经大鼠内眦静脉采血以酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法检测AchR-Ab滴度阳性率。ELISA基本操作步骤如下:用包被缓冲液将捕获抗体稀释,每孔100 μl,4 ℃过夜;吸去孔内包被液,PBST洗板,共洗5次,最后两次用吸水纸拍干;每孔加400 μl 1%BSA,室温封闭1 h,封闭非特异性结合位点;弃封闭液,每孔加100 μl抗原,置湿盒中,室温1 h;弃去孔内溶液,同上洗涤拍干;在各反应孔中加入酶标抗体稀释液100 μl,置湿盒中,室温1 h;弃去孔内溶液,同上洗涤拍干。于各反应孔中加入显色液200 μl,避光显色30 min;各反应孔中加入终止液(1 mol H2SO4)50 μl;结果测定:酶标仪上测读OD490(A)值。
2.5 RT-Q-PCR检测肾上腺细胞IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17基因表达量 灌胃4 w后,取出大鼠双侧肾上腺去掉包膜等多余组织放入EP管后,组织总RNA完整性检测取5 μl RNA样品+1 μl 6×DNA Loading Buffer进行1.2%琼脂糖凝胶电泳检测RNA完整性。电泳结束后在全自动凝胶成像分析系统下观看,RNA样品能看到非常明显的rRNA条带,28 SrRNA的量约为18 SrRNA的两倍,说明RNA的完整性较好。每个样本取1 μl RNA溶液,通过紫外分光光度计吸收测定RNA的浓度并检测总RNA的纯度,确定其高质量(见表1)。在37 ℃、15 min、85 ℃、4 ℃条件下逆转录合成cDNA后两步法进行内参基因与目的基因的实时荧光定量PCR反应:(1)引物序列(见表1)。(2)反应体系20 μl,扩增程序为95 ℃ 30 s、预变性95 ℃ 5 s、60 ℃ 34 s共40个循环,最后为溶解曲线反应阶段,反应结束后,采用相对定量比较CT值(△△CT)的方法得到目的基因mRNA表达的相对值。计算公式为:样品目的基因相对表达量(F)=2-△△CT(△△CT=各样品的△CT值-对照组平均△CT值),△CT=样品目的基因的CT值-样品管家基因的CT值(以β-actin为对照)。(3)反应完毕后对扩增产物进行1.2%琼脂糖凝胶电泳分析产物。
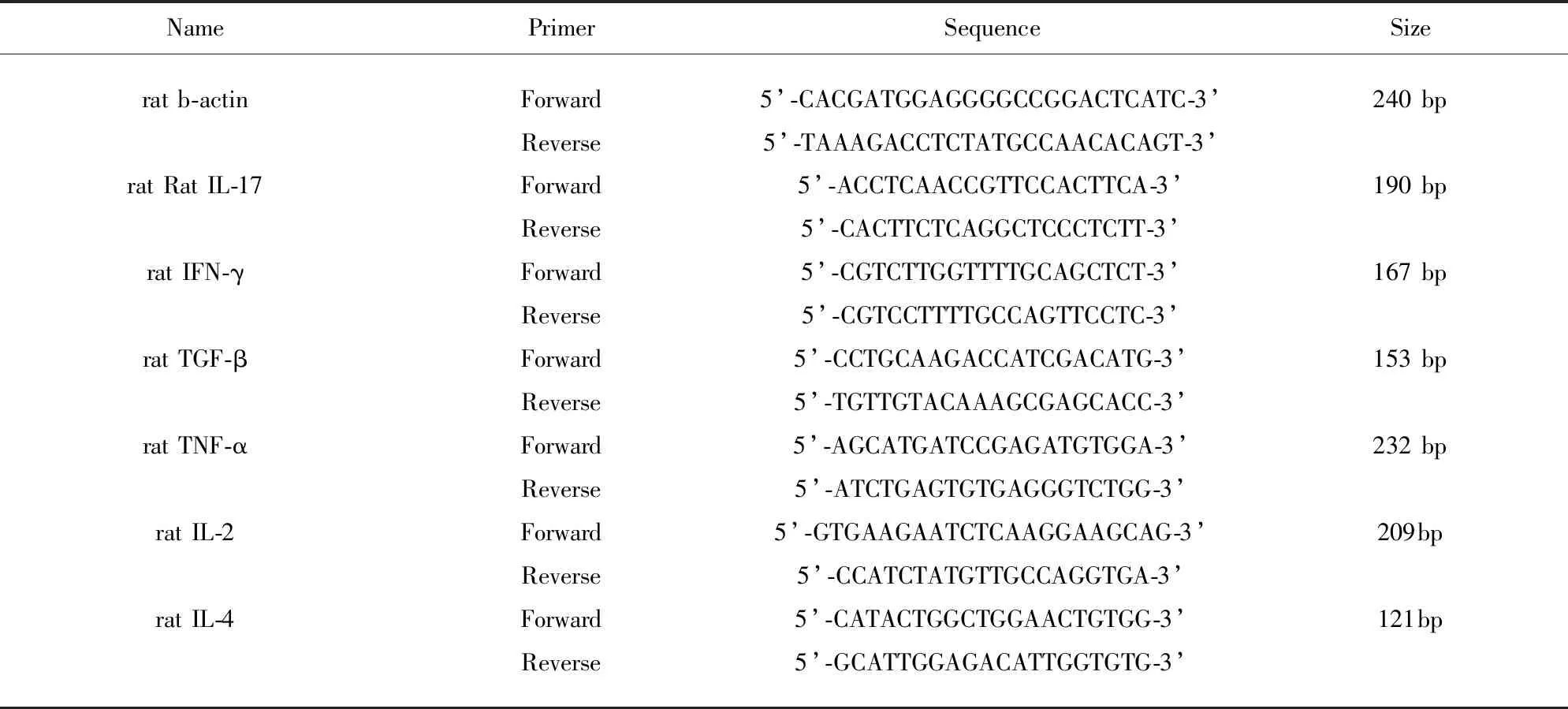
表1 引物序列
采用SPSS 19.0 统计软件进行数据处理,数据符合正态分布的用t检验,不符合正态分布的使用非参数检验,P<0.05为差异有统计学意义
3 实验结果
3.1 EAMG大鼠行为学表现 EAMG大鼠造模2 w后注射部位逐渐出现炎性反应,表现为足垫红肿,腹部及背部注射部位局部皮肤泛红,局部鼠毛干枯、稀疏、脱落,3 w后逐渐出现在光滑地面上行动变慢、前肢打滑,活动减少。4 w后部分EAMG大鼠或因咀嚼无力,或因足部感染,或抬头无力,而站立取食困难,出现消瘦。灌胃被持捏时背、颈部皮毛松弛,抓笼持续时间缩短,灌胃结束后出现呼吸困难、四肢无力,休息时脊背呈隆起姿势,头尾下垂,动作笨拙。可见1只因咀嚼减少门齿过度增生。另外,我们在预实验时发现,群居大鼠中若出现个别比较虚弱的个体,剩下的相对健壮的大鼠会将其咬死甚至吃掉部分尸体。故灌胃前,我们将肌无力症状较重的5只EAMG大鼠单独喂饲养,以排除因咀嚼吞咽困难而过度虚弱,被其它大鼠咬死而造成非实验性死亡的可能。灌胃前强的松组及模型组各死亡2只,灌胃结束前模型组死亡2只,共取材30只。
3.2 EAMG大鼠血清AchR-Ab滴度检测结果 ELISA法检测大鼠静脉血血清AchR-Ab滴度阳性率,其中有24只EAMG大鼠结果为阳性,其余大鼠结果均为阴性,阳性率约为66.7%,表明造模成功。
3.3 各组大鼠灌胃前后Lennon评分(见表2)。
3.4 灌胃4 w后各组大鼠血清AchR-Ab含量检测结果(见表3)。
3.5 RT-Q-PCR检测肾上腺细胞IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17基因表达量(见表4)。表2可见,灌胃前,EAMG大鼠肌力平均为1.38分,各组EAMG大鼠间评分无统计学差异;灌胃后,EAMG大鼠肌力平均为0.84分。强的松组与模型组比有统计学意义,且显著高于模型组,说明强的松能够显著改善EAMG大鼠肌无力症状。表3可见,与对照组大鼠比较,强的松组与模型组EAMG大鼠血清AchR-Ab含量有统计学差异,且显著高于对照组大鼠,说明造模成功;强的松组与模型组比较AchR-Ab含量有统计学差异,且低于模型组,说明强的松能有效降低血清AchR-Ab含量,进而有效治疗MG。表4可见,与对照组比较,模型组大鼠肾上腺中IFN-γ mRNA、TGF-β mRNA、IL-4 mRNA表达减少有统计学意义;而与对照组比较,模型组大鼠肾上腺中TNF-α mRNA、IL-17 mRNA的表达增加有统计学意义,且有显著差异;与模型组比较,强的松组大鼠肾上腺中IFN-γ mRNA表达减少,且有显著差异,而强的松组大鼠肾上腺中TGF-β mRNA、IL-4 mRNA、TNF-α mRNA、IL-4 mRNA、IL-17 mRNA的表达增加有统计学意义;在EAMG大鼠肾上腺中没有IL-2 mRNA的表达。
3.6 PCR产物电泳结果 除IL-2外,各组肾上腺细胞IFN-γ、TGF-β、TNF-α、IL-4、IL-17基因扩增产物电泳均在 Marker 100 bp~250 bp之间,约在200 bp处出现清晰的DNA条带。相应的位置出现扩增条带,与扩增产物的碱基数基本相符,故认为其基因在各组大鼠肾上腺组织内均有表达。

表2 各组大鼠灌胃前后Lennon评分比较
与对照组比较△P<0.01;与模型组比较*P<0.05
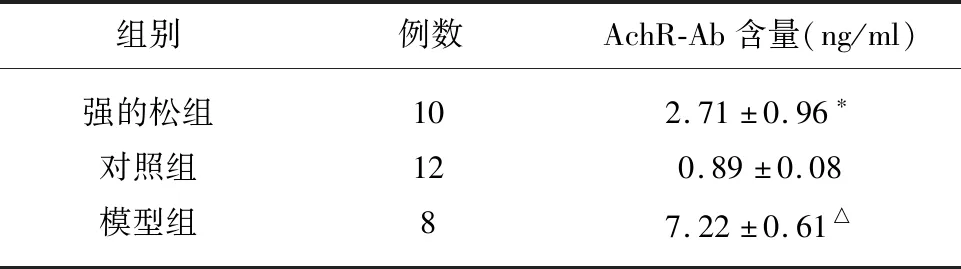
表3 各组大鼠AchR-Ab含量比较
与对照组比较△P<0.01;与模型组比较*P<0.05

表4 肾上腺细胞IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17基因表达量
与对照组比较△P<0.05,△△P<0.01;与模型组比较*P<0.05,**P<0.01
4 讨 论
影响EAMG造模成功的因素很多,已有的研究中,EAMG模型常见选用的有Lewis大鼠、Wistar大鼠或Ig转基因小鼠等,本实验选取的Lewis大鼠同Wistar大鼠相比具有HPA轴缺陷,我们前期的实验[1]已证明Lewis大鼠对EAMG的具有易感性。而在张芷荧[2]的研究中,EAMG模型选用的是C57BL/6小鼠,其血清IFN-α、IL-12、IL-17的含量与未造模组无明显差异,与我们前期的部分实验结果不一致,我们推测,这可能与C57BL/6小鼠免疫补体活性高、细胞免疫随增龄而降低且较易诱发免疫耐受性有关。我们认为C57BL/6小鼠免疫特性不如Lewis大鼠更稳定更适合EAMG的内分泌与免疫相关性研究。而AKR小鼠及SJL小鼠未见报道用于EAMG模型研究。Lewis大鼠虽然价格较高但对于研究EAMG是大家公认比较合适的传统实验动物。
自身免疫性疾病MG的发病机制涉及体液免疫及细胞免疫的异常、NK/NKT细胞紊乱、树突状细胞异常、遗传及内分泌因素等多种因素。CD4+辅助细胞性T细胞(helper T Cell,Th)在MG的发病中扮演重要角色。Th首先分化为TH0细胞,而后分化为Th1细胞、Th2 细胞、Th3细胞、Th17 细胞4种类型。Th1主要分泌IFN-γ、TNF-α、IL-2;Th2主要分泌TNF-α、IL-4;Th3主要分泌TGF-β;Th17主要分泌IL-17。其中,IL-2、IFN-γ、IL-4、TGF-β、IL-17均能同时作用于T、B淋巴细胞,同时参与细胞免疫与体液免疫。IFN-γ可抑制Th2细胞反应且可与细胞膜上的IFN-γR结合后,通过激活Jak1和Jak2激酶使无活性的信号传导于活化转录因子-1(signal transducer and actlvator of transcription-1,STAT-1)磷酸化为有活性的STAT-1,并使之聚合成二聚体转运至核内,激活具有抗原提呈功能的主要组织相容性复合物-Ⅱ(MHC-Ⅱ)基因的转录及其他转录因子的表达[3,4],增强抗原提呈进而促进致病性AChR-Ab产生[5]从而导致MG的发生。
TNF-α可促进胸腺细胞活化及增殖,也可通过诱导抗原递呈细胞,APC活化,促进产生IL-2和增强活化T细胞表达IL-2R而达到促进T细胞活化及增殖作用[6],促进T细胞活化及增殖作用。姜广建[7]等的研究结果显示AchR自身抗原刺激机体免疫系统,使能分泌TNF-α的单核巨噬细胞被激活,从而产生大量的TNF-α,从而使MG患者血清TNF-α水平明显高于正常。IL-4是Th2细胞分化的特征性细胞因子,能抑制Th1细胞产生细胞因子来抑制细胞免疫,并可以刺激B细胞增殖、活化转化成浆细胞并表达抗体来增强体液免疫。它是MG免疫诱导早期产生的效应因子,参与了MG免疫启动过程。已有的研究表明[8],IL-4在发生危象的MG患者外周血中水平极低,血浆置换病情明显好转后,IL-4至少增高两倍以上。也有研究显示,MG患者的IL-4水平与正常人无差异,胸腺瘤的MG患者IL-4 mRNA表达细胞的数量少于未切除胸腺的患者,发生危象的MG患者IL-4水平更低。因此推测IL-4可能是一种具有保护作用的因子。
TGF-β可由活化的T、B细胞及多种细胞分泌,可抑制B细胞增殖、分化及免疫效应,抑制抗原诱导的T细胞增殖反应,如抑制Th1、Th2细胞的功能,减少相应细胞因子,并能拮抗具有增强免疫活性的细胞因子的功能[9],是对EAMG具有免疫抑制作用的保护性细胞因子。MaCG[10]发现免疫耐受EAMG鼠淋巴器官中经AChR刺激后活化的TGF-β mRNA表达细胞数明显增加,说明TGF-β在免疫耐受中起免疫抑制功能。重组的TGF-β可抑制MG患者外周血单个核细胞因子中AChR诱导的炎性因子及穿孔素的产生[11]。TGF-β的降低导致受AChR刺激过度活化T、B细胞产生AChR-Ab,从而导致EAMG的发生。IL-17是新型辅助性T细胞Th17细胞的主要细胞因子,可促进T细胞活化,同时刺激上皮、内皮和成纤维细胞,促进产生大量促炎细胞因子[12],从而上调T细胞免疫应答。IL-17还可通过G蛋白Rgs13 和Rgs16调控信号的表达,实现在生发中心导致原始的B细胞积累[13]。
IL-17的增加可导致生发中心免疫应答的增加和B细胞数量的增加。并且,体外通过IL-17刺激,可以诱导AChR特异性B细胞的增加。Soltys等[14]用IgG免疫吸附剂给予重症肌无力的患者,结果发现重症肌无力患者严重程度有所减轻,检测治疗前后的IL-17水平,发现治疗后的IL-17减少。说明在EAMG发病过程中IL-17的增加可同时影响体液免疫和细胞免疫。IL-2是功能复杂并受多种细胞因子调节的具有促进 T、B 细胞增殖、分化和增强NK细胞杀伤毒性作用的细胞因子。一方面,IL-2在效应性T细胞与Treg细胞起负反馈调节作用,效应性T细胞分泌的IL-2能够维持并激活Foxp3+CD4+CD25+Treg,而Foxp3+CD4+CD25+Treg反过来可以抑制效应性T细胞产生IL-2[15]。魏秀丽等[16]的研究表明,IL-2可诱导Thl细胞增殖及产生INF-γ、激活巨噬细胞、刺激NK细胞、促进B细胞增殖及分泌抗体,起免疫增强作用,IL-2在MG患者血清中呈高表达,且其浓度的高低与AchR-Ab水平、肌无力严重程度及胸腺增生的具体情况关系密切。而另一方面,抗IL-2单克隆抗体复合物能够增强体内调节性T细胞的功能,从而抑制反应性T细胞及B细胞对AchR-Ab的反应,改善肌无力症状。
我们推测IL-2 mRNA在EAMG大鼠肾上腺中的未见表达的原因可能有以下几点:(1)肾上腺中IL-2R亚基组发挥免疫效用是通过与效应细胞膜上的IL-2R结合而发挥作用,高亲和力的IL-2R由3种亚基组成:IL-2Rα、IL-2Rβ和 IL-2γ[17]。其中,α亚基不参与信号转导,且单独的α亚基或β亚基对IL-2的亲和力很低、γ亚基对IL-2的亲和力几乎为零。β和γ亚基结合也只能形成中等亲和力的受体,但能结合大量信号分子活化多条信号通路。只有 α、β、γ 三者结合才能产生高亲和力的 IL-2R[18]。可能存在于EAMG大鼠肾上腺中的IL-2R仅具备3种亚基中的一部分,因此不能产生高亲和力的IL-2R;(2)细胞因子之间的相互作用。可能在EAMG发病前期,TNF-α促进胸腺细胞活化及增殖,也可通过诱导抗原递呈细胞,APC活化,促进产生IL-2,而后TGF-β的表达降低下调FOXP3的表达,从而通过阻断多种细胞因子表达所必须的转录活化因子NF-κB的活化来抑制IL-2的表达;(3)血清中IL-2R的竞争性结合。sIL-2R是活化的T淋巴细胞膜上IL-2R之一,是T细胞被激活的标志。可能由于MG患者变构的AchR作为自身抗原刺激了机体免疫系统,T细胞被激活后大量表达膜IL-2R,使血清sIL-2R水平升高,与膜IL-2R竞争结合免疫活性细胞周围的IL-2能力增加,而导致肾上腺中IL-2活性降低;(4)其他内分泌轴相关性。研究发现,MG患者比普通人更容易发生甲状腺疾病[19~21]。且MG患者中女性发病比例高于男性,结合我们前期的研究表明,MG发病与胸腺的病理改变关系密切[22,23],IL-2在EAMG大鼠外周血中的含量显著升高[24],我们推测,可能IL-2的表达与神经内分泌网络中的联系在下丘脑-垂体-性腺轴或下丘脑-垂体-甲状腺-胸腺轴中更为显著,其具体联系有待进一步研究。IL-2的双重特性使调控IL-2活性,选择性地增强Treg细胞功能成为研究的热点。近年来,基于Treg细胞高亲和力IL-2R的本构性表达等特点,出现了多种靶向Treg细胞治疗自身免疫性疾病的方法,这些治疗方法在临床试验和实验动物模型中均取得了良好的效果,为IL-2治疗自身免疫性疾病的新策略提供了新的靶向治疗前景[25],其在MG治疗中的应用值得期待。
我们的实验结果表明,肾上腺皮质激素强的松能有效下调IFN-γ mRNA、TNF-α mRNA、IL-17 mRNA在肾上腺的蛋白表达,同时保护肾上腺中IL-4 mRNA,TGF-β mRNA的蛋白表达,这可能是其治疗MG的作用机制之一。肾上腺是EAMG的发病过程中的环节之一,我们进而推测MG不仅仅是自身免疫性疾病,发病机制亦涉及内分泌系统的多个层次和环节,针对EAMG内分泌系统的治疗值得期待。

