ω-3不饱和脂肪酸DHA改善β淀粉样蛋白沉积致AD的小鼠模型记忆功能的机制研究
陆 冰,刘 洲,郑锡峰,刘广雁,林智君,陈秋萍
阿尔茨海默病(Alzheimer diseasa,AD)即老年性痴呆,是一种最为常见的神经系统退行性疾病,临床主要特征表现为失认、失语、记忆障碍、执行功能障碍、视空间技能损害和行为改变等。目前,β-淀粉样蛋白(amyloid-β,Aβ)假说是广泛认可的AD发病机制[1],Aβ1-42是一种常用的Aβ亚型,具有毒性强、易聚集等特点,可使Aβ斑块沉积引起神经毒性,造成突触损伤和神经元死亡,进而引发AD,多用于AD小鼠模型的建立。目前,临床上仍无治疗AD的特效药物。随着我国老龄化的加剧,AD越来越受到科学研究领域的关注和重视,寻找和研发改善AD患者认知功能、延缓疾病进展的新药物对AD患者的治疗具有重要意义。
二十二碳六烯酸(Docosahexaenoic acid,DHA)是深海鱼油和微藻油的主要成分,隶属ω-3不饱和脂肪酸(ω-3 polyunsaturated fatty acid,ω-3PUFA)。DHA作为一种天然的长链多不饱和脂肪酸,具有保护视网膜、促进生长发育、防治心血管疾病、抗癌、抗炎、延缓衰老、预防老年痴呆等重要作用[2],在机体代谢合成和生理病理过程中发挥着重要作用[3]。有研究指出,在老年人群脑内ω-3多不饱和脂肪酸丢失严重,摄入DHA有降低AD风险和改善大脑记忆障碍的作用[4~7]。然而,目前DHA改善AD记忆功能的机制并不明确,研究DHA改善AD记忆功能的作用机制对DHA延缓和治疗AD的临床应用具有重要意义。因此,本研究通过建立AD小鼠模型的方式,以DHA灌胃后观察其对神经炎症因子及相关蛋白的影响。
1 材料与方法
1.1 材料、试剂与仪器 SD健康雄性小鼠36只,体重21~27 g,月龄6 m,购于广东省实验动物中心;Aβ1-42和DHA购于美国Sigma公司;辣根酶HRP标记抗鼠或抗兔IgG(IgG-HRP)、脑源性神经营养因子(BDNF)抗体、干扰素-γ(IFN-γ)抗体、核转录因子-κB(NF-κB)抗体购于美国Santa Cruz公司;RIPA裂解液和BCA蛋白质定量测定试剂盒购于上海碧云天公司;ELISA试剂盒购于美国R&D公司;Morris水迷宫测试系统购于深圳瑞沃德公司;脑立体定位仪购于成都仪器厂。
1.2 Aβ致AD小鼠模型的建立及分组 采用Aβ-intrahippocampal injection方法:首先,将Aβ1-42溶于NH4OH(浓度1%)和无菌三蒸水,使其工作浓度为2 μg/μl,制备寡态Aβ1-42;将小鼠麻醉后,使用固定仪将头颅固定,去毛后沿正中切口,剥皮暴露前囟;选择前囟后2.2 mm,中线左右旁开1.7 mm,硬脑膜下2.0 mm,采用体积为25 μl微量进样器,向小鼠左侧侧脑室中注射2 μl寡态 Aβ1-42生理盐水;待注射完毕后留针2 min;缓慢拔针后,缝合切口;于切口处涂青霉素粉末;待小鼠清醒,将其放回笼内。将注射Aβ1-42的小鼠分为Aβ模型组和Aβ+DHA组,注射生理盐水的小鼠记为假手术组。每组小鼠均12只,于次日,采用灌胃方式给药,Aβ+DHA组小鼠每天以DHA按照300 mg/kg剂量灌胃,而Aβ模型组和假手术组给予等量的羧甲基纤维素钠灌胃,连续3 w后,开展后续实验。
1.3 Morris水迷宫实验 在上述各组小鼠给药15 d后,于次日开始进行定位航行实验和空间探索实验:定义小鼠从放入水中(面壁腹部朝下)到找到平台所需时间为潜伏期,如果小鼠未能在规定时间内(60 s)找到平台,则应给以引导。所有小鼠在平台的停留时间为15 s,实验重复3次,连续训练5 d。在实验结束1 d后,撤掉平台。按照原位置投放小鼠,观察并记录小鼠在60 s内的游泳路径,以及穿越原平台所在地点的次数。
1.4 尼氏染色 上述实验结束1 d后,进行尼氏染色:每组小鼠随机选取5只,先以生理盐水进行心脏灌流;麻醉处死后,分离大脑,并用4%多聚甲醛进行固定;经液氮冷冻后,采用冷冻切片机切取海马部位,作海马结构冠状面连续切片(厚度5 μm,每50 μm取片);冲洗后,经梯度酒精(50%、70%、80%、90%)脱水、透明、浸蜡、包埋和切片后制成石蜡切片;将切片置于载玻片上,滴加焦油紫染液,常温下反应15 min后,以95%酒精进行分色,显微镜下观察并控制染色;再经酒精梯度脱水和二甲苯透明后,以中性树胶封片;观察各组小鼠海马神经元的尼氏染色情况,200倍显微镜下统计单位面积的阳性细胞个数。
1.5 ELISA检测海马炎症因子TNF-α、IL-16检测 各组随机选取5只小鼠,断头取海马组织,按照ELISA试剂盒说明书检测海马炎性因子TNF-α和IL-16的含量。
1.6 Western blot检测海马BDNF、IFN-γ、NF-κB蛋白检测 取上述实验中的海马组织,以RIPA裂解液提取总蛋白,以BCA试剂盒定量:取蛋白样品50 μg,加5 μl 5×loading buffer混匀,沸水浴变性5 min,离心,上样至12% SDS-PAGE凝胶中电泳,其中,浓缩胶和分离胶的电压分别为80 V和120 V恒压;终止电泳后,取蛋白转印至PVDF膜;经TBST漂洗后,以脱脂奶粉-TBST封闭液处理2 h;37 ℃下,与用TBST 500倍稀释的BDNF、IFN-γ、NF-κB和β-actin抗体4 ℃反应过夜;次日洗膜后,加入TBST 1000倍稀释HRP-IgG二抗,常温下孵育1.5 h;洗膜后,滴加ECL试剂显色;采用Gel-Pro Analyzer 6.0凝胶定量软件分析BDNF、IFN-γ、NF-κB蛋白条带灰度,以目的蛋白与β-actin蛋白的灰度值表示相对表达量。
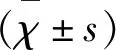
2 结 果
2.1 DHA对Aβ致AD小鼠记忆功能的影响 记录5 d内的小鼠航行,定位小鼠的潜伏期和穿越平台的次数,结果(见表1)。与假手术组相比,Aβ模型组和Aβ+DHA组小鼠的潜伏期显著延长(P<0.05),而Aβ+DHA组潜伏期较Aβ模型组小鼠有所降低(P<0.05);同时,注射Aβ后小鼠穿越平台的次数较假手术组显著减少(P<0.05),而在注射Aβ基础上给予DHA后,穿越次数又有所增加(P<0.05)。可见,DHA能够改善Aβ所致AD小鼠的记忆功能障碍。
2.2 DHA对小鼠海马神经元的影响 注射Aβ的小鼠海马神经元有大量缺失,尼氏染色阳性细胞数所减少,与假手术组相比,差异有统计学意义(P<0.05);在注射Aβ基础上给予DHA灌胃后,尼氏染色阳性细胞数较Aβ模型组显著增多(P<0.05)。结果反映了DHA可以改善Aβ注射后引起的神经元损伤(见表2)。
2.3 DHA对Aβ致AD小鼠海马TNF-α、IL-16含量 与假手术组比较,Aβ模型组和Aβ+DHA组小鼠海马组织中TNF-α和IL-16含量显著升高,统计学分析差异有显著性(P<0.05);给予DHA灌胃后,海马组织中TNF-α和IL-16含量较Aβ模型组显著降低,差异有统计学意义(P<0.05)。结果显示,DHA对Aβ致AD小鼠功能障碍的改善作用与下调TNF-α和IL-16含量有关(见表3)。
2.4 DHA对Aβ致AD小鼠海马BDNF、IFN-γ、NF-κB蛋白的表达 不同小组中小鼠海马组织中BDNF、IFN-γ、NF-κB蛋白的表达存在差异,注射Aβ后,BDNF蛋白表达水平降低,而IFN-γ和NF-κB蛋白表达水平升高,与假手术组比较,差异均有统计学意义(P<0.05);在注射Aβ并给予DHA干预后,由Aβ引起的BDNF蛋白表达降低、IFN-γ和NF-κB蛋白表达升高的结果受到减弱。表明,DHA可促进BDNF蛋白表达,抑制IFN-γ和NF-κB蛋白表达(见图1、表4)。
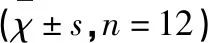
表1 DHA对Aβ致AD小鼠潜伏期及穿越平台次数的影响
与假手术组相比*P<0.05;与Aβ模型组相比#P<0.05
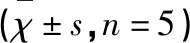
表2 各组小鼠神经元的尼氏染色阳性细胞数比较
与假手术组相比*P<0.05;与Aβ模型组相比#P<0.05
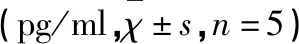
表3 各组小鼠海马组织中TNF-α和IL-16含量的比较
与假手术组相比*P<0.05;与Aβ模型组相比#P<0.05
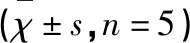
表4 各组小鼠海马组织中BDNF、IFN-γ、NF-κB蛋白的相对表达量
与假手术组相比*P<0.05;与Aβ模型组相比#P<0.05

图1 Western blot检测各组小鼠海马组织中BDNF、IFN-γ、NF-κB蛋白的表达结果
3 讨 论
AD是一种隐匿性慢性疾病,其发病前在临床前期表现为轻度认知障碍。调查数据显示,每年在有轻度认知障碍的65岁以上老年人中AD的发病率占到95‰[8]。已步入老龄化的我国,到2053年之前老年人口规模将不断攀升,AD的发病率也有上升的趋势,这将为家庭和社会带来巨大的负担,严重影响着我国人们的生活质量[9,10]。因此,改善AD患者认知障碍药物的研究一直是医学研究领域的热点。DHA广泛存在于多种海洋生物中,在延缓和改善AD记忆功能方面具有很好的作用,是一种很有潜力的治疗和改善AD的药物[5]。本研究通过注射寡聚态Aβ1-42建立AD小鼠模型,探讨DHA对小鼠记忆功能的影响。结果发现,DHA可改善Aβ1-42所致AD小鼠的记忆功能障碍和神经元损伤。此结果进一步验证了王佳等[11]关于DHA改善AD学习记忆实验结果。
近年来,越来越多的证据表明,炎症反应是Aβ造成神经毒性引发AD的主要致病原因之一[12~14]。处在AD脑内神经元损伤部位的小胶质细胞可以不断被激活,产生大量如IL-1β、IL-6、TNF-α和IFN-γ等炎症因子,进而引发脑内的炎症反应[15]。本研究通过检测DHA干预后AD小鼠模型中TNF-α和IL-16的含量变化,BDNF、IFN-γ、NF-κB联蛋白表达来探讨和评估DHA对改善AD记忆功能障碍的分子机制。结果显示,DHA可抑制Aβ1-42所引起的TNF-α和IL-16含量上升;进一步检测炎性因子IFN-γ蛋白的表达发现,Aβ1-42所引起IFN-γ蛋白升高也受到抑制。此结果与陈祥荣等[16]得出DHA能够降低小胶质细胞介导的中枢性炎症反应中TNF-α、IL-6和IL-1β等炎性因子的表达结果相吻合。提示,DHA可能通过抑制小胶质细胞分泌炎症因子TNF-α、IL-16和IFN-γ等改善AD功能障碍。BDNF是神经营养家族中的重要成员,在维持神经元生长和损伤后修复方面发挥着重要作用,低水平的BDNF与AD的发生发展关系密切[17]。NF-κB联是一种重要的转录调节因子,在胶质细胞介导的神经炎症中发挥着重要作用[18]。研究结果显示,DHA还可以促进BDNF和抑制NF-κB联蛋白表达,提示,DHA可能通过上调BDNF表达改善神经元的损伤,抑制NF-κB联信号通路激活介导AD的炎症反应。
综上所述,DHA可以改善Aβ1-42致AD小鼠模型记忆功能障碍,其作用机制可能与降低海马组织中TNF-α和IL-16含量,抑制IFN-γ和NF-κB联蛋白表达,促进BDNF蛋白表达有关。这一结果为DHA治疗AD记忆功能障碍的临床应用提供了新的理论依据。

