MRI对卵巢囊实性上皮性肿瘤的定性诊断价值
孔伟 郭强 林文聪 陈文坚 谭丽珊
[摘要] 目的 探讨MRI对鉴别囊实性卵巢上皮性肿瘤(EOT)良、恶性的价值。 方法 回顾性分析2018年1月~2020年4月我院69例囊实性卵巢EOT患者的影像学资料。将肿瘤分为良性、恶性两组,记录肿瘤的MRI征象并比较各征象在两组肿瘤间的差异。绘制ROC曲线评价定性诊断效能,计算ROC曲线下面积(AUC)。 结果 肿瘤的形态、边界、构成、实性成分强化程度、实性成分弥散情况及腹膜转移在两组EOT间差异有统计学意义(P<0.05),肿瘤的大小及腹水组间比较差异无统计学意义(P>0.05)。肿瘤的弥散情况在鉴别诊断中有较高的敏感性(0.848)和特异性(0.971),各征象联合能显著提高诊断AUC(0.932)。 结论 MRI能很好地显示肿瘤内部结构特征,联合平扫、增强及DWI图像上的各种征象能提高囊实性EOT的定性诊断效能。
[关键词] 卵巢上皮性肿瘤;囊实性肿瘤;磁共振成像;影像诊断
[中图分类号] R737.31 [文献标识码] B [文章编号] 1673-9701(2020)34-0108-04
[Abstract] Objective To investigate the value of MRI in differentiating benign and malignant cystic and solid epithelial ovarian tumors(EOT). Methods The imaging data of 69 EOT patients with EOT in our hospital from January 2018 to April 2020 were retrospectively analyzed. The tumors were divided into the benign group and the malignant group. The MRI signs of the tumors were recorded, and the differences between the two groups of tumors were compared. The ROC curve was drawn to evaluate the qualitative diagnostic efficiency and the area under the ROC curve(AUC) was calculated. Results The tumor morphology, boundary, composition, solid component enhancement degree, solid component diffusion, and peritoneal metastasis were significantly different between the two groups of EOT(P<0.05). There was no difference in the tumor size and ascites between roup(P>0.05). Tumor diffusion had high sensitivity(0.848) and specificity(0.971) in the differential diagnosis, and the combination of various signs can significantly increase the AUC(0.932). Conclusion MRI can show the internal structural features of the tumor well, and the combination of various signs on the plain scan, enhanced, and DWI images can improve the qualitative diagnostic efficiency of cystic EOT.
[Key words] Epithelial ovarian tumor; Cystic solid tumors; Magnetic resonance imaging; Imaging diagnosis
卵巢上皮性腫瘤(Epithelial ovarian tumor,EOT)约占卵巢肿瘤的60%~70%,其发病较隐匿,早期无明显症状,临床缺乏敏感而特异的诊断方法,病死率居妇科肿瘤首位[1]。影像学检查是发现卵巢肿块的主要手段,包括超声、CT、MRI及PET/CT。超声检查在诊断恶性肿瘤方面有较高灵敏度,较低特异性的特点[2]。CT及PET/CT均存在辐射风险,同时PET/CT易受膀胱和输尿管内残存放射性核素及肠道非特异度摄取18F-FDG的干扰而影响诊断效果。MRI是一种无创的影像学检查技术,具有高软组织分辨率的特点,通过多序列、多平面、多参数的立体成像能够很好地显示肿瘤的结构、形态学、血供来源及血流动力学特征,有助于卵巢肿瘤的定位、定性诊断[3-6]。本研究收集含囊、实性成分的EOT资料旨在分析MRI在肿瘤良、恶性鉴别中的价值,为临床诊断及治疗提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2018年1月~2020年4月期间前来我院行盆腔MRI检查的EOT患者资料。纳入标准:①附件区同时含囊性及实性成分的肿瘤;②经手术病理证实为EOT;③图像质量好、无伪影等。排除标准:①实性肿块(不含囊性成分)或纯囊性肿块(不含实性成分);②卵巢非上皮性肿瘤;③影像学检查前已行治疗(如手术、放疗或化疗等)或侵入性检查。符合标准共69例,主要临床表现为不同程度腹胀或腹痛,伴或不伴阴道流血、月经紊乱、体重下降,CA125 10.2~2533 U/mL(参考值0~35 U/mL),年龄21~84岁,中位年龄53.1岁。所有患者均行MRI平扫、DWI及增强扫描,检查征得患者及家属同意,使用造影剂者签署知情同意书。
1.2 检查方法
采用荷兰飞利浦公司Achieva 1.5 T磁共振,体部相控阵线圈。所有患者均行常规平扫及增强扫描,范围从盆底到脐孔,病灶较大者增大扫描上限以保证包括肿瘤全部,训练呼吸后屏气扫描并适当运用呼吸门控。
平扫序列及参数:T1WI轴位(TR529 ms,TE14 ms,层厚6 mm,间隔1 mm,FOV 350 mm×380 mm,重建矩阵256×256),T2WI轴位及矢状位(TR3500,TE90 ms,层厚5~6 mm,间隔1 mm,FOV 350 mm×380 mm,重建矩阵256×256),T2-SPAIR冠状位(TR2300 ms,TE70 ms,层厚5 mm,间隔1 mm,FOV 350 mm×380 mm,重建矩阵256×256)。
弥散加权成像(Diffusion-weighted imaging,DWI)采用横断面单次激发自旋回波-平面回波成像序列(SE-EPI)(TR2500 ms,TE85 ms,层厚5 mm,间隔1 mm,FOV350 mm×380 mm,矩阵256×256),增强前进行,行横轴位成像,三个方向施加扩散敏感梯度磁场,b值取0、800 s/mm2,平均次数为6次。扫描完成后生成表观弥散系数(Apparent diffusion coefficient,ADC)图。
增强对比剂选用钆喷酸葡胺(Gd-DTPA),注射剂量为0.2 mmol/kg,手臂静脉人工推注,注射对比剂后行横断面、冠状位及矢状面T1WI扫描。
1.3 图像处理与分析
所有图像传至PACS,由两名具有10年以上妇科影像诊断经验的放射科医师在未告知病理结果的前提下共同分析,达成一致意见。观察征象包括:①大小(最大径);②形态:规则、不规则;③边界:清晰、模糊(包括向周围侵犯);④构成:囊性为主(实性成分<1/3)、混合囊实性(实性成分≥1/3);⑤实性成分强化程度(与正常子宫肌层强化程度比较):高、低强化;⑥DWI上实性区弥散受限情况:受限、不受限;⑦腹水:有、无;⑧腹膜转移:有、无。
手术病理标本由10%甲醛固定并经脱水、浸蜡、包埋后切片,行苏木素-伊红(HE)染色,在显微镜下观察细胞形态学改变;再行免疫组织化学染色观察组织抗原。各组切片由2名具有病理副主任医师以上职称者综合分析、作出结论。
1.4 统计学分析
所有肿瘤依据病理结果并对照WHO分类(2014版)分为良性、交界性及恶性,将良性者记为良性EOT;交界性及恶性者归为恶性组,记为恶性EOT。采用SPSS 25.0及MedCalc19.0统计软件联合分析,计量资料以(x±s)表示。比较各征象在良、恶性EOT组间的差别:分类变量使用χ2检验或Fisher检验,计量资料使用t检验,P<0.05为差异有统计学意义。
运用受试者工作特征曲线(Receiver operation characteristic curve,ROC)评价具有统计学差异的征象对肿瘤定性诊断的效能,计算曲线下面积(Area under curve,AUC)。
2 结果
2.1 病理分类
良性EOT 31例,双侧者5例,共36个;恶性EOT 38例,双侧者8例,共46个,其中交界性肿瘤12个,卵巢癌34个。
2.2 影像征象
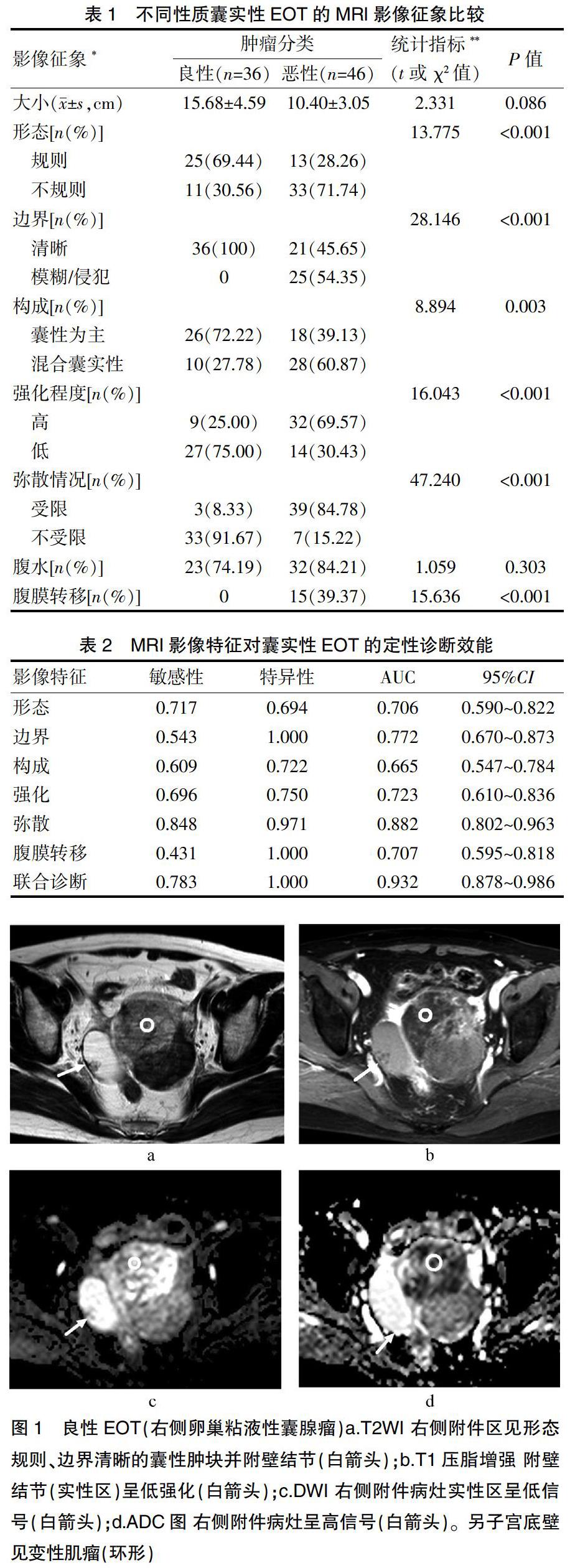
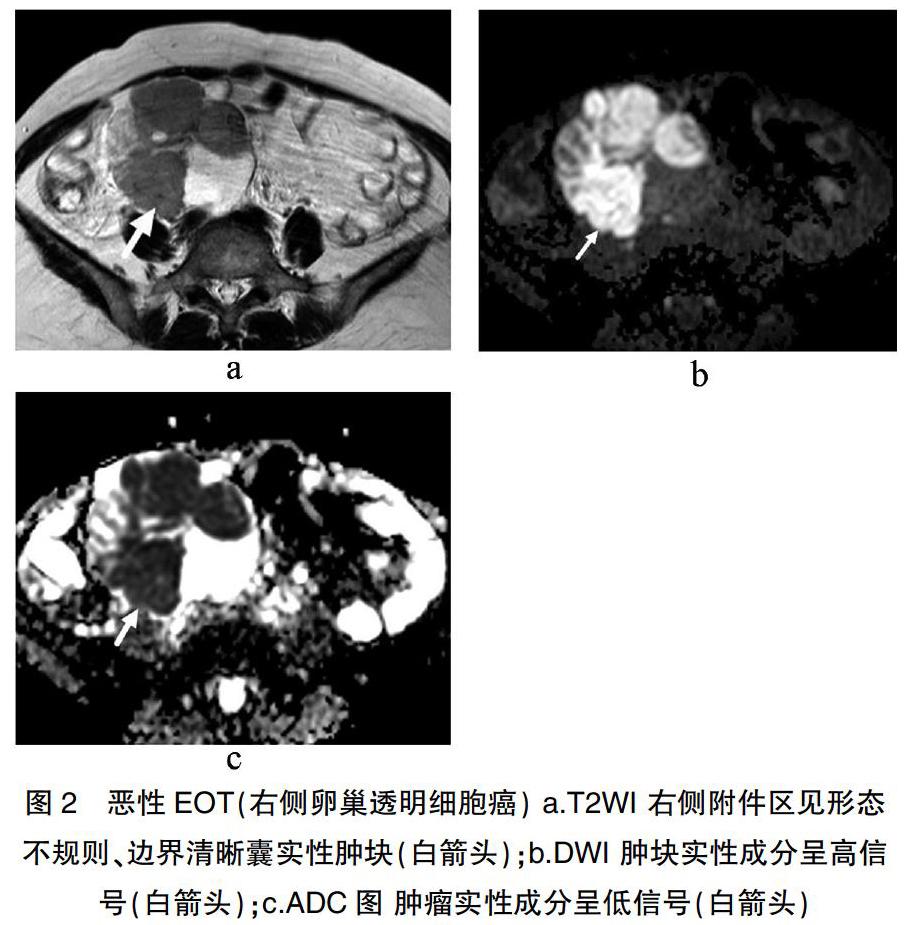
良性EOT多表现为以囊性为主、形态规则、边界清晰的肿块,实性成分多为低强化、极少弥散受限、无腹膜转移,见图1。恶性EOT多表现为混合囊实性、形态不规则、边界模糊的肿块,实性成分多为高强化、弥散大多受限,见图2。肿瘤的形态、边界、构成、实性成分强化程度、实性成分弥散情况及腹膜转移在两组EOT间均有明显差异(P<0.05),肿瘤的大小及腹水组间无差异(P>0.05)(表1)。
2.3 鉴别诊断效能
腫瘤的形态、边界、构成、强化程度、弥散情况、腹膜转移在鉴别诊断中的敏感性及特异性分别为0.717、0.543、0.609、0.696、0.848、0.431及0.694、1.000、 0.722、0.750、0.971。单独运用弥散特征进行鉴别有较高的AUC(0.882),各征象联合能显著提高诊断AUC(0.932)(表2)。MRI征象对恶性EOT(定性)诊断的ROC曲线见封三图5。
3 讨论
囊实性EOT包含了多种组织类型和分化程度的肿瘤,病理上分为良性、交界性和恶性三类,不同性质的肿瘤在治疗选择及预后改善上有极大差异。交界性肿瘤尽管预后较恶性肿瘤好,但是因其有一定侵袭性及转移特性被归为卵巢上皮癌[7],本次研究分组基于相同理由,仅分为良、恶性两个组别。良性者病灶多见于膨胀性生长,恶性组生长较快,各部分增长速度不均匀,常向周围浸润。
过往报道显示MRI在EOT的术前诊断及鉴别诊断上有较多优势[8-10]。本组病例显示两组肿瘤在形态上存在差异,良性组更多表现出规则形状,一定程度上反映了其生长特性。然而,由于组织类型及内部构成等方面的不同,良性肿瘤也可能表现为分叶或不规则状,低级别、分化较好的恶性肿瘤也可能是规则形态,其对肿瘤定性诊断的敏感性及特异性均较低。肿瘤内部结构及强化程度能反映出肿瘤的分化和血供[11]。不同病理组织的细胞结构及血液供应源、供应量存在差异,本次结果良性组大多为囊性为主(实性成分<1/3)、实性成分低强化,恶性组多为混合囊实性(实性成分≥1/3)、实性成分高强化,反映了相对于良性者,恶性EOT内细胞含量多、间质含量较少及新生血管更丰富。部分良性EOT实性成分较多与高强化,推测可能与肿瘤的组织学类型及血供差异相关。病灶的边界及腹膜转移在良、恶性EOT间有显著性差异,肿瘤的边界模糊和(或)腹膜转移的出现对良性肿瘤有绝对的阴性预测价值(阴性预测值100%),对恶性肿瘤提示的特异性特别高(1.000)。过往研究认为,良性肿瘤虽然没有腹膜转移,但是黏液性肿瘤偶可见破裂瘤种植于腹膜形成腹腔黏液瘤[12],这在本组病例中没有出现。肿瘤的大小及腹水的有无在两组EOT间没有差异。
DWI是通過无创观察体内水分子弥散特点来其反映各组织微观结构变化的方法。相关研究表示[13-15],水分子的活动与组织密度、数目、内外间隙、排列方式等有关:组织弥散受限表示肿瘤细胞密集、数量较多、细胞外间隙小的组织;反之,则提示肿瘤细胞疏松、数量较少、细胞外间隙大。本研究显示,两组肿瘤实性部分弥散情况有差异:恶性组绝大部分病例弥散受限,而良性组绝大部分病例弥散不受限。结果与恶性卵巢肿瘤细胞呈多层排列、细胞密集度高及良性卵巢肿瘤细胞呈单层排列、细胞密集度低的特点相符,且对肿瘤的定性诊断有较高的敏感性和特异性(分别为0.848和0.971)。
尽管多个MRI征象在两组囊实性EOT间存在差异,但是单个征象在组间仍旧有较大重叠,受诊断敏感性和/或特异性的影响,单独运用鉴别良、恶性EOT的价值不高。联合有差异的各征象进行定性诊断能使AUC值达到最优。此外,本次为回顾性研究,病例存在一定的选择偏倚;其次,单中心、样本量有限,且病例分布不均,结果尚需要大样本研究进一步证实。
总之,MRI检查能够较好反映肿瘤的整体及内部结构特征,对囊实性EOT鉴别诊断有重要价值,DWI上肿瘤的弥散程度较其他征象有较高的敏感性和特异性,联合平扫、增强及DWI图像上的各种征象能提高囊实性EOT的定性诊断效能。
[参考文献]
[1] 温蒙科,熊廷川,沈谷群,等.卵巢交界性肿瘤保留生育功能的不同手术方式疗效对比[J]. 新疆医学,2018,48(1):36-39.
[2] CT及MRI在卵巢上皮交界性与恶性肿瘤鉴别中的研究进展[J].实用放射学杂志,2019,35(3):478-480,490.
[3] Mukuda N,Fujii S,Inoue C,Fukunaga T,et al.Bilateral ovarian tumors on MRI:How should we differentiate the lesions?[J].Yonago Acta Med, 2018,61(2):110-116.
[4] An H,Lee EYP,Chiu K,et al.The emerging roles of functional imaging in ovarian cancer with peritoneal carcinomatosis[J].Clin Radiol,2018,73(7):597-609.
[5] Sharma SK,Nemieboka B,Sala E,et al.Molecular imaging of ovarian cancer[J].J Nucl Med,2016,57(6):827-833.
[6] 武庆利,赵祖来,付剑平,等.CT及MRI显示卵巢血管和输卵管对盆腔肿瘤的诊断价值[J].临床放射学杂志,2018,37(3):466-470.
[7] Zeppernick F,Meinhold-Heerlein I.The new FIGO staging system for ovarian, fallopiantube,and primary peritoneal cancer[J].Arch Gynecol Obstet,2014,290(5):839-842.
[8] 宋宏涛,时惠平,柴晓媛,等.卵巢上皮性肿瘤的MRI表现与病理对照分析[J].中国中西医结合影像学杂志,2016,14(4):396-399.
[9] Li YA,Qiang JW,Ma FH,et al. MRI features and score for differentiating borderline from malignant epithelial ovarian tumors[J]. Eur J Radiol,2018,98:136-142.
[10] 连鹏,潘静.MRI对卵巢交界性肿瘤和上皮性卵巢癌的鉴别诊断价值[J].实用癌症杂志,2019,34(8):1358-1361.
[11] 任明达,刘树学,唐玉德,等.卵巢肿瘤定性诊断及卵巢癌术前分期:MRI与病理对照研究[J].中国CT和MRI杂志,2015,13(4):87-90.
[12] 李院华,喻思思,康红祥,等.卵巢囊实性占位性病变的MRI诊断[J].放射学实践,2014,29(9):1021-1024.
[13] Gueli Alletti S,Rossitto C,Perrone E,et al.Needleoscopic conservative staging of borderline ovarian tumor[J].J Minim Invasive Gynecol,2017,24(4):529-530.
[14] 张朝晖,李竹浩,方字文.不同b值组合时Vx2肿瘤ADC值差异的评估及与肌肉的比较[J].广东医学,2017,38(9):1329-1332.
[15] 石良瑜,陈萍,江燕萍.DCE-MRI与DWI对不同性质囊实性卵巢肿瘤的诊断价值分析[J].中国CT和MRI杂志,2019,17(6):119-121.
(收稿日期:2020-06-09)

