大豆肽减轻β-淀粉样蛋白肽诱导的小鼠原代海马神经元损伤*
马永超 范文娟 饶淑梅 赵丽芳 黄亚蓝 金少举 崔明辰△
(1 漯河医学高等专科学校,漯河 462002;2 河南省南街村集团,临颍 462600;3 河南省肿瘤发生与防治创新型科技团队,漯河 462002)
阿尔茨海默病(Alzheimer’s disease,AD)特征性病理学改变为细胞内神经元缠结、细胞外出现大量由β-淀粉样蛋白肽(β-amyloid peptide,Aβ)构成的老年斑以及神经元缺失[1]。有研究认为,Aβ的过量产生和沉积引发的神经毒性是导致AD 病变过程逐渐加重的重要原因[2-4]。这种毒性作用可以触发病理级联反应,引发炎症反应、氧化损伤、线粒体功能障碍以及细胞骨架的破坏,从而进一步导致神经功能的损害以致细胞死亡[5-6]。许多抗氧化剂都有保护原代神经细胞及克隆的细胞系免受Aβ毒性损伤的作用[7-8]。大豆肽(soybean peptide,SBP)具有较强的抗氧化作用,其内含有多种抗氧化物质[9],研究表明,大豆肽可通过消除自由基及螯合金属离子等方式发挥抗氧化作用[10]。但大豆肽能否对抗Aβ 毒性并产生神经保护作用,目前尚未有相关的研究报道。Aβ25-35为Aβ 位于第25~35位氨基酸位点的基因片段,是引起神经毒性的主要活性部位。体外研究显示,Aβ25-35可以降低PC12细胞的存活率,诱导细胞发生凋亡以及细胞骨架解体,并具有剂量依赖性[11-13]。因此,本实验应用Aβ25-35作用于原代培养的小鼠海马神经元,建立体外AD 神经元模型,研究大豆肽对Aβ 损伤的海马神经元是否具有保护作用,为大豆肽在AD 治疗方面的开发应用提供实验依据。
1 材料和方法
1.1 材料
C57BL/6 小鼠购于南京大学模式动物研究所。细胞培养所用试剂购自美国Gibco 公司;Aβ25-35购自美国Sigma 公司;大豆肽购自湖北瑞邦生物科技有限公司,DAPI 购自美国Invitrogen 公司;小鼠抗caspase-3 抗体,小鼠抗caspase-9 抗体、兔抗β-actin多克隆抗体均购自美国Santa Cruz 公司;HRP 标记的羊抗小鼠IgG 购自北京中杉金桥生物公司;抗干扰Lowry 法蛋白定量试剂盒购自珠海健康元生物技术公司;ECL 化学发光试剂盒购自北京索莱宝公司;兔抗β-Ⅲ-tubulin 多克隆抗体、小鼠抗微管相关蛋白2(MAP2)单克隆抗体购自美国Abcam 公司;Alexa 568 结合的羊抗小鼠IgG 、Alexa 488 结合的羊抗兔IgG 购自美国Invitrogen 公司;BX61 型荧光显微镜购自日本Olympus 公司。
1.2 原代神经元培养
取孕18.5 d 母鼠拉颈处死,取出胎鼠,剥离胎鼠海马,0.25%胰酶消化15 min,加入神经元预培养液(MEM,10% 胎牛血清,1 mmol/L 丙酮酸钠,100 U 青/链霉素双抗,1× GlutaMAX)终止酶反应,并反复吹打10~20 次,将海马组织吹散成单细胞;计数后按照1×105/mL 分别接种至24 孔板、96 孔板以及6 cm 培养皿中。随后放入37 ℃ CO2培养箱3~5 h 后,换成神经元培养液(neurobasal medium,1×B27,1×GlutaMAX,100 U 青/链霉素双抗)。每隔3 d 半量换液。
1.3 Aβ25-35的老化与造模
Aβ 蛋白具有“老化”特性,即在体外能聚集成纤维状寡聚体,从而对神经细胞具有更强的毒性作用。本研究结合相关文献,在PC12 细胞造模前首先对Aβ25-35进行了老化处理[13-14]。方法如下:首先使用0.01 mol/LPBS 将Aβ25-35稀释成1 μg/μL 的溶液,在37 ℃培养箱中孵育7 d,使Aβ25-35聚集以增加其毒性。分装后在4 ℃保存,备用。
小鼠原代神经元培养7 d 时,使用Aβ25-35造模。取 1 支已处理好的Aβ25-35加入培养7d 的原代神经元培养基内,使其终浓度为10 μmol/L。继续孵育24 h 后,即为造模完成。
1.4 大豆肽的处理与实验分组
使用0.01 mol/L PBS 将大豆肽配制成浓度为20 %的储存液,随后加入到已完成造模处理的小鼠原代神经元培养基内,使大豆肽在培养基中的终浓度分别为0.1%、0.5%、1.0%。大豆肽处理48 h 后,终止孵育,将小鼠原代神经元从培养箱中取出,进行各项实验分析。
按照大豆肽在培养基中的浓度不同,将小鼠原代处理的神经元分为对照组与实验组2个组别。对照组为:正常对照组(不加任何处理),DMAO对照组(培养基中加10% DMSO),模型对照组(使用10 μmol/L 的Aβ25-35造模)。在模型对照组的基础上,分别加0.1%、0.5%、1.0%大豆肽处理,即为实验组,分别为 0.1%、0.5%、1.0%大豆肽处理组。
1.5 大豆肽对小鼠海马神经元活力及细胞凋亡的影响
1.5.1 MTT 法比色法 神经元经造模及大豆肽处理48 h 后,利用MTT 法检测各组神经细胞的活力。在神经元培养基中加入 5.0 mg/mL 的MTT,使其终浓度为0.5 mg/mL;4 h 后终止培养,小心吸弃培养基,每孔加入DMSO 150 μL,37 ℃振荡 10 min 混匀,采用酶联免疫检测仪在490 nm 处检测其光吸收值,实验重复3 次。
1.5.2 DAPI 染色法 Aβ 毒性会增加细胞的死亡,为了研究大豆肽对抗Aβ 毒性的作用,利用DAPI 检测各组凋亡的神经细胞。首先使用ddH2O 将DAPI配制成2.5 mg/mL 储存液,再用0.01 mol/L 的PBS将其按照1∶2000 稀释成工作液。在神经元经造模及大豆肽处理48 h 后,吸弃神经元培养基,4% 多聚甲醛4 ℃固定后,加200 μL DAPI 工作液,室温避光孵育5 min。吸弃废液,0.01 mol/L 的PBS洗2 次。抗荧光淬灭封片剂封片,随后在荧光显微镜下观察拍照。
1.5.3 免疫印检测迹 取3 只孕18.5 d 的母鼠按1.2 所述方法培养原代神经元后,接种至10 个6 cm 培养皿中,培养7 d 后进行造模及大豆肽处理。48 h 后,搜集各组细胞,利用RIPA 裂解液提取蛋白。采用Lowry 法测定各组总蛋白,定量后,煮沸变性,并于12% SDS 聚丙稀酰胺凝胶中电泳。随后电转蛋白至NC 膜;5%脱脂奶粉封闭过夜,次日分别加入小鼠抗caspase-3 抗体(1∶1 500)和小鼠抗caspase-9 抗体(1∶1 000)。随后室温孵育 3 h;TBST 缓冲液漂洗后分别加入HRP 标记的羊抗小鼠IgG;室温孵育1 h,TBST 缓冲液漂洗后,使用ECL 化学发光法显示结果,压片曝光。以兔抗β-actin 多克隆抗体为内参照,Image J 软件分析条带灰度值,结果以对照组的百分率表示。
1.6 大豆肽对神经元细胞骨架的影响
神经元经造模及大豆肽处理48 h 后,吸去培养基,经0.01 mol/L 的PBS 漂洗后,4% 多聚甲醛4 ℃固定 15 min。随后利用神经元微管相关蛋白MAP2(1∶500)及微管蛋白β-Ⅲ-tubulin(1∶2 000)特异性抗体进行免疫荧光染色,以观察小鼠原代神经元中细胞骨架的变化情况。方法如下:0.01 mol/L 的PBS 漂洗3 次后,加入兔抗β-Ⅲ-tubulin 多克隆抗体、小鼠抗MAP2 单克隆抗体。并于4 ℃孵育过夜。切片经0.01 mol/L 的PBS漂洗后入Alexa 568 结合的羊抗小鼠IgG 和Alexa 488 结合的羊抗兔IgG;室温下避光孵育3 h,之后 0.01 mol/L 的PBS 漂洗,荧光封片介质封片。在罗达明和FITC 激发光下,用Olympus 荧光显微镜进行观察,拍片。
细胞计数在Image J 1.47V 软件下进行,对以下参数进行测量:① 细胞存活率(%)=(实验组OD570-空白组OD570)/(对照组OD570-空白组OD570)×100%;② 细胞凋亡率(DAPI 染色)=(凋亡细胞数/总细胞数)×细胞数(%);③ 微丝/微管解体率=(发生微丝、微管解体的细胞数/总细胞数)×细胞数(%)。
1.7 统计学处理
所有实验至少重复3 次,结果用±s,采用SPSS 23.0 统计学软件对数据进行分析处理。多组间比较采用单因素方差(One-Way ANOVA)分析,组间两两比较采用LSD-t检验。
2 结果
2.1 大豆肽对神经元损伤模型中细胞活力的影响
利用MTT 法检测各组神经细胞活力,结果显示神经元经Aβ25-35造模处理后,相对于空白对照组与DMSO 对照组,细胞存活率显著降低(P<0.01),仅为55.8%;经0.1%浓度的大豆肽处理后相对于对照组细胞存活率仍然是明显降低(P<0.05),为65.3%;经0.5%浓度的大豆肽处理后,能提高细胞存活率至89.7%;1.0%浓度的大豆肽亦能提高细胞存活率至80%以上,但相较0.5%浓度的大豆肽,量效并无明显提升(图1)。
2.2 大豆肽对神经元损伤模型中细胞凋亡的影响
DAPI 染色可用于细胞凋亡的检测,在荧光显微镜下可以看到细胞核的形态变化。细胞凋亡时,染色质凝集,胞核碎裂,荧光强度显著增强[15]。原代神经元DAPI 染色结果表明,在正常培养组及DMSO 处理组,神经元细胞核圆润无皱缩,仅有少量细胞的核则呈现碎裂和固缩的特征(图2A、B,见封二);Aβ25-35作用24 h 后,细胞凋亡现象明显增加,出现大量明亮固缩的胞核碎片(图2C)。分别利用不同浓度的大豆肽对Aβ25-35所致的细胞损伤模型进行处理,显示0.5% 与1.0%浓度的大豆肽处理后,Aβ25-35所致的细胞凋亡可得到缓解(图2D~F,见封二)。进一步采用免疫印迹检测各组神经细胞凋亡蛋白的表达,结果显示,Aβ25-35作用24 h后,模型组caspase-3、caspase-9蛋白表达量显著高于对照组;0.1% 浓度的大豆肽作用模型组48 h后,caspase-3、caspase-9蛋白表达量与模型组相比差异无统计学意义;0.5%与1.0% 大豆肽作用模型组48 h后,caspase-3、caspase-9蛋白表达量与模型组相比,均明显降低,提示0.5%与1.0% 的大豆肽对Aβ25-35引起的细胞凋亡均具有保护作用;0.5% 与1.0% 大豆肽组之间,凋亡细胞及凋亡蛋白表达量没有明显差别,提示 0.5% 浓度的大豆肽已经可以达到抗凋亡的最佳效果(图3)。

图1 Aβ25-35 和大豆肽对神经元存活率的影响Fig 1 The viability of neurons after Aβ25-35-induced neuronal injury by soybean peptide treatment
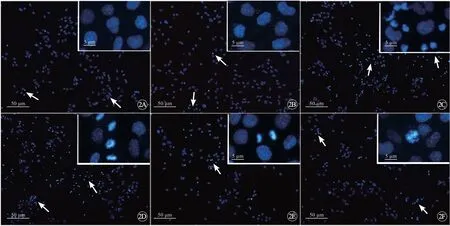
图2 大豆肽对Aβ25-35 所致神经元损伤模型中细胞凋亡的影响。利用DAPI 染色(蓝色)检测细胞核的凋亡。A:正常对照组;B:DMSO 对照组;C:模型组(用10 μmol/L 的Aβ25-35 造模);D:用0.1%大豆肽对模型组处理;E:用0.5%大豆肽对模型组处理;F:用1.0 %大豆肽对模型组处理。箭头和框图内示高倍镜下各组细胞核的聚集与凋亡小体.Fig 2 Effect of SBP on apoptosis in neural damage model by Aβ25-35-induced neurotoxicity.The apoptotic cells were visualized by DAPI staining.A:Normal control;B:DMSO control;C:Model group(using 10 μmol /L Aβ25-35 for modeling);D:Model group treated with 0.1% SBP;E:Model group treated with 0.5% SBP;F:Model group treated with 1.0% SBP.The block diagram showed the nucleus aggregation and apoptotic bodies under high magnification.
2.3 大豆肽对神经元损伤模型中细胞骨架的影响
为了研究大豆肽对Aβ 所致神经细胞损伤的影响作用,利用免疫荧光技术检测各组细胞形态及骨架蛋白特异性标志物的表达变化。结果表明,正常体外培养10 d 的原代神经元,MAP2 阳性的树突分支较多,突起较长(图4A,见封二)。利用10 μmol/L Aβ25-35造模处理,培养至第10 天时,一部分神经元凋亡或死亡,幸存的神经元与DMSO 对照组相比,树突分支少,突起也比较短(图4B,见封二)。
大豆肽对Aβ25-35所致神经元损伤具有改善作用。0.5%与1.0%浓度的大豆肽可以明显提高神经元树突突起的长度(图4C、D,见封二)。高倍镜下观察β-Ⅲ-tubulin 免疫荧光染色,结果可见,DMSO 对照组在培养至10 d 时,神经元各突起分支多且较长,胞体及突起荧光信号较强(图4E,见封二);而Aβ25-35处理后培养至第10 天时,神经元突起分支少,且在胞体及突起周围散布很多点状碎片(图4F,见封二);经0.5%与1.0%浓度的大豆肽处理培养至第10 天时,神经元突起明显变长,点状碎片减少(图4G、H,见封二)。统计分析结果表明,相对于DMSO 对照组,模型组神经元MAP2 阳性的突起长度明显变短(图5A),微管解体率显著增高(P<0.01)(图5B)。0.5% SBP与1.0% SBP 处理后MAP2 阳性的突起长度有所恢复,与DMSO 对照组相比已无统计学意义上的差异(图5A)。神经元微管解体率亦有所改善,与模型组相比,微管解体率明显减少,差异有统计学意义(P<0.05)(图5A、B)。
3 讨论

图4 大豆肽对Aβ25-35 所致神经元损伤模型中细胞骨架的影响。A~D:用MAP2 免疫荧光染色示神经元树突,依次为DMSO 对照组、模型组、0.5%大豆肽处理组、1.0%大豆肽处理组;E~H:利用β-Ⅲ-tubulin 免疫荧光染色示神经元微管蛋白,依次为DMSO 对照组、模型组、0.5%大豆肽处理组、1.0%大豆肽处理组.Fig 4 Effect of SBP on cytoskeleton in Aβ25-35-induced neurotoxicity.A-D:MAP2 immunofluorescence staining showed neuronal dendrites.They were DMSO control group,model group,0.5% SBP treatment group and 1.0% SBP treatment group in this order;E-H:Neuronal tubulin was shown by β-Ⅲ-tubulin immunofluorescence staining in DMSO control group,model group,0.5% SBP treatment group and 1.0% SBP treatment group orderly.
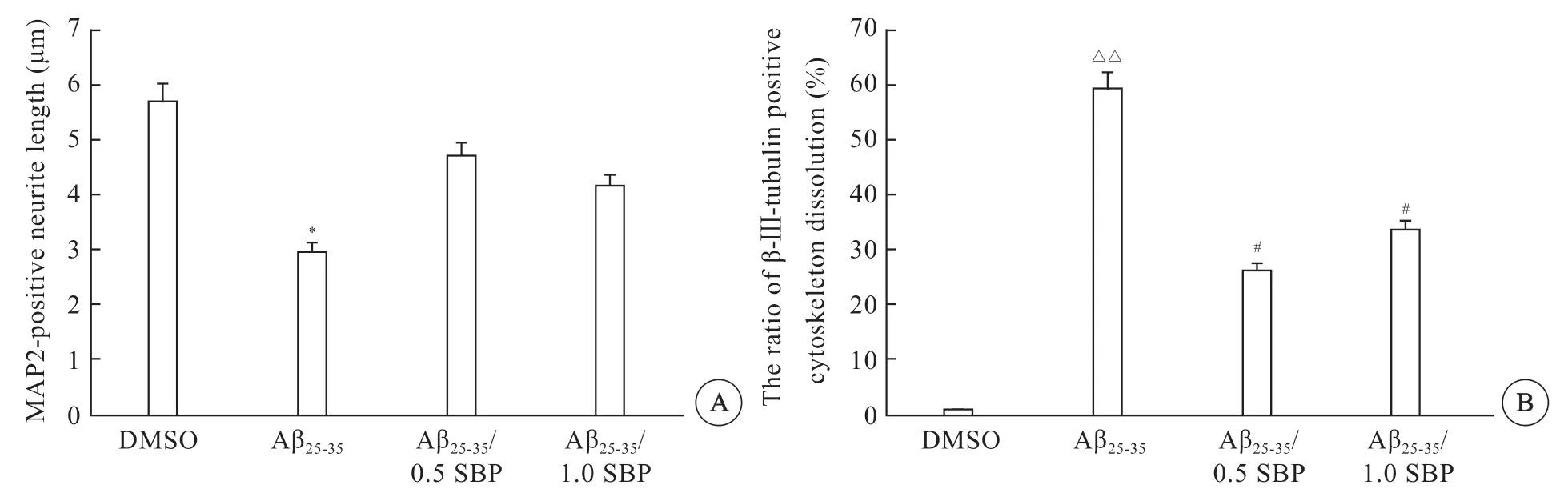
图5 大豆肽改善Aβ25-35 所致神经元内细胞骨架损伤Fig 5 SBP improved cytoskeletal damage in neurons caused by Aβ25-35
Aβ 是由淀粉样前体蛋白(amyloid precursor protein,APP)经β-和γ-分泌酶水解产生。神经系统所有细胞均表达APP 和产生Aβ,但在正常时Aβ 的产生和降解保持平衡,且体内有一些因素可保 持Aβ的可溶性[5]。家族性AD 患者APP基因突变可以导致Aβ 的过量产生与沉积,从而引发Aβ 的神经毒性作用,且这种作用在AD 的病程进展中发挥着主要作用[6]。Aβ25-35为Aβ 位于第25~35 个氨基酸位点的基因片段,是引起神经毒性的主要活性部位。本研究采用Aβ25-35作用于小鼠原代神经元,24 h 即可引起神经细胞的大量凋亡以及细胞骨架的解体及破碎,提示Aβ25-35诱导的海马神经元损伤模型成功建立。随后,本研究采用大豆肽来改善Aβ 所致神经元损伤,结果发现,大豆肽对神经细胞的存活及增殖具有明显的生理效应。大豆肽可以降低神经细胞的凋亡率,引起caspase-3、caspase-9 等凋亡蛋白的表达水平降低,且与DAPI 核染色表现出的凋亡程度基本一致。
大豆肽是一种大豆蛋白水解后产生的小分子肽链,不但具有良好的免疫调节和生物防御作用,还能促进细胞的增殖。研究表明,大豆肽通过促进2型糖尿病大鼠模型中胰岛β细胞的增殖,调节血清胰岛素的分泌水平[16-17];大豆肽还可以刺激免疫细胞分泌免疫活性因子,增强机体免疫效应[18]。在神经细胞保护方面,有关大豆肽的报道尚不多见。Kumrungsee等[18]的研究表明,大豆肽可以维持细胞内Ca2+的稳态,降低线粒体内Ca2+含量,从而减轻细胞内Aβ毒性导致的钙平衡失调。本研究结果显示大豆肽可以降低Aβ25-35诱导的海马神经元损伤模型中神经细胞的凋亡率,提示大豆肽对神经细胞的存活具有明显的生理效应。
为了进一步寻找大豆肽改善神经细胞存活的形态学证据,本研究在高倍镜下观察了大豆肽处理海马神经元损伤前后神经元的细胞骨架情况。神经元的细胞骨架是由蛋白多聚体组成的1个三维空间网架结构,主要有微管、微丝和神经丝3种成分。在神经细胞中,细胞骨架系统的基本功能是维持神经元的特殊形态,参与形成神经元的特定功能区如胞体、树突、轴突及突触,并为神经元的物质转运提供保障。MAP2是一种神经元特异性的细胞骨架蛋白,通常表达在成熟神经元的树突,能够很好的显示神经元树突的生长状态,常作为神经细胞表型的标记物,MAP2蛋白被认为参与微管组装,通过与中间丝和其他微管的交联作用稳定微管生长[19]。β-Ⅲ-tubulin是一种参与神经元细胞类型特异性分化的微管蛋白,是细胞骨架的组成成分,在细胞结构的维护、有丝分裂、减数分裂、细胞内的运输等方面发挥作用,可以很好的展现神经元轴突和轴突末端的细节[20]。目前的研究表明,突触功能障碍是引起AD患者临床症状加重的主要原因[21-22],而细胞骨架蛋白不正常的解离、聚合及异常的修饰是引起突触结构和功能改变的重要原因[23-24]。目前有关大豆肽对抗Aβ毒性的研究还未有报道,本研究结果表明,经0.5%大豆肽或者1.0% 大豆肽作用后,Aβ所致神经元损伤后神经元树突突起的长度明显提高,β-Ⅲ-tubulin、MAP2等微管蛋白及微管相关蛋白表达水平也有所增高。这一结果为大豆肽可以改善Aβ所致神经元损伤提供了形态学证据。
综上所述,Aβ 毒性可引起小鼠原代神经细胞凋亡及神经细胞骨架的改变,而大豆肽对Aβ 诱导的神经细胞凋亡及细胞骨架损伤具有明显的保护和修复作用。由于大豆是我国重要的粮食作物之一,大豆蛋白含量丰富,因此大豆肽来源非常广泛。而作为小分子蛋白质,大豆肽又非常容易被人体吸收。大豆肽对Aβ 诱导神经细胞损伤所起的保护作用提示大豆肽可能对一些神经退行性疾病的预防和恢复有一定疗效,在天然药物及保健食品的开发方面有重要的研究和应用价值。
——水芹主要害虫识别与为害症状

