朝鲜蓟茎叶副产物青贮过程中多酚及其功能活性的研究
戴倩倩 樊雨梅 张晓旭,2 倪元颖 马丽艳*
(1 中国农业大学食品科学与营养工程学院 北京100083
2 天津科技大学食品工程与生物技术学院 天津300457)
朝鲜蓟(Cynara scolymus L.)是菊科菜蓟属多年生草本植物,起源于地中海,具有保肝[1]、抗癌[2]、抗氧化[3]、抗菌[4]等多种生理功能活性,在公元前四世纪就被用作食物和药物[5]。朝鲜蓟可食用部分为其花蕾,仅占植株的15%~20%,80%~85%部分为其茎叶副产物[6]。朝鲜蓟茎叶同样营养丰富,富含多酚、膳食纤维和菊糖,且资源巨大,常作为动物饲料[7],生产膳食纤维和提取多酚等天然抗氧化剂等原料[8-9]。由于其含水量在83.1%~90.1%[10],极易腐败,造成环境污染,因此急需解决贮藏问题。虽然热风干燥、冷藏等常规贮藏方式能够满足朝鲜蓟茎叶加工的需要,但是综合考虑经济可行性后认为这些方法不适用于大量朝鲜蓟废弃物。
青贮是在厌氧条件下,通过附生于植物体的乳酸菌厌氧发酵产生有机酸(主要是乳酸),导致pH值降低,从而抑制各种腐败微生物繁殖,达到保存青绿植物原料的储藏方式[11],常用于玉米秸秆、苜蓿等反刍动物饲料的青绿保存[12-13]。目前,对朝鲜蓟副产物青贮贮藏及其功能性影响的研究甚少,仅Meneses等[7,14]研究了朝鲜蓟副产物青贮50 d后的营养品质和感官特性。
因不良生活习惯和饮食结构而导致Ⅱ型糖尿病等流行病的大量出现。目前全国约有3.82亿的糖尿病患者,其中约90%患者属于Ⅱ型糖尿病,Ⅱ型糖尿病患者的胰岛素分泌缺陷、胰岛素敏感性下降,使得患者血糖上升[15]。α-葡萄糖苷酶是血糖产生的关键因素,通过抑制α-葡萄糖苷酶的活性来抑制血糖是治疗糖尿病患者主要手段[16]。
本研究通过青贮处理朝鲜蓟茎叶副产物,探究青贮期间其营养成分、多酚的变化,并以抗氧化活性和对α-葡萄糖苷酶活性的抑制作用来评价青贮对朝鲜蓟茎叶副产物功能活性的影响。
1 材料与方法
1.1 材料与试剂
朝鲜蓟(Cynara scolymus L.)的茎叶等副产物于2015年6月份采自于湖南省常德市西洞庭管理区(东经111°69′,北纬29°05′),采收后立即送往实验室。
二苯基苦基苯肼(DPPH)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、三吡啶三嗪(TPTZ)、三羟甲基氨基甲烷(Tris)、奎诺二甲基丙烯酸酯(Trolox)、乳酸、没食子酸,购自北京百灵威科技有限公司;α-葡糖苷酶、绿原酸、洋蓟素、芦丁、槲皮黄酮-3-O-葡糖苷酸、槲皮黄酮-3-O-葡萄糖苷、槲皮黄酮-3-O-半乳糖苷、山奈酚-3-O-葡萄糖苷、槲皮黄酮、山奈素、山奈酚、木犀草素等标准样品,购自美国Sigma公司。
1.2 仪器与设备
Agilent 1200型液相色谱,美国Agilent公司;Agilent 6460型三重四级杆质谱,美国Agilent公司;Multiskan MK3型酶标仪,美国Thermo公司;T6型紫外分光光度计,北京普析通用有限公司;KDY-9820凯氏定氮仪,北京市通润源机电技术有限责任公司;GL-20G-II型高速冷冻离心机,上海安亭科学仪器厂;KSW-6-12型马弗炉,北京科伟永兴仪器公司;LGJ-12型冷冻干燥机,北京益德益华科技发展有限公司。
1.3 方法
1.3.1 朝鲜蓟茎叶副产物青贮处理 将朝鲜蓟茎叶切割成长约3~5 cm的小段,充分混合后,将小段植株装于纯尼龙复合PE材料包装袋(28 cm×19 cm)中,真空密封包装,(20±2)℃环境中贮存。分别在青贮0,10,20,30,50,70,90,120,150,180 d取样,每次随机抽取2袋,进行冷冻干燥。随后,粉碎冻干样,过20目筛,装于密封袋中,避光贮存于干燥器中。
1.3.2 朝鲜蓟茎叶副产物粗多酚提取 参照abu-reidah等[17]、Pandino等[18]方法。分别取朝鲜蓟副产物青贮后冻干的样品3 g,加30mL 70%甲醇,室温震荡提取1 h,冷冻离心15 min(4℃,3 800 r/min),取上清液。向沉淀中加入7.5mL 70%甲醇,重复上述提取操作,合并两次上清液。40℃旋蒸除去甲醇,粗提物用冻干机冷冻干燥并称重。随后,加蒸馏水复溶,定容50mL得朝鲜蓟副产物粗提液。以60℃热风干燥朝鲜蓟茎叶副产物样品为对照。整个过程避光。
1.3.3 基本理化指标的测定 根据AOAC的方法测定青贮期间的干物质、总糖、灰分、粗脂肪、粗蛋白、粗纤维[19]。
1.3.4 青贮期间乳酸的测定 参考Jin等[20]的方法。按四分法取朝鲜蓟副产物粉末400mg,加入20mL纯净水,超声30min,4 000 r/min离心10 min,取上清液过0.22μm水系滤膜,进行HPLC分析。色谱柱:TechMate C18-ST(4.6mm×250 mm,5μm);流动相:磷酸氢二铵缓冲液;等梯度洗脱,流速1.0mL/min;进样量10μL;检测波长210 nm。重复3次,外标法定量。
1.3.5 总酚和单体酚含量及种类的测定 参考Yang等[21]的方法,利用福林酚法测定总酚含量,结果以没食子酸含量mg GAE/g DM表示。
参考Jin等[22]方法,采用HPLC-QQQ-MS检测单体酚,具体操作:取青贮和烘干后的粉末各1 g,加入25mL 90%甲醇,充入氮气保护,室温提取1 h,提取液于40℃下旋蒸至干,加入5mL 90%甲醇复溶,过0.22μm尼龙滤膜,待分析。
色谱条件:色谱柱为Poroshell 120 EC-C18柱(3.0mm×50mm,2.7μm,美国Agilent公司),柱温为25℃;流动相为0.1%的甲酸水溶液(A相)和乙腈(B相)。梯度洗脱条件:0~1min,5%B;1~3 min,5%~15%B;3~15min,15%~20%B。流速为0.3mL/min,进样量2μL。
质谱采用ESI源,负离子模式,干燥气温度330℃,流速10 L/min,雾化气压35 psi,鞘气温度350℃,流速10 L/min,毛细血管电压3 500 V,喷嘴电压500 V。
1.3.6 抗氧化活性的测定 以DPPH[22]、ABTS[22]、FRAP[21]、Fe2+螯合[23]试验作为抗氧化活性测定指标。
1.3.7 AG活性抑制 参考Jin等[21]的方法。取50μL朝鲜蓟多酚提取液(0~0.6mg/mL)于96孔板中,加入100μLα-葡萄糖苷酶溶液(1.0U/mL,溶解于pH 6.9的1mol/L磷酸缓冲液),25℃孵 育10 min(100 r/min,10 min),加 入50μL PNPG溶液(5mmol/L,溶解于pH 6.9的0.1mol/L磷酸缓冲液),25℃孵育5min。在405 nm处测定吸光度。朝鲜蓟多酚提取液对α-葡萄糖苷酶的抑制率(AG抑制率)的计算公式如下:

1.4 数据统计
所有样品平行测定3次,数据以平均值±标准差(Mean±SD)表示。采用Duncan’s test对数据进行显著性分析,P<0.05水平下进行方差分析(Analysis of Variance,ANOVA)。数据统计分析软件为SPSS(Version 21.0,美国芝加哥)。
2 结果与分析
2.1 青贮期间朝鲜蓟副产物中基本理化指标的变化
从图1可以看出,在青贮前期(30 d内),除灰分指标外,其它理化指标变化较大,干物质含量持续下降,结合乳酸含量的变化(图2)说明在此期间乳酸菌大量繁殖产酸,消耗了总糖,带动了粗蛋白、粗脂肪的积累。上述营养物质含量在青贮90 d后保持稳定,青贮进入稳定期。纵观青贮过程,180 d后,干物质、粗蛋白、粗脂肪、灰分的含量与青贮前无显著差异,粗纤维含量显著上升(P<0.05),而总糖含量显著下降(P<0.05)。
青贮过程中乳酸的积累至关重要,伴随着乳酸菌发酵,乳酸含量在30 d内持续增加(0.19%~1.97%),随后其含量基本保持稳定(图2),说明乳酸菌厌氧发酵产生乳酸主要发生在青贮前期[7,14]。
2.2 青贮期间朝鲜蓟副产物中总酚含量的变化
朝鲜蓟副产物多酚含量在青贮90 d内波动较大(图3),第30天达到高峰(P<0.05),这与乳酸菌大量繁殖、代谢活跃有关,后者产生乳酸、降低pH值的同时,释放糖苷酶等水解酶,具有促进结合态多酚释放的作用[24]。随后总酚含量有所下降,这与朝鲜蓟中多酚氧化酶的作用有关[25]。青贮后期,总酚含量保持稳定。在180d青贮结束后,其总酚的保留率为96.2%。
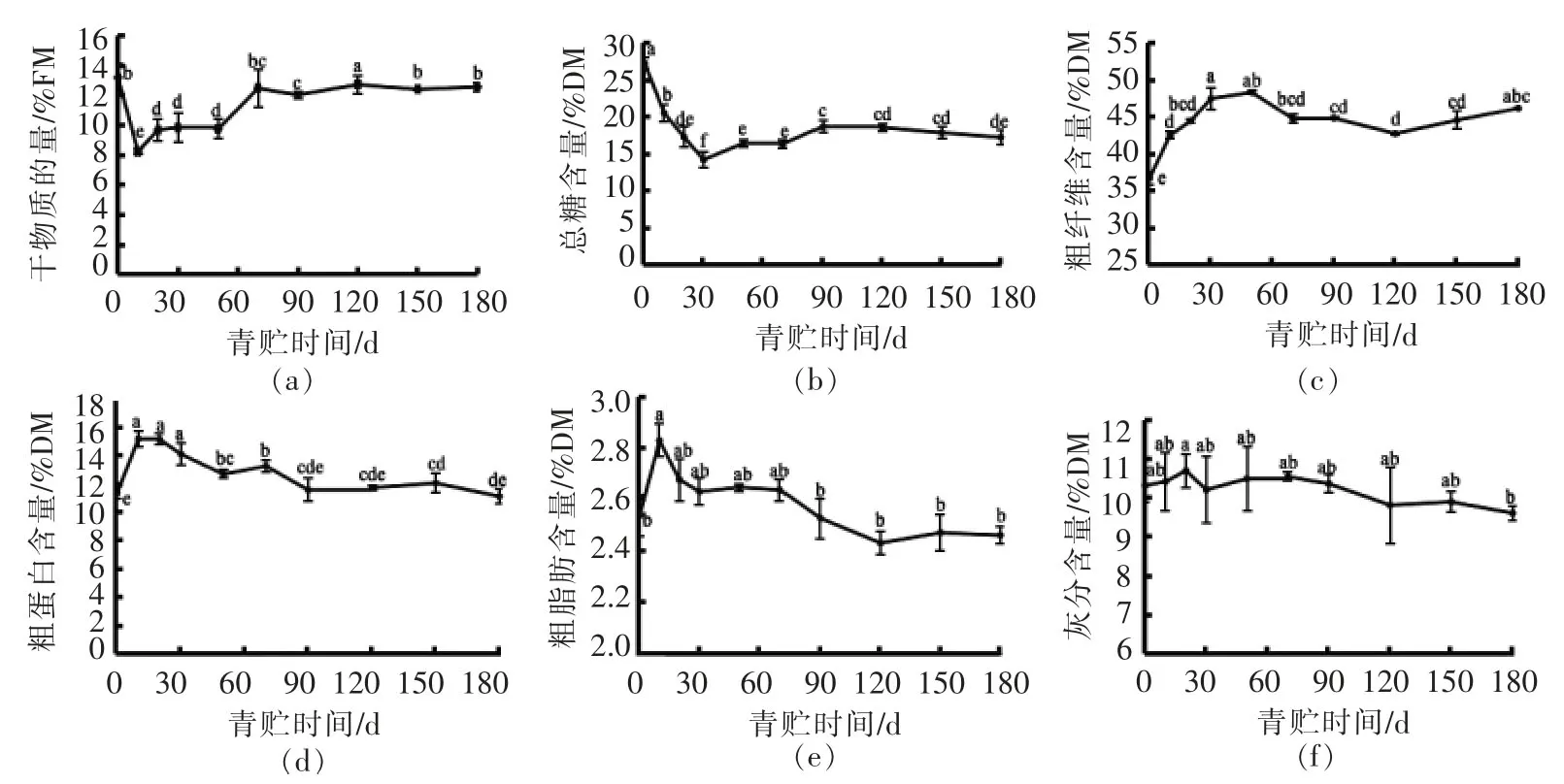
图1 朝鲜蓟副产物青贮过程中营养成分的变化(平均值±标准差,平行次数=3)Fig.1 Nutritional components content changes of artichoke by-product ensilage(Mean±SD,n=3)
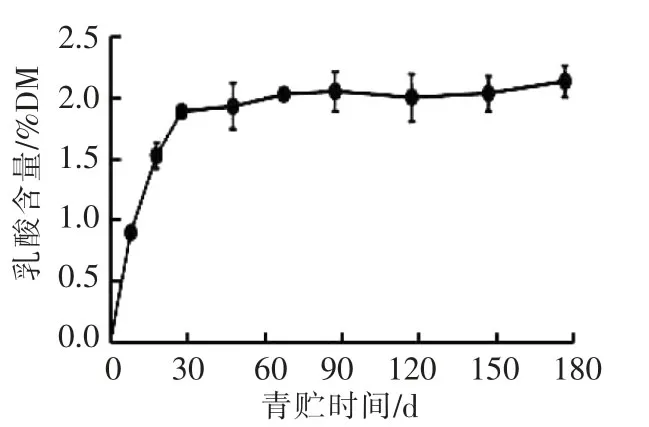
图2 青贮期间乳酸含量的变化(平均值±标准差,平行次数=3)Fig.2 Changes of lactic acid content during silage(Mean±SD,n=3)
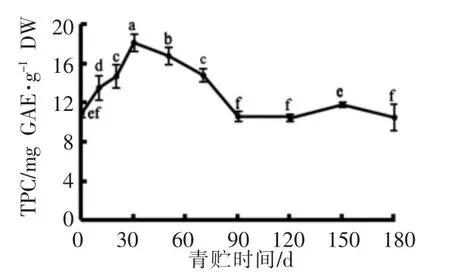
图3 朝鲜蓟副产物青贮过程中总酚含量的变化(平均值±标准差)Fig.3 The changes of TPC in artichoke by-product for whole ensiling days(Mean±SD)
2.3 青贮前、后朝鲜蓟副产物中单体酚的检测
有研究表明,朝鲜蓟的花蕾(可食部分)和叶中含有丰富的酚类物质,以酚酸类中咖啡酰奎宁酸衍生物为主,如绿原酸(5-O-咖啡酰奎宁酸),还包括一些类黄酮,如芹黄素和木犀草素糖苷等[1,26]。本文采用青贮方法实现朝鲜蓟副产物的低能耗保存,并在青贮180 d后对朝鲜蓟茎叶副产物中最主要的单体酚(共20种)进行分析(表1)。以热风干燥处理的样品为对照,青贮后在朝鲜蓟副产物中共检测到11种咖啡酰奎宁酸同分异构体和7种黄酮类多酚,而在对照样品中仅检测到12种单体酚,包括7种咖啡酰奎宁酸同分异构体和5种黄酮。从多酚组成与总量可以看出,与热风干燥工艺相比,青贮保藏对多酚更有利。在检测到的20种多酚组分中,热风干燥样品中单咖啡酰奎宁酸类多酚的损失最大,仅检测到绿原酸。青贮后的副产物中咖啡酰奎宁酸含量远高于烘干处理,由于咖啡酰奎宁酸具有很强的抗氧化性[27],因此青贮方式对活性成分的保存优势凸显。此外,对比青贮和烘干后的朝鲜蓟副产物中的黄酮类多酚发现,青贮样品中芦丁和山奈酚-3-O-葡萄糖苷含量非常高,烘干样品中只有少量的芦丁而不见山奈酚-3-O-葡萄糖苷。芦丁是预防和治疗血栓综合症的功能成分[28]。山奈酚-3-O-葡萄糖苷具有抗氧化、抗炎、抗肿瘤的活性[29]。由此可见,青贮是保留朝鲜蓟副产物中多酚类物质的有效方法。

表1 青贮后朝鲜蓟副产物中单体酚含量(平均值±标准差,平行次数=3)Table1 The content of the phenol from artichoke by-product after the ensilage(Mean±SD,n=3)
2.4 青贮对朝鲜蓟茎叶副产物抗氧化活性的影响
朝鲜蓟茎叶副产物中含有丰富的咖啡酰奎宁酸和黄酮类活性物质,它们都具有很强的抗氧化活性[3]。本研究对青贮朝鲜蓟茎叶副产物的抗氧化活性的保存能力进行评价,结果表明,青贮180 d后,朝鲜蓟茎叶副产物仍能保持较好的ABTS自由基清除能力、铁还原力和Fe2+螯合能力,DPPH活性略低于青贮前(P<0.05)。值得关注的是,本研究中的朝鲜蓟副产物表现出较强的铁还原能力,青贮前、后其IC50值约为0.70μmol Fe2+/mg DM,远高于Kukic等[4]所报道的刺菜蓟(Cynara cardunculus)的外苞片提取物的FRAP值,后者仅为0.12~0.38μmol Fe2+/mg DM。结论:朝鲜蓟副产物具有较强的抗氧化活性,且青贮有利于保持这种活性。
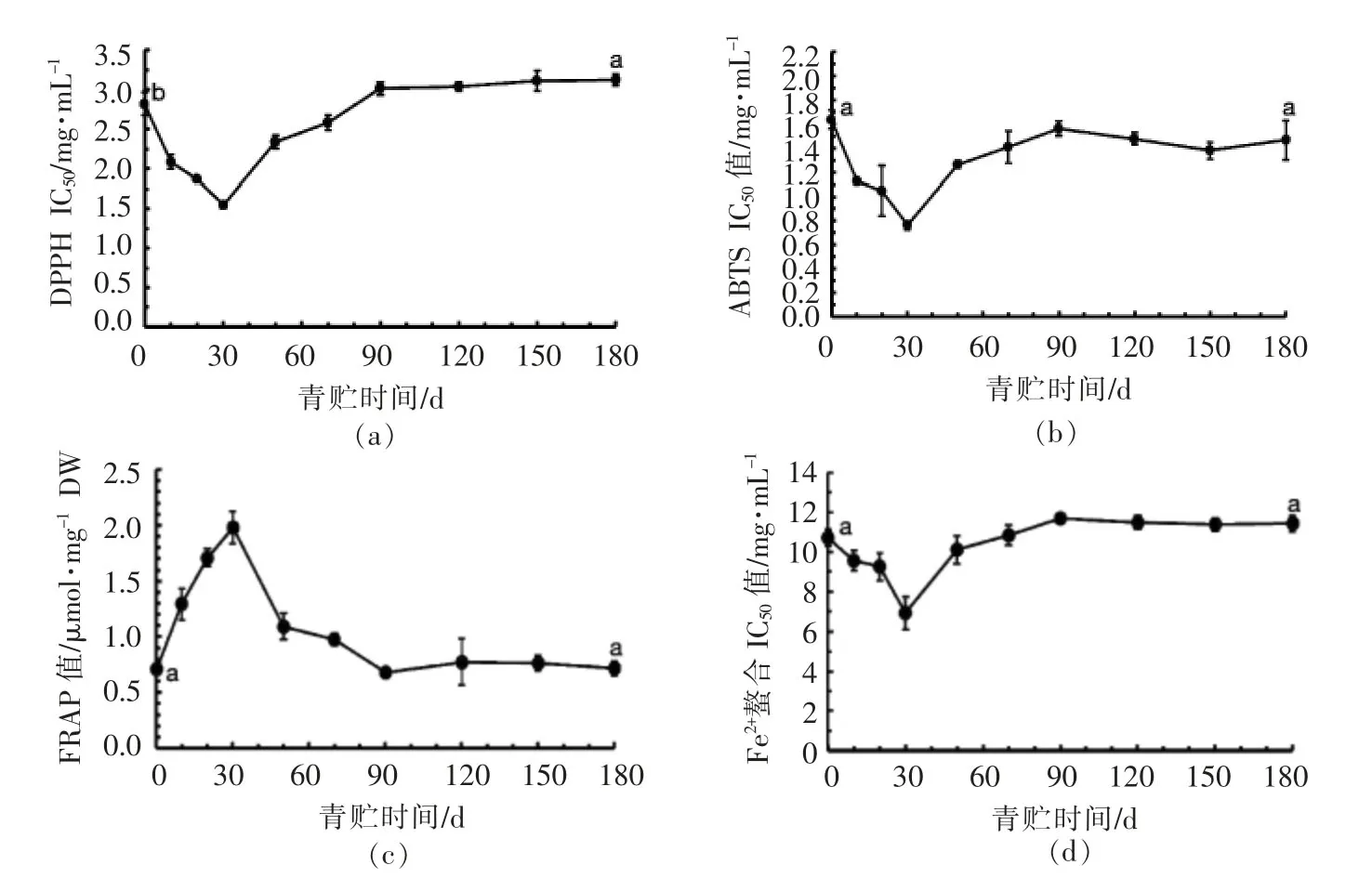
图4 青贮期间朝鲜蓟副产物的抗氧化活性(平均值±标准差,平行次数=3)Fig.4 Antioxidant activity of artichoke by-product in ensiling days(Mean±SD,n=3)
2.5 青贮对朝鲜蓟副产物功能活性的影响
丰富的饮食使得器官对氧化损伤的敏感性增加,即餐后氧化应激,它与糖尿病、肥胖、动脉粥样硬化等高风险的慢性代谢疾病息息相关,而餐后氧化应激直接与餐后血糖增加成正比[30]。控制餐后高血糖和氧化应激是控制糖尿病的实用治疗方法。α-葡萄糖苷酶是高血糖形成的关键因子,可通过抑制α-葡萄糖苷酶的活性来控制餐后高血糖和氧化应激[31]。许多研究证明植物提取物如茶多酚等次生代谢产物可降低氧化水平,抑制α-葡萄糖苷酶的活性。本试验发现,青贮朝鲜蓟茎叶副产物抑制α-葡萄糖苷酶活性的IC50为(0.18±0.06)mg/mL(图5)。相比其它植物而言,Adefegha等[32]发现刺果番荔枝果实和种子提取物的α-葡萄糖苷酶抑制活性的IC50值分别为0.37mg/mL和0.37 mg/mL。Ademiluyi等[33]发现大豆单体酚和结合酚对α-葡萄糖苷酶的抑制活性IC50分别为0.37mg/mL和0.46mg/mL。本研究中的朝鲜蓟茎叶副产物对α-葡萄糖苷酶活性的抑制作用具有显著的优势。此外,由表2可见,青贮副产物对α-葡萄糖苷酶活性的抑制作用与原料相比并未明显改变(图5)。而热风干燥贮藏后,原料中的单体酚损失极大(表1),降低了其抑制α-葡萄糖苷酶活性的能力(P<0.05),说明青贮可较好地保持朝鲜蓟副产物抑制α-葡萄糖苷酶的活性。
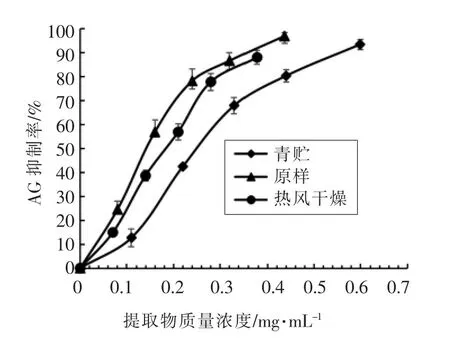
图5 朝鲜蓟茎叶副产物提取物对α-葡萄糖苷酶活性的抑制作用(平均值±标准差,n=3)Fig.5 Inhibition of artichoke by-product on α-glycosidase activity(Mean±SD,n=3)
3 结论
本研究探究了朝鲜蓟副产物青贮过程中的营养成分、总酚及其单体酚种类和含量的变化,评价了青贮前、后抗氧化、抑制α-葡萄糖苷酶活性的变化,结果表明,青贮对营养成分及多酚有较好的保留作用,相比于原样,总酚的保留率达96.2%。未处理的朝鲜蓟副产物具有很强的抗氧化能力,青贮120 d后,其ABTS自由基清除能力、铁还原能力和Fe2+螯合能力未见无明显损失,而DPPH自由基清除能力略微下降。研究表明,无论青贮前、后,朝鲜蓟副产物都可有效抑制α-葡萄糖苷酶的活性,说明青贮120 d能保持朝鲜蓟副产物的酶抑制活性。综上所述,朝鲜蓟副产物中的多酚及其抗氧化和抑制α-葡萄糖苷酶的活性在青贮后被高效保存,用青贮方式可长期贮藏。

