青梅组分抗食源性致病菌活性分析
宋 爽 王兴娜 高志红*
(1 南京农业大学园艺学院 南京210095
2 江苏省农业科学院农产品加工研究所 南京210014)
青梅(Prunusmume Sieb.Et Zucc)为蔷薇科植物。我国是青梅的原产地,也是世界上适合生长青梅地域最广的国家[1]。青梅果具有很高营养价值,可以制成咸水梅、梅胚、果酱、果醋、果酒等产品[2-5]。青梅果还具有很高的药用价值。据报道,青梅具有抑菌[6]、抗肿瘤、驱虫、解毒、抗氧化[7-8]、抗骨质疏松[8]、抑制黑色素生成[9]、抗疲劳、抗过敏等生理作用。在我国传统医药中,青梅的炮制品乌梅被国家卫生部正式列为药、食两用制品[10]。
由于青梅酸度很高,所以不能用于鲜食,限制了青梅产业的发展。为促进青梅加工业的发展,必须研究其活性部位和成分,以便于深加工。目前有大量研究表明,青梅炮制品乌梅具有很好的抗菌活性,能够抑制30多种细菌,其中包括金黄色葡萄球菌、大肠杆菌、假单胞菌、荧光假单胞菌、李斯特菌、沙门氏菌、变形杆菌、蜡样芽胞杆菌等食源性致病菌[11-16]。此外,青梅果汁对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌[17]、副溶血性弧菌[18]、鼠伤寒沙门杆菌[19]也有显著的抑制作用。目前深入研究青梅的抗菌活性部位、组分、成分的文章较少。本文对青梅的抗菌活性组分和成分进行了初步研究。
1 材料与方法
1.1 材料与试剂
青梅新鲜果实,采自国家果梅种质资源圃(南京),品种为大叶青;供试菌种为甘油冷冻保存的肠沙门氏菌(Salmonella enterica,简写S.enterica)、单增李斯特菌(Listeria monocytogenes,简写L.monocytogenes)、金黄色葡萄球菌(Staphylococcus aureus,简写S.aureus)、枯草芽孢杆菌(Bacillus subtilis,简写B.subtilis)、大肠杆菌(Escherichia coli,简写E.coli),中国工业微生物菌种保存管理中心。营养肉汤(Nutrient Broth,NB)、琼脂粉,北京奥博星生物技术有限责任公司。二甲亚砜、氯仿、乙酸乙酯、正丁醇均为国产分析纯级,中国国药集团化学试剂有限公司;甲醇、醋酸为色谱纯级,美国sigma公司。
1.2 设备与仪器
立式压力蒸汽灭菌锅(LDZX-50KBS),上海申安医疗器械厂;数显电热培养箱(HPX-9162MBE),上海博讯实业有限公司医疗设备厂;桌上式洁净工作台(HD-650型),苏州净化设备有限公司;高效液相色谱及质谱联用仪(Agilent1100 LC/MSD VL),美国安捷伦公司;电子天平,梅特勒-托利多仪器(上海)有限公司;pH计,上海康仪仪器有限公司;8道移液枪,宁波群安实业有限公司。
1.3 试验方法
1.3.1 青梅不同组分的制备 将新鲜青梅果实于75%乙醇中浸泡一段时间,将浸出液浓缩后加蒸馏水充分混匀,依次用氯仿、乙酸乙酯、正丁醇分别萃取3次,分别得氯仿(组分1)、乙酸乙酯(组分2)、正丁醇(组分3)、水液(组分4)及原液(组分5)5个组分。取青梅组分1,2,3,4,5各0.5 g,溶于4.5mL的85%二甲亚砜溶液,即样品1~5质量浓度为111.1 g/L的溶液。
1.3.2 菌悬液的制备 取以甘油冷冻保存的肠沙门氏菌肠亚种、单增李斯特菌、金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌的菌种保藏液各100μL于50 mL灭菌后的NB液体培养基中活化,于37℃下培养24 h,得菌悬液,备用。使用时将其稀释到106~107。
1.3.3 打孔法测定抑菌圈 取备用的NB固体培养基融化后倒入一次性培养皿中,待冷却凝固后,每皿各取备用的菌悬液50μL,以灭菌后的涂布棒均匀涂布,用经灭菌的打孔器在培养基上打孔,直径为6mm。将其中的琼脂块取出,每个孔在酒精灯火焰下烤10 s,封底。此过程时间不能过长,以免过热融化培养基而产生过多冷凝水。之后,在每孔内注入待检组分溶液100μL,同时每皿设置一个溶剂对照,即85%二甲亚砜溶液,每处理重复3次,放入恒温培养箱中,于37℃下培养24 h,拍照,以直尺测量抑菌圈直径,采用十字交叉法测量,同一抑菌圈取横、竖两个值的均值记录为数据。
1.3.4 二倍梯度稀释法测定最小抑菌浓度 将96孔板孔中分别加入肠沙门氏菌肠亚种、单增李斯特菌、大肠杆菌、枯草芽孢杆菌及金黄色葡萄球菌菌悬液各100μL,第1行加样液各100μL,用85%二甲亚砜溶液作为对照,每个处理重复3次。用移液枪吹打混匀第1行的样液与菌液,吸取100μL,加入第2行中吹打混匀,再吸取100μL加入第3行。以此类推,当第8行吹打混匀后,吸取100μL弃去。至此,可形成8个梯度的样液浓度。将96孔板置于恒温培养箱中,于37℃下培养24 h后,观察每个孔中是否产生浑浊,记录。以肉眼观察没有浑浊的最高稀释倍数所对应的样液浓度值为该样品对于该菌种的最小抑菌浓度。
1.3.5 LC-MS分析 将青梅组分1~5进行LCMS分析,用1%醋酸-甲醇溶液(D)梯度洗脱,洗脱程序见表1。色谱柱:安捷伦Eclipse XDB-C18柱(4.6mm×250mm,5μm),流速0.6mL/min,控制柱温35℃,采用DAD检测器。质谱条件:电喷雾离子源(ESI),控制雾化气(N2)气压为206 850 Pa;干燥气(N2)流量为9 L/min;毛细管温度350℃,毛细管电压3.0 kV,采用负离子模式检测,质谱测定范围m/z 100~1 000。

表1 LC-MS分析梯度洗脱溶剂变化Table1 Changes of solvents in gradient elution by LC-MS
2 结果与分析
2.1 青梅不同极性组分抑菌活性
根据表2不同组分对同一种菌抑菌活性方差分析,组分1~5对大肠杆菌的抑菌活性,从高到低为组分2>组分4、5>组分1>组分3>对照;对枯草芽孢杆菌的抑菌活性,从高到低为组分2>组分1、3、5>组分4>对照;对金黄色葡萄球菌的抑菌活性,从高到低为组分2、5>组分4>组分1>组分3>对照;对肠沙门氏菌肠亚种抑菌活性,从高到低为组分1、组分2>组分3>组分5>组分4>对照;对单增李斯特菌抑菌活性,从高到低为组分2>组分1、3>组分5>组分4>对照。
根据表3同一种处理对不同菌抑菌活性的方差分析,组分1对大肠杆菌等5种细菌的抑菌活性从高到底为:大肠杆菌、肠沙门氏菌>金黄色葡萄球菌>单增李斯特菌>枯草芽孢杆菌;组分2对大肠杆菌等5种细菌的抑菌活性从高到底为:大肠杆菌>肠沙门氏菌>单增李斯特菌>金黄色葡萄球菌>枯草芽孢杆菌;组分3对大肠杆菌等5种细菌的抑菌活性从高到底为大肠杆菌、肠沙门氏菌、单增李斯特菌>金黄色葡萄球菌>枯草芽孢杆菌;组分4对大肠杆菌等5种细菌的抑菌活性从高到底为大肠杆菌>金黄色葡萄球菌>枯草芽孢杆菌>肠沙门氏菌、单增李斯特菌;组分5对大肠杆菌等5种细菌的抑菌活性从高到底为大肠杆菌>金黄色葡萄球菌>单增李斯特菌>肠沙门氏菌>枯草芽孢杆菌。
由以上数据可见,组分2对5种食源性致病菌的抑制效果最好。
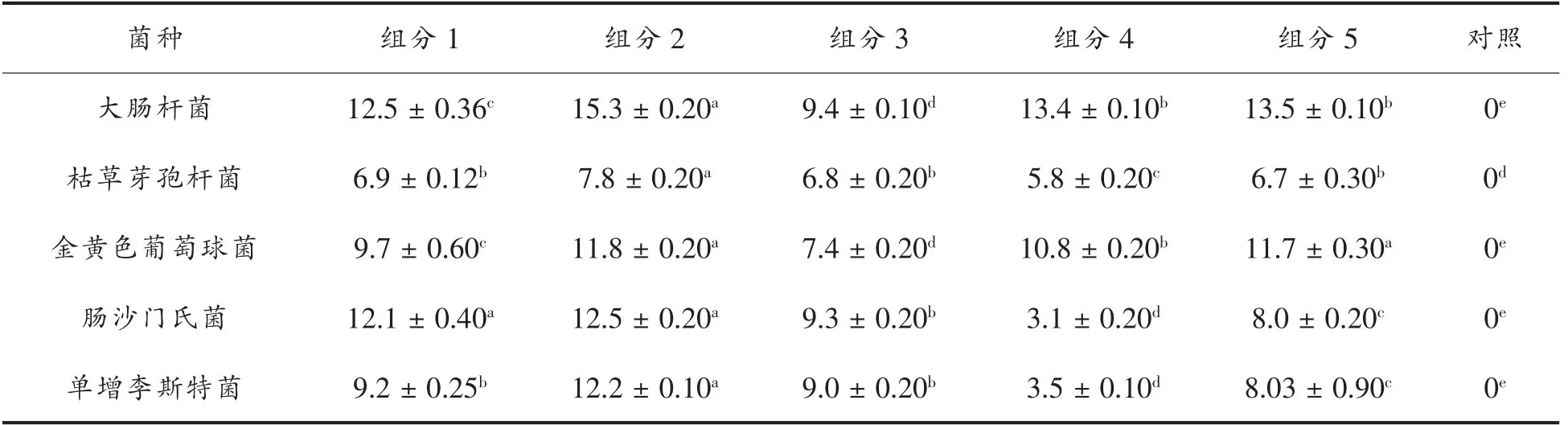
表2 不同组分对同一种菌抑菌圈直径方差分析(单位:mm)Table2 Inhibitory zone diameters'SPSS analysis of various extracts against one bacteria(unit:mm)
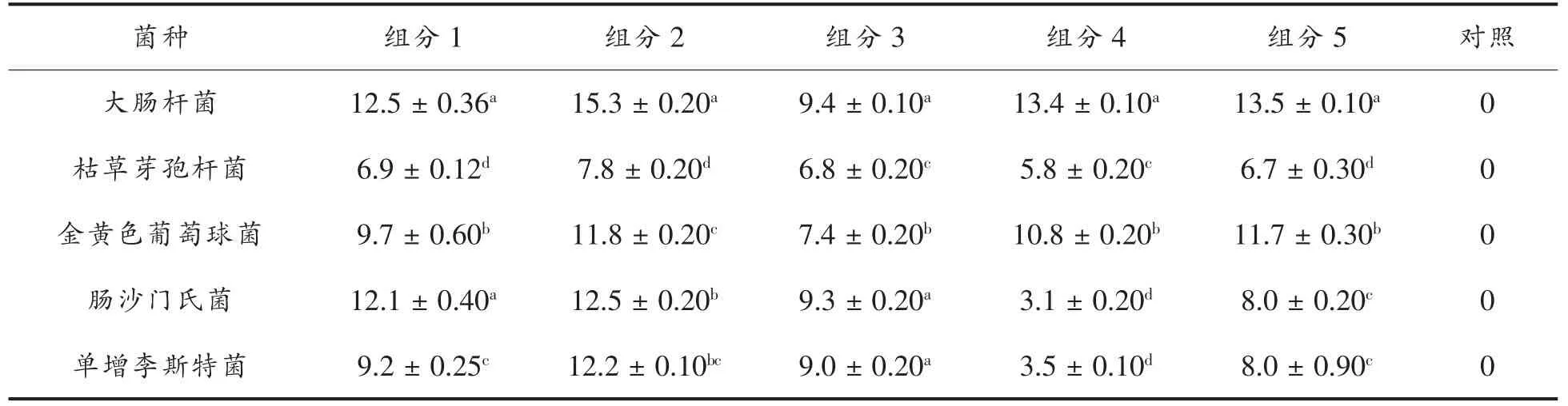
表3 同一组分对不同细菌抑菌圈直径方差分析(单位:mm)Table3 Inhibitory zone diameters’SPSS analysis of one extract against various bacteria(unit:mm)
2.2 最小抑菌浓度
由最小抑菌浓度测定结果可知,组分2对大肠杆菌、枯草芽胞杆菌、金黄色葡萄球菌、李斯特菌、沙门氏菌的抑制效果最好。组分3对沙门氏菌的抑制效果最好,组分2次之。
总体而言,组分2对5种菌的抑制效果最好。
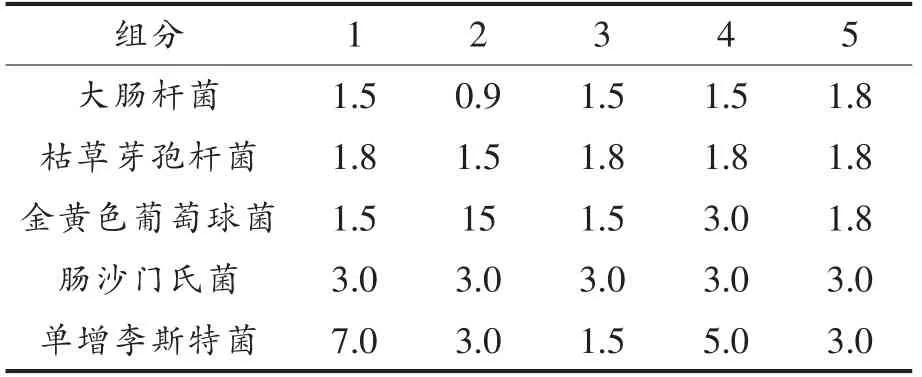
表4 青梅组分1~5的最小抑菌浓度(g·L-1 )Table4 Minimal inhibitory concentrations of components 1-5(g·L-1 )
2.3 乙酸乙酯组分LC-MS分析
对乙酸乙酯(组分2)进行分析发现,在波长320 nm处共有12个主要峰。质谱结果:组分2中互为同分异构体的成分多,其中相对分子质量为354的有3个峰,相对分子质量为368的有4个峰,相对分子质量为336的有3个峰。参考已分离得到的化合物,推测峰1~12分别为表5所示化合物。
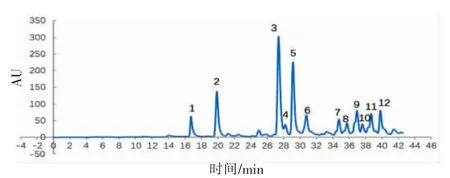
图1 波长320nm处青梅乙酸乙酯组分的液相图谱Fig.1 HPLC spectra of ethyl acetate component at320nm
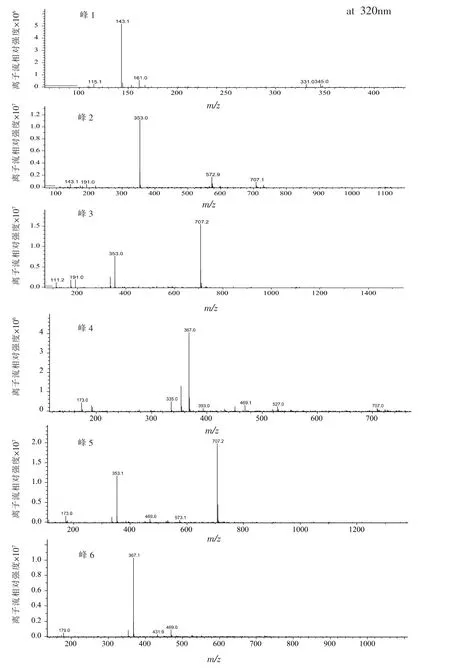
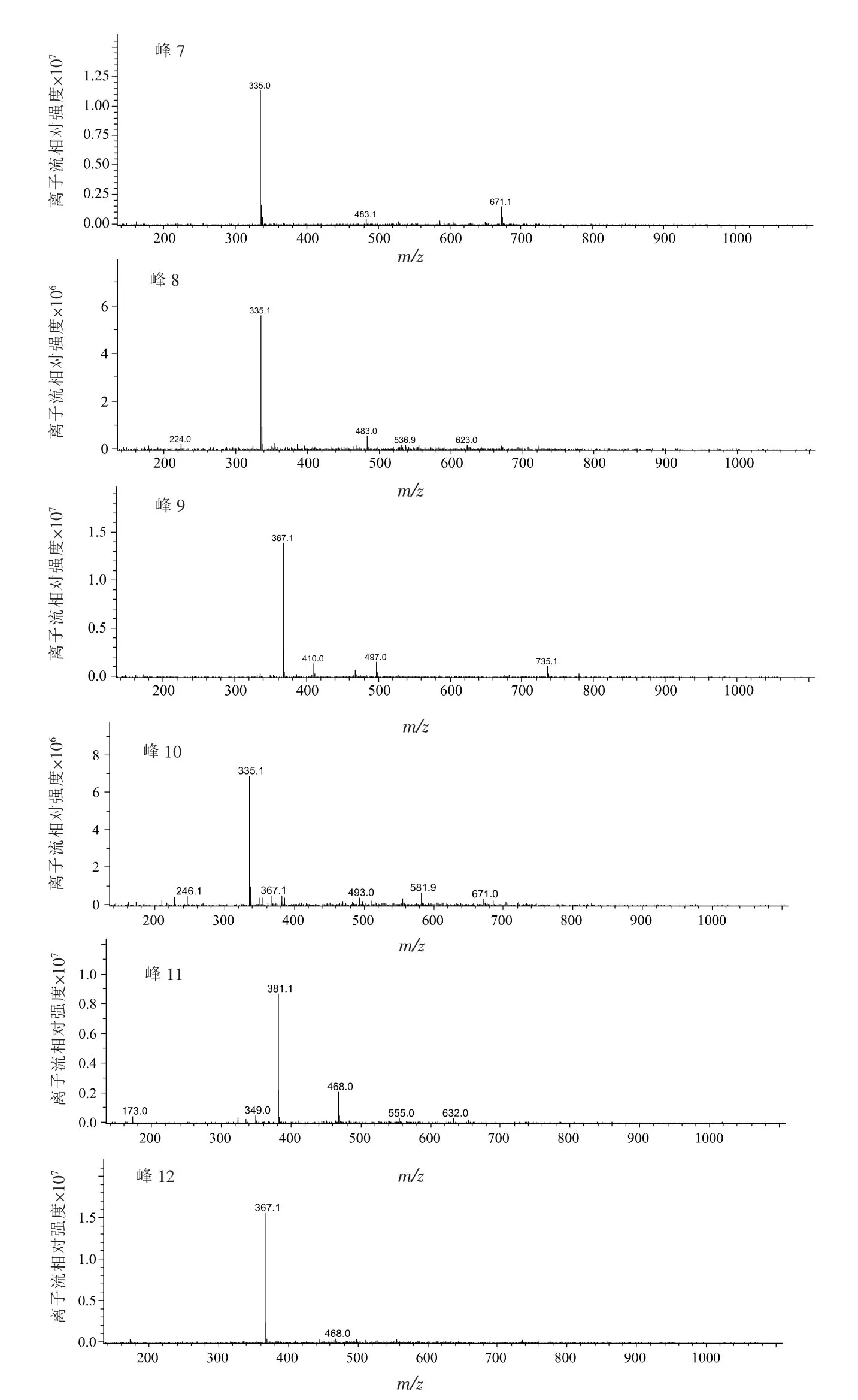
图2 峰1~12质谱图Fig.2 MS spectra of Peak 1-12
液-质谱联用测定结果表明,乙酸乙酯萃取相中的化合物大多是咖啡酰莽草酸及其衍生物,相对分子质量分别为336,354,368,382,相对分子质量之间相差14,18,都是由阿魏酸/咖啡酸与奎尼酸/莽草酸(见图3)酰基化形成,是植物体在有氧呼吸过程中经莽草酸途径产生的一类苯丙素类化合物。分子质量之间的差异是由于阿魏酸/咖啡酸之间相差14,奎尼酸/莽草酸之间相差18引起的。

表5 青梅乙酸乙酯萃取物中的化合物Table5 Compounds in ethyl acetate extractant of Prunus mume
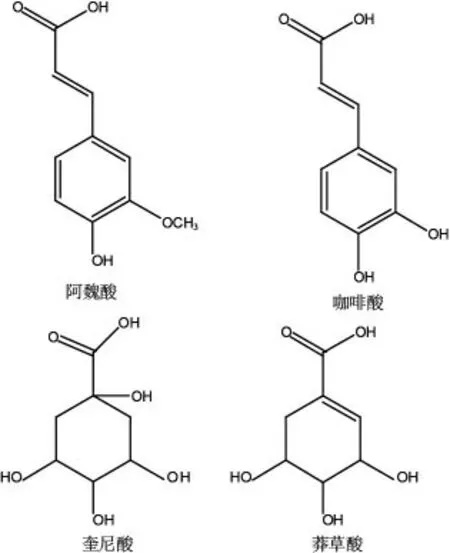
图3 阿魏酸、咖啡酸、奎尼酸、莽草酸结构图Fig.3 Structures of ferulic acid,caffeic acid,quinic acid and shikimic acid
Zhang等[21]从青梅中分离得到一个相对分子质量为336的化合物,即3-O-咖啡酰莽草酸,而在液-质谱联用图谱上显示相对分子质量为336的化合物有3个。这是因为咖啡酰莽草酸化合物中咖啡酸的3个羟基都易与莽草酸形成酯键,而且3个同分异构体(峰7,8,10)极性相似,所以推测另两个相对分子质量为336的化合物为4-O-咖啡酰莽草酸和5-O-咖啡酰莽草酸。
Xia[6]和Shi等[24]从青梅的花和种子里都分离到相对分子质量为354的3-O-咖啡酰奎尼酸、4-O-咖啡酰奎尼酸、5-O-咖啡酰奎尼酸。Yan等[8]从果实中分离得到3-O-咖啡酰奎尼酸甲酯、4-O-咖啡酰奎尼酸甲酯、5-O-咖啡酰奎尼酸甲酯。相对分子质量为354的同分异构体一般认为是3-O-咖啡酰奎尼酸、4-O-咖啡酰奎尼酸、5-O-咖啡酰奎尼酸。
从青梅中分离到5个相对分子质量为368的化合物[21],分别为3-O-阿魏酰奎尼酸、5-O-阿魏酰奎尼酸、3-O-咖啡酰奎尼酸甲酯、4-O-咖啡酰奎尼酸甲酯、5-O-咖啡酰奎尼酸甲酯。由于液相和质谱图谱显示,相对分子质量368的峰分别对应4,6,9,12峰,因4,6峰极性相近,9,12峰极性相近,故推测4,6峰是极性较大的3-O-阿魏酰奎尼酸、5-O-阿魏酰奎尼酸,而9、12峰是极性较小的3-O-咖啡酰奎尼酸甲酯、4-O-咖啡酰奎尼酸甲酯、5-O-咖啡酰奎尼酸甲酯中的两个,至于是哪两个,有待进一步表征。
3 讨论
经LC-MS分析乙酸乙酯组分,除一个小分子脂肪酸(辛酸)外,大部分化合物属于咖啡酰莽草酸类化合物。由于阿魏酸/咖啡酸的羧基与奎尼酸/莽草酸脂环上3个羟基都容易酰基化,因而同分异构体特别丰富。由于阿魏酸/咖啡酸上的羧基也比较活泼,在环境中容易与活泼的醇类化合物形成甲酯/乙酯等酯类化合物,所以导致该类化合物的衍生物非常多。这在青梅乙酸乙酯萃取物中得到充分的体现。
本试验结果表明,青梅乙醇提取物具有较好的抗食源性致病菌活性,其中萃取的乙酸乙酯组分抗菌活性比乙醇提取液活性强。咖啡酰莽草酸类化合物是青梅乙酸乙酯萃取物中的特征成分。提示咖啡酰莽草酸类化合物可能具有较好的抗菌活性,此有待于进一步的验证。

