益生菌对大鼠肾功能缺失性肠屏障损伤的修复作用
张筱琳 王希璠 肖娅琳 邱青璐 赵 亮,3*
(1 食品营养与人类健康高精尖创新中心 中国农业大学食品科学与营养工程学院 北京100083
2 教育部功能乳品重点实验室 中国农业大学食品科学与营养工程学院 北京100083
3 河北省畜产食品工程技术研究中心 河北三河065200)
流行病学调查显示,中国成人慢性肾病患病率高达10.8%,约有1.2亿成人患有慢性肾脏病,因此控制慢性肾病的发展和恶化成为目前亟待解决的问题[1]。慢性肾脏病中的肾功能损伤主要表现为肾脏纤维化、肾小球硬化和肾小球滤过率下降等[2]。肾功能损伤会导致血液中毒素无法被肾脏代谢,滞留在体内,而累积的毒素通过血液循环流至全身各处,造成机体肠道屏障[3-4]、心脏和脑部损伤[5],最终引发心脑血管疾病和贫血症等并发症。其中肠道屏障受损会加重机体炎症反应,大大提高了肾病患者心脑血管疾病的发生率[6-8]。
肠道上皮屏障由黏液层、肠上皮细胞和肠细胞间的紧密连接组成。黏液层能够保护肠道上皮细胞免受病原微生物的侵袭,同时是肠道蠕动的润滑剂。肠细胞顶端的等离子膜控制着物质跨细胞膜的主动和被动运输,紧密连接用来防止肠腔内物质的细胞旁渗透[9]。正常情况下,肠道上皮的紧密连接能够有效阻止有害物质和抗原(胃肠道内的细菌、细菌毒素、细菌副产物、消化酶、被降解的食物)的渗透,然而当慢性肾脏病患者的肠道屏障尤其是紧密连接受损时,肠道中的微生物及其副产物就会通过受损的肠屏障进入机体,引发机体炎症反应,加重肾脏及其他器官的损伤,使更多的毒素在体内积累,从而进一步加重肠道屏障损伤,形成恶性循环[10-11]。
目前治疗肠道屏障损伤的主要手段有服用药物,补充益生菌制剂和膳食纤维等营养成分。有大量研究表明益生菌有修复肠道屏障的功能[12-15],主要修复机制包括促进黏蛋白和免疫球蛋白sIgA的分泌,共同增强黏液层抵抗肠道微生物入侵的功能;分泌抗菌因子如短链脂肪酸和细菌素等,阻止病原微生物入侵肠道上皮细胞;提高紧密连接蛋白表达量等[16]。体外实验表明乳酸菌能够有效增加黏蛋白MUC2的分泌量[17],降低肠道环境pH值,抑制大肠杆菌的生长[18],促进免疫球蛋白sIgA分泌[19],然而,益生菌修复肠道屏障的能力存在菌株特异性,并且缺乏体内实验证据。
动物双歧杆菌A6分离自广西巴马长寿老人肠道,之前研究表明含有A6菌株的混合益生菌粉能够有效抵御抑制病原微生物的生长,改善小鼠肠道免疫功能[20]。本文采用5/6肾切除大鼠模型,连续灌胃混合益生菌粉10周,研究该益生菌修复肾功能缺失性肠道屏障损伤的功能,探讨菌株缓解慢性肾脏病炎症反应的机制。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 实验动物 SD大鼠39只,雄性,SPF级,6周龄,购自北京维通利华实验动物技术有限公司。
1.1.2 试剂 磷酸氢二钠、磷酸二氢钾、氯化钾、氯化钠、吐温-80、柠檬酸氢二铵、磷酸氢二钾、无水乙醇、二甲苯、浓盐酸(分析纯),北京化工厂;甲醛溶液(分析纯),国药集团化学试剂有限公司;无水乙醚、氢氧化钠,西陇化工;甘氨酸,上海远慕生物科技有限公司;中性树脂,国药集团化学试剂有限公司;BCA试剂盒、脂多糖试剂盒、C反应蛋白酶联免疫试剂盒、rabbit anti-claudin-1抗体、rabbit anti-occludin抗体和rabbit anti-ZO-1抗体,赛默飞世尔科技(中国)有限公司;Western及IP细胞裂解液(无抑制剂)、苯甲基磺酰氟溶液和辣根过氧化物酶标记山羊抗兔IgG(H+L),上海碧云天生物技术有限公司;TNF-α、IL-6、IL-10和IL-13酶联免疫试剂盒,北京华英生物技术研究所;标准大小鼠维持饲料(无菌、不含OVA),北京华阜康生物科技股份有限公司。
1.1.3 仪器与设备 AR1140电子分析天平,梅特勒托利多仪器上海有限公司;DELTA 320 pH计,梅特勒托利多仪器上海有限公司;Vert.A1倒置显微镜,德国ZEISS集团;Infinite M2000Pro多功能酶标仪,瑞士TECAN公司;ZW-A微量振荡器,江苏省金坛市荣华仪器制造有限公司;TDL-5-A低速离心机,上海安亭科学仪器厂;LGJ-18真空冷冻干燥机,北京松源华兴科技发展有限公司;Centrifuge 5418R小型台式高速离心机,芬兰Eppendorf公司。
1.2 试验方法
1.2.1 受试菌株的制备 动物双歧杆菌A6菌粉,菌量为3×1010CFU/mL,由北京和益源生物技术有限公司提供。
1.2.2 实验动物分组、造模及灌胃方式 动物实验经中国农业大学动物权利及伦理安全委员会批准,6周龄雄性SD大鼠被置于(25±2)℃SPF级动物房喂养,灯光日夜轮换。适应性喂养5 d后,随机分组(每组13只),即假手术组、模型组和益生菌组。分别于第0,7天进行5/6肾切除手术,其中假手术组仅麻醉备皮后,切开缝合。于第22天灌胃,益生菌组大鼠每天灌胃2mL 0.9%灭菌NaCl菌粉悬液,模型组和假手术组大鼠则每天灌胃2mL 0.9%灭菌NaCl溶液。
1.2.3 血清中脂多糖的测定 采用眼眶内眦采血的方法采集大鼠血液,静置2 h后,3 000×g离心15min,吸取血清,将上清以12 000 r/min、4℃离心5min,留取血清。使用赛默飞鳌试剂盒测定血清中脂多糖的含量。
1.2.4 大鼠结肠组织切片及病理染色 结肠用10%福尔马林溶液固定,常规石蜡包埋切片,进行苏木精和曙红(H&E)染色,观察结肠隐窝深度和黏膜厚度,进行PAS染色,观察结肠杯状细胞数量的变化。
1.2.5 Western-Blot分析 将大鼠结肠放入组织研磨器中,置于冰上,加入细胞裂解液和PMSF后匀浆,在冰上孵育30min,直至充分裂解。组织匀浆中的蛋白含量通过BCA试剂盒测定。蛋白提取完成后,通过4%~10%的SDS-PAGE电泳,将样品中不同分子质量的蛋白分开,初始电压为80 V,进入10%的分离胶后电压调整为120 V,电泳时间为90min,其中每个样品中总蛋白含量为50μg。电泳完成后,将蛋白转移到PVDF膜。转膜后,将每个蛋白对应的PVDF膜分别放在包含rabbit anti-claudin-1抗体、rabbit anti-occludin抗体、rabbit anti-ZO-1抗体或rabbit anti-actin antibodies抗体溶液中,抗体含量分别为1∶100,1∶5 000、1∶250和1∶1 000,孵化过夜。将孵化好的PVDF膜放入辣根过氧化物酶标记山羊抗兔IgG(H+L)溶液中继续孵化2 h,抗体含量为1∶1 000,孵化完成后用凝胶成像仪成像。
1.2.6 大鼠免疫蛋白因子的测定 按照上述方法分离得到大鼠血清,使用ELISA试剂盒测定血清中CRP、TNF-α、IL-6、IL-10和IL-13的含量。
1.3 数据分析
所有数据结果以平均值±标准差表示,采用SPSS 20.0统计软件进行One-Way ANOVA分析。样本均数之间差异性采用Duncan检验判断,P<0.05存在显著性差异。
2 结果与讨论
2.1 益生菌对慢性肾脏病大鼠血清中脂多糖含量的影响
脂多糖是革兰阴性菌外膜的主要成分,正常情况下肠道中细菌及脂多糖无法穿过肠道屏障,而当肠道紧密连接受损时,从病原体中释放的脂多糖可通过受损的肠道屏障进入血液,之后血液中脂多糖会引发机体先天免疫反应,来防止免疫系统受到进一步感染[21-23]。若脂多糖没有被机体免疫系统有效的控制和清除,则会引发败血性休克综合症[6]。
由图1可知,与假手术组相比,模型组大鼠血清中脂多糖含量显著升高(P<0.05),说明模型组大鼠的肠道屏障确实存在受损情况,血清中的脂多糖升高有可能会引发机体的炎症反应。益生菌灌胃后,大鼠血清中的脂多糖含量明显下降(P<0.05),这说明益生菌阻断了血清中脂多糖的来源,在修复肠屏障上有一定作用。
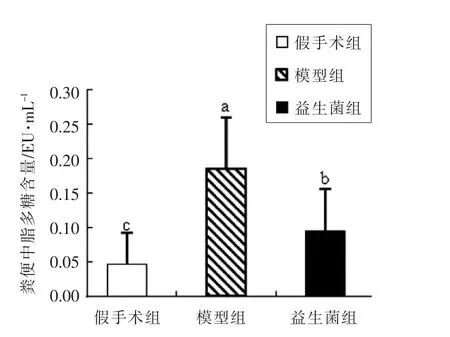
图1 慢性肾病大鼠血清中脂多糖含量Fig.1 Total LPS in serum of CKD rats
2.2 慢性肾脏病大鼠结肠黏膜的隐窝深度、黏膜厚度及杯状细胞含量的变化
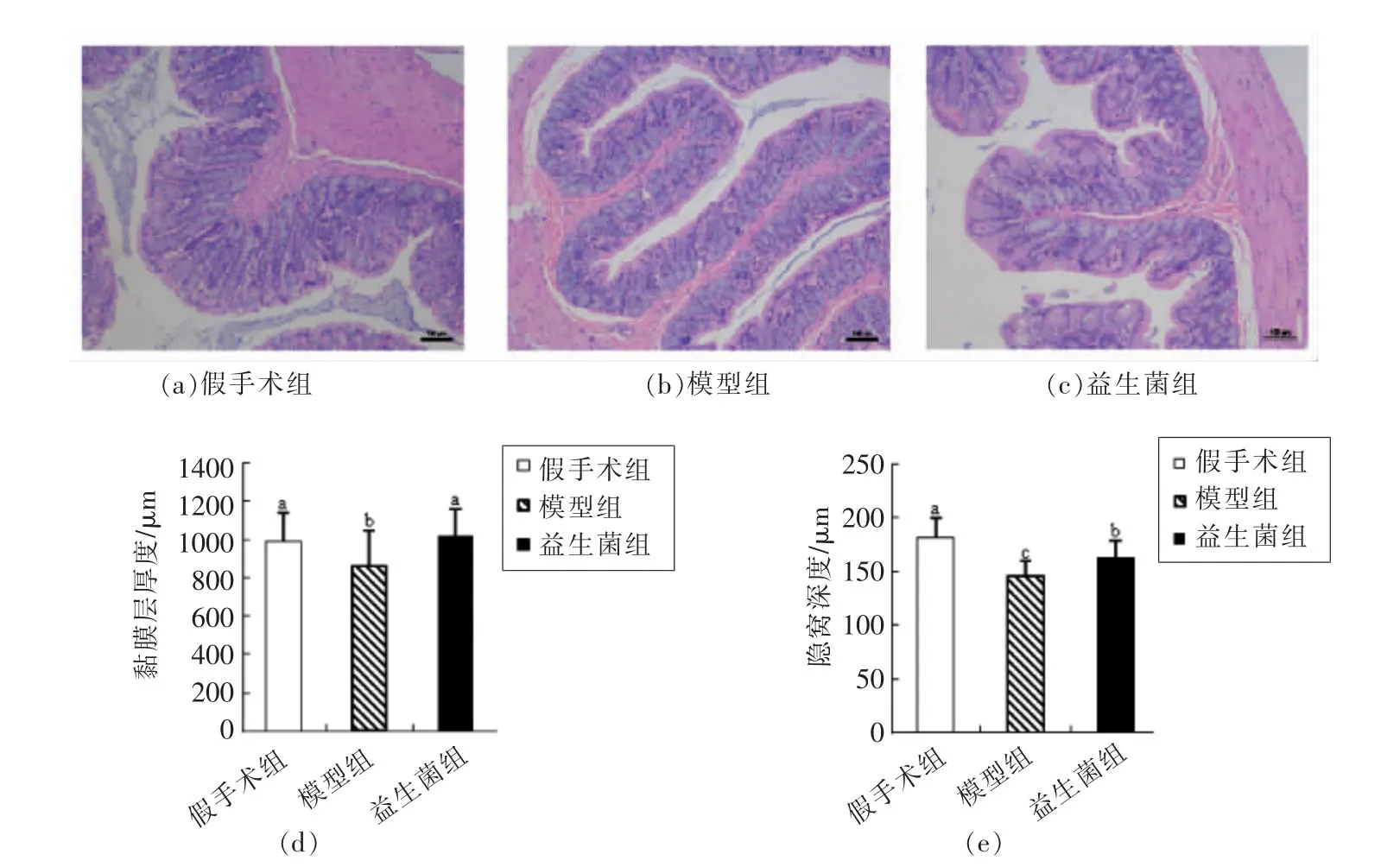
图2 慢性肾病大鼠结肠隐窝深度和黏膜厚度Fig.2 Crypt depth and mucosal thickness in colon of CKD rats
肠道黏膜的主要功能是吸收营养物质,分泌废物,作为屏障防止废物吸收和肠腔内的微生物及其有害副产物进入人体内部环境[24-25]。
根据图2中大鼠结肠H&E染色结果可知,与假手术组相比,模型组结肠组织的隐窝深度和黏膜厚度均明显降低(P<0.05);而与模型组相比,益生菌组的隐窝深度和黏膜厚度显著升高(P<0.05),说明灌胃益生菌后,结肠黏膜的形态有一定恢复。
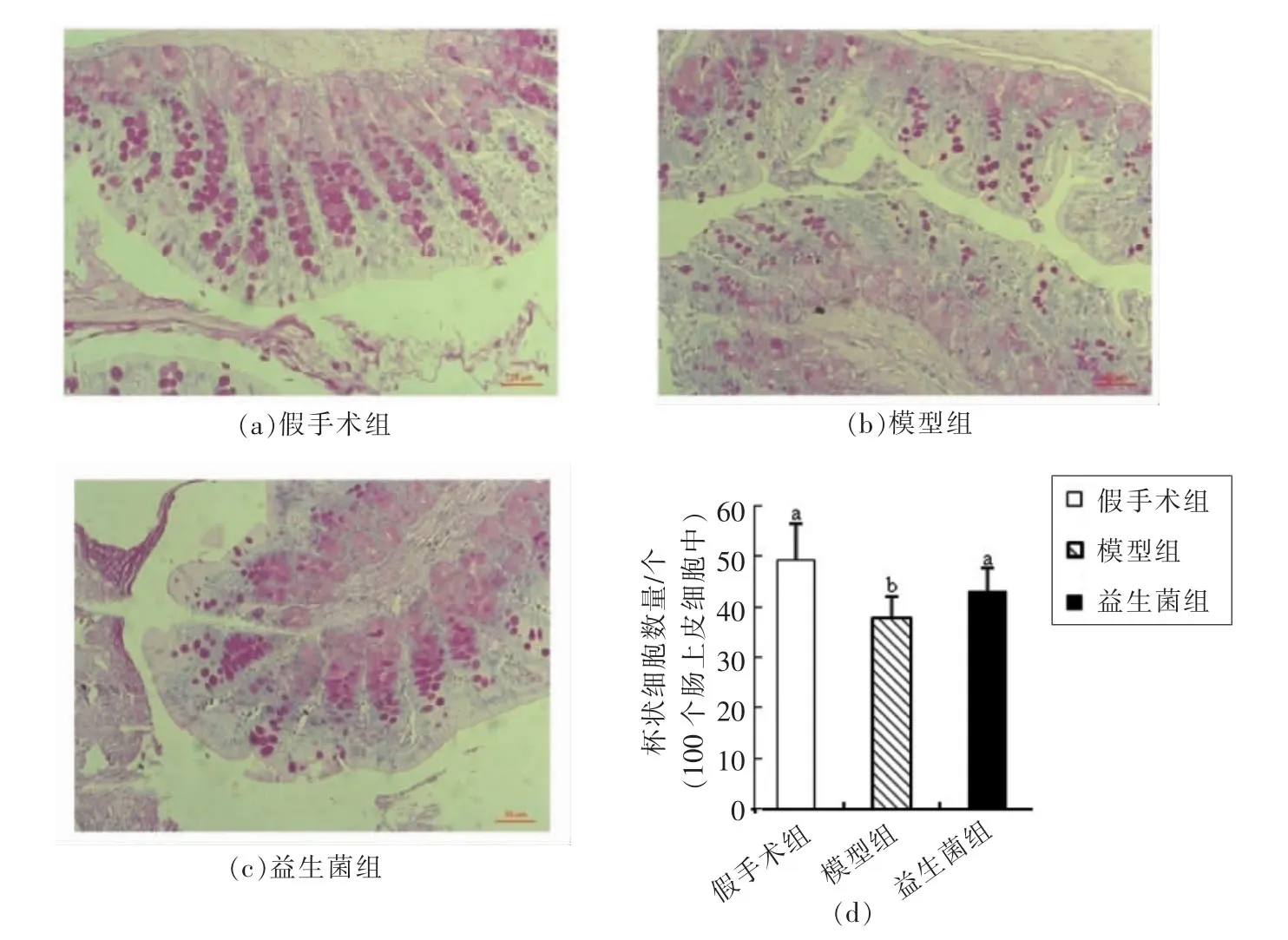
图3 慢性肾病大鼠结肠上皮中杯状细胞含量Fig.3 The number of goblet cells in colonic epithelia of CKD rats
杯状细胞能够在肠道中特异性地分泌黏蛋白,而这些黏蛋白会在黏膜表面聚集成水合凝胶,形成一层黏膜屏障,阻止肠道中的大颗粒物如细菌等物质直接接触肠上皮层[10,26-27]。当黏膜屏障被破坏后,肠道中的大颗粒物会刺激肠道上皮的免疫细胞,激活免疫屏障,保护机体不受异物的损害[9,26-27]。
根据图3中大鼠结肠组织PAS染色结果可知,与假手术组相比,模型组结肠组织的杯状细胞数量明显降低(P<0.05)。灌胃益生菌后,与模型组相比,益生菌组的杯状细胞数量显著升高(P<0.05)。由此推断,灌胃益生菌后结肠中被破坏的黏膜屏障得到修复,修复后的黏膜屏障能够阻止肠道中异物进入肠上皮,抑制肠道免疫细胞的活性。
2.3 益生菌对慢性肾脏病大鼠结肠上皮紧密连接蛋白的影响
肠道紧密连接结构由跨膜蛋白和胞质蛋白组成:①跨膜蛋白能够紧密连接周围的肌动蛋白和肌球蛋白环,通过调节紧密连接的结构和通透性,来调控细胞旁通透性;②胞内蛋白与肌动蛋白结合,调控紧密连接结构的组成和定位。跨膜紧密连接蛋白包括occludin、claudin蛋白家族和连接粘附因子-A,胞内蛋白包括ZO蛋白家族,其中ZO-1是关键蛋白。ZO-1能够结合跨膜蛋白和环状肌动蛋白,在紧密连接组装和功能上发挥必要作用[6,9]。
根据图4可知,灌胃益生菌后,大鼠结肠中的ZO-1和Claudin-1蛋白的含量显著回升(P<0.05),说明益生菌能够在一定程度上修复被破坏的肠道紧密连接,减少肠道中有害物质和抗原进入机体,抑制机体的免疫反应。
2.4 混合益生菌对慢性肾脏病大鼠血清中细胞因子的影响
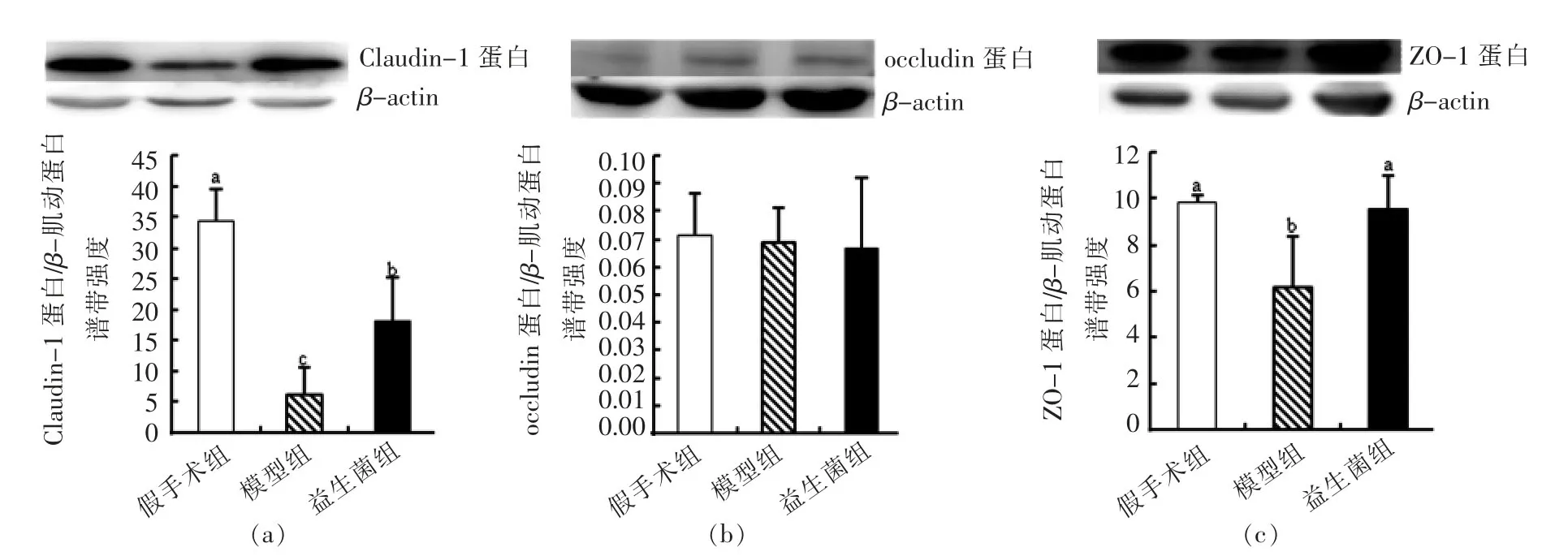
图4 各组大鼠结肠上皮紧密连接蛋白的表达量Fig.4 Abundance of intestinal barrier proteins in colonic epithelia of rats
C-反应蛋白是评价慢性肾病患者炎症情况的指标,在临床上广泛使用[28-30]。TNF-α属于TNF类细胞因子,连接先天性免疫和获得性免疫,能够激活吞噬细胞杀死病原体,并诱导单核细胞和血管内皮细胞分泌趋化因子、IL-1和IL-6等促炎因子,引起细胞因子的级联反应[28-31]。IL-6由Th2细胞、单核细胞和血管内皮细胞等产生,有促炎活性,能够加重慢性肾病大鼠的动脉粥样硬化,增加慢性肾病患者的死亡率[28,31]。IL-13主要由Th2细胞产生,有研究表明IL-13和IL-10均能够抑制单核细胞的抗原呈递功能和IL-1和TNF-α等细胞因子的释放[32-33]。此外,还有证据说明IL-10能够调节肾病患者体内紊乱的细胞因子网络[31]。
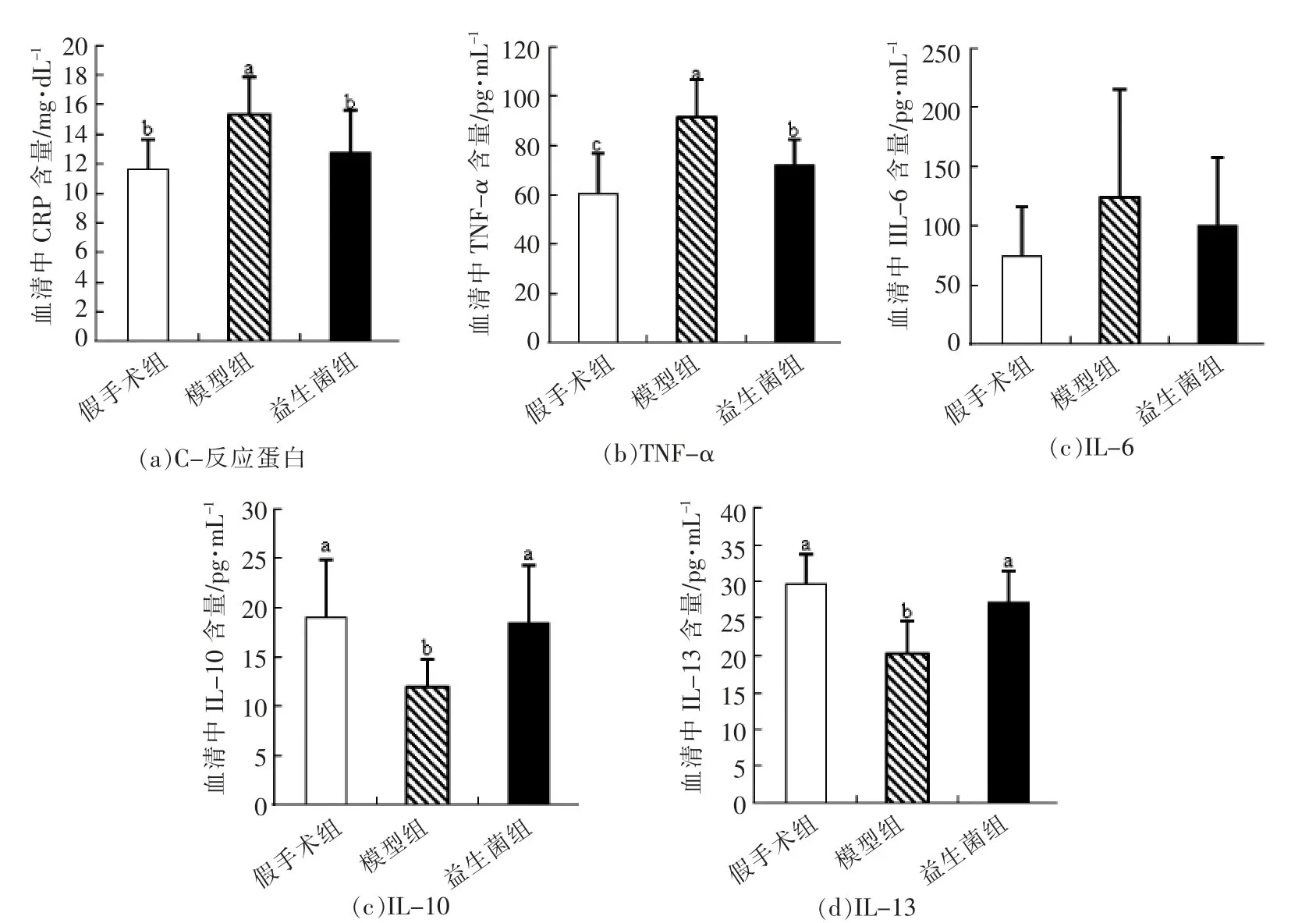
图5 血清中C-反应蛋白、TNF-α、IL-6、IL-10、IL-13的含量Fig.5 Total CRP,TNF-α,IL-6,IL-10,IL-13 production in serum
由图5可知,与假手术组相比,模型组大鼠血清中C-反应蛋白含量显著升高,说明模型组大鼠出现全身炎症现象,这种现象有可能是肠道屏障受损后,肠道中脂多糖进入机体所致。灌胃益生菌后,与模型组大鼠相比,益生菌组大鼠血清中C-反应蛋白含量显著降低,说明本益生菌产品能够有效抑制肾病大鼠体内的炎症反应。结合之前的实验结果,益生菌干预后,肾功能缺失性肠屏障损伤得到修复,益生菌有可能通过改善受损肠屏障来减少肠道中微生物及其它异物进入体内,从而减轻肾病大鼠体内的炎症现象。此外,与假手术组相比,模型组大鼠血清中促炎因子TNF-α(P<0.05)和IL-6(P>0.05)含量升高,抗炎因子IL-10(P<0.05)和IL-13(P<0.05)含量显著下降,说明慢性肾病大鼠体内的先天性免疫系统被激发,与C-反应蛋白的结果一致,而在灌胃益生菌后,与模型组大鼠相比,益生菌组大鼠血清中促炎因子TNFα(P<0.05)和IL-6(P>0.05)含量下降,抗炎因子IL-10(P<0.05)和IL-13(P<0.05)含量显著升高,说明益生菌通过调节血清中促炎因子和抗炎因子的水平,来改善大鼠体内的免疫失衡和炎症反应。
3 结论
通过灌胃益生菌产品能够显著降低慢性肾脏病大鼠血清中脂多糖含量,有效改善大鼠肾功能缺失性肠屏障损伤,增加隐窝深度和黏膜厚度,提高肠道上皮中杯状细胞的数量,修复肠上皮细胞间的紧密连接,阻止肠道中微生物、毒素及异物进入机体内环境,从而减轻慢性肾脏病大鼠体内的系统炎症现象。

