乳酸菌发酵大麦提取物对胰岛素抵抗的干预作用
张家艳 肖 香 周兴华 董 英
(江苏大学食品与生物工程学院 江苏镇江212013)
当机体内胰岛素不足以维持机体的葡萄糖代谢,胰岛细胞便代偿性地分泌过量胰岛素,导致胰岛素浓度增加,功能下降,即形成胰岛素抵抗。胰岛素抵抗的产生与高能量的摄入密切相关,长期摄入高能量饮食增加了胰岛素抵抗发生的概率。目前广泛认为高脂、高糖饮食是产生胰岛素抵抗的关键因素之一[1]。胰岛素抵抗产生的同时伴随着高血糖、高血脂、高胰岛素血症以及炎症因子分泌异常等现象。
大麦经乳酸菌发酵后可显著提高提取物中β-葡聚糖、多酚以及蛋白等活性成分的含量,且有研究报道其活性成分具有调脂降糖,改善胰岛素抵抗的功效。Skendi等[2]研究发现富含β-葡聚糖的饮食能够改善胰岛素抵抗和抑制肝脏脂质积累。Bays等[3]研究发现喂食3g/dβ-葡聚糖能够改善大鼠口服糖耐量并改善胰岛素抵抗。Chang等[4]研究发现香草酸可干预肥胖大鼠肝脏胰岛素抵抗和机体炎症水平。
课题组前期预研试验表明,与未发酵大麦相比,植物乳杆菌发酵大麦粉能显著地预防肥胖大鼠胰岛素抵抗[5]。LFBE干预胰岛素抵抗的作用及其机制国内外尚未见报道。
本文采用饲喂高糖、高脂饲料的方法建立营养型肥胖大鼠的胰岛素抵抗模型,通过测定口服糖耐量、血清胰岛素、血脂水平、炎症因子表达水平等指标,研究LFBE对胰岛素抵抗的干预作用。
1 材料与仪器、设备
1.1 实验动物及饲养条件
清洁级健康SD大鼠80只,5~6周龄,160~180 g,雄性,购于江苏大学实验动物中心,许可证号:SCXK(苏)2013-0011。试验过程遵循江苏省实验动物管理委员会和国家实验动物福利保护的规定。大鼠饲养于江苏大学实验动物中心动物房,其室温(25±2)°C,相对湿度(55±5)%,12 h/12 h光照,自由获取食物和饮水。
1.2 饲料
大鼠基础饲料,购于南京皇佳生物技术有限公司。高脂饲料由课题组自制,即在基础饲料中添加12%猪油、10%蔗糖及5%蛋黄粉混合制成。混合均匀后切条、烘干,于-20℃保存,设定其保质期为1个月。
1.3 试剂与材料
大麦:新鲜脱壳大麦,扬饲麦3号,购自盐城市双增农化科技有限公司。
乳酸菌:植物乳杆菌(Lactobacillus plantarum dy-1,CGMCC No.6016),本实验室分离,中国普通微生物菌种保藏管理中心保藏。
IKB、NF-B、P38、P-p38、JNK、P-JNK和βactin等抗体,Abcam公司;炎症因子测定试剂盒,美国eBioscience公司;其它相关测定试剂盒,南京建成生物工程研究所;其它生化试剂,国药集团上海化学试剂有限公司。
1.4 仪器与设备
B040234全自动酶标仪,美国Thermo公司;电泳仪和转运仪,BioRad有限公司;T8电动匀浆器,广州仪科实验室技术有限公司(IKA集团公司);冷冻离心机,德国Eppendorf公司;FD-8真空冷冻干燥机,北京博医康有限公司;化学发光检测器,上海培清科技有限公司。
1.5 试验方法
1.5.1 乳酸菌发酵大麦提取物的制备 新鲜大麦脱壳后磨粉、过筛,按料液比1∶7混合均匀。按1×107接种活化至对数期后(活菌数达到1×109CFU/mL)的植物乳杆菌dy-1,搅拌5 min,30℃发酵24 h,8 000 r/min离心15min,收集上清液,冷冻干燥即乳酸菌发酵大麦提取物。
1.5.2 营养型肥胖大鼠模型的建立及试验设计在SD大鼠适应环境1周后,按体重将大鼠分为正常组和模型组,分别喂以基础饲料和高脂饲料。饲喂8周后,测定大鼠体重、体长和口服糖耐量,取体重超过正常大鼠20%、Lee’s指数增加的大鼠作为肥胖模型大鼠。
以健康大鼠为正常组,灌胃生理盐水并喂食基础饲料。肥胖模型大鼠按平均体重随机分为模型对照(HFD)组、乳酸菌发酵大麦提取物(LFBE)组。模型对照组灌胃4mL/kg bw的生理盐水并喂食高脂饲料,乳酸菌发酵大麦提取物组灌胃1 g/kg/d的LFBE并喂食高脂饲料。
各组试验大鼠均连续灌胃8周,每天1次,记录每组大鼠周体重变化。末次灌胃后禁食8 h,次日采用水合氯醛麻痹,腹主动脉取血,3 500 r/min离心10min分离血清,于-20°C保存。
1.5.3 口服糖耐量及血清胰岛素的测定 口服糖耐量测试(OGTT)方法为对空腹大鼠经口灌胃葡萄糖2 g/kg,分别于0,0.5,1,2 h时断尾取血,采用强生稳步血糖仪测定血糖水平。
血清胰岛素含量的测定采用ELISA试剂盒,根据双抗体夹心法测定样品中大鼠胰岛素水平。
1.5.4 血清生化指标的测定 大鼠血清中甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)等含量采用全自动生化分析仪测定。
1.5.5 血清炎症因子的测定 分别采用肿瘤坏死因子(TNF-α)、单核细胞趋化蛋白(MCP-1)、白细胞介素10(IL-10)及白细胞介素1β(IL-1β)Elisa试剂盒测定SD大鼠血清中的主要炎症因子TNF-α、MCP-1、IL-10和IL-1β含量。
1.5.6 Western blot检测脂肪中NF-B、MAPK蛋白表达水平 取不同组大鼠附睾脂肪0.5 g,冰浴剪碎并加入液氮,迅速研磨成粉,加入0.5mL组织裂解液,置于冰上裂解20min,用组织匀浆机匀浆,4°C 12 000 g/min离心5min,取上清液,用BCA法测定上清液的蛋白浓度。
每个样品加入5×上样缓冲液,100°C下加热5min使其变性后上样,10%SDS-PAGE(聚丙烯酰胺凝胶电泳)电泳分离,先浓缩胶恒压80 V,后分离胶恒压100V。将胶取出,连同PVDF膜和滤纸置于转运液中浸润,做好标记,然后将其以海绵-滤纸-凝胶-PVDF膜-滤纸-海绵的顺序组装成“三明治”状,置于转运仪中,加入转运液,稳流200mA,转运2 h。
将PVDF膜取出后置于TBST中洗涤3次,每次10min,再置于含有5%脱脂奶粉溶液中摇晃封闭90min。膜封闭后,用TBST洗涤3次,每次10 min。加入稀释的一抗4°C孵育过夜,然后用TBST洗涤3次,每次10min。加入稀释的二抗,室温摇晃2 h。最后用TBST洗涤3次,每次10min。采用化学发光法(ECL)曝光显色。
1.5.7 数据分析 采用统计软件Excel对结果进行分析,各组数据以±SD(平均值±标准偏差)表示。采用单项方差分析,用DPS来确定数据间的显著性差异,显著水平设定为P<0.05。
2 结果与讨论
2.1 LFBE对肥胖大鼠体重的影响
由图1数据可以看出造模成功的肥胖组大鼠体重显著高于正常组大鼠(P<0.05),且无组间差异。灌胃8周后,正常组大鼠和肥胖组大鼠体重均显著增加,且增长趋势一致。与HFD组相比,灌胃8周LFBE后,LFBE高剂量组的大鼠体重增长幅度逐渐减缓,明显低于模型对照组(P<0.05);而LFBE低剂量组的大鼠体重虽低于模型对照组但无显著性的差异。灌胃8周吡格列酮后,大鼠的体重反而高于模型组且也无明显差异。结果表明,LFBE可以显著地减少大鼠体重增加,其效果优于吡格列酮。
2.2 LFBE对肥胖大鼠口服糖耐量和血清胰岛素含量的影响
胰岛素抵抗常伴随着机体糖耐量受损,刺激胰岛素大量分泌而加速肥胖[6]。LFBE对肥胖大鼠糖耐量的影响见图2。试验前,与正常组相比,其它各组肥胖大鼠的口服糖耐量均显著较低,且无组间差异,其中喂食高脂饲料可导致大鼠口服糖耐量降低。灌胃4周后,正常组大鼠的糖耐量维持在正常水平,而HFD组大鼠的糖耐量仍维持在较低水平。与HFD组大鼠的糖耐量相比,LFBE高、低剂量组大鼠的糖耐量显著增加。PGT组肥胖大鼠的糖耐量虽增加明显但无显著性差异。灌胃8周LFBE后,HFD组大鼠的糖耐量持续维持在较低水平,而LFBE组大鼠糖耐量已与正常组大鼠糖耐量相似,维持在相对稳定的水平。其中PGT组肥胖大鼠的糖耐量增幅最大,这是是因为吡格列酮是通过增加脂联素水平,减少肝脏葡萄糖生产及增加AMPK活性来干预肥胖小鼠胰岛素抵抗[7]。

图1 LFBE对肥胖大鼠周平均体重的影响Fig.1 Effects of LFBE on mean weekly body weight in obese rats
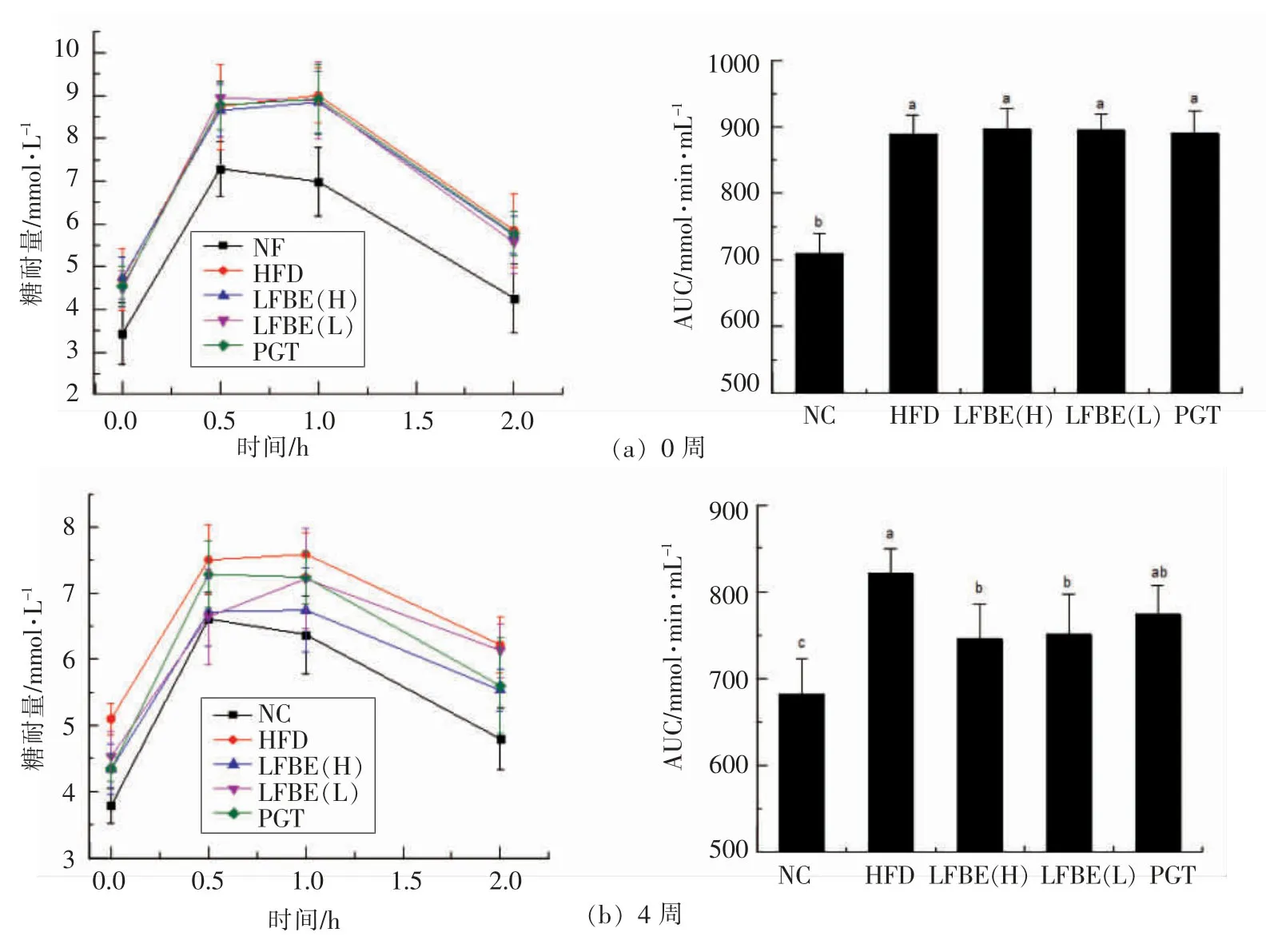
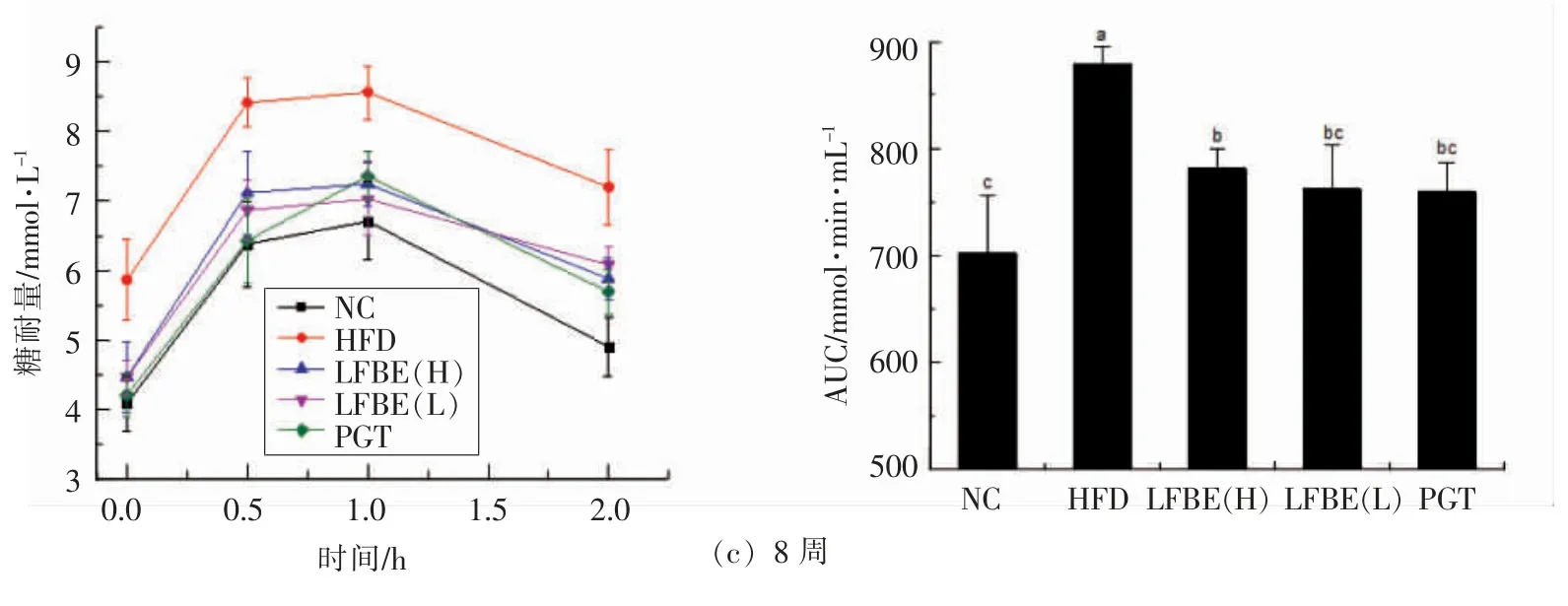
图2 LFBE对肥胖大鼠口服糖耐量的影响Fig.2 Effects of LFBE on oral glucose tolerance in obese rats
胰岛素是具有多种生物学效应的激素,对保持机体营养物质的代谢平衡,维持内环境稳定具有至关重要的作用。如图3所示,高脂饲料诱导的肥胖大鼠的血清胰岛素水平较正常组显著上升(P<0.05),出现高胰岛素血症,表明产生了胰岛素抵抗。灌胃8周后,与HFD组相比,LFBE高、低剂量组和PGT组大鼠血清胰岛素含量均显著下降(P<0.05)。
吡格列酮是PPARs激动剂,能高效活化PPARγ,进而调控胰岛素相关基因的转录[8]。有文献报道,大麦中的β-葡聚糖和多酚具有调节机体血糖和胰岛素水平的功能。Behall等[9]研究发现饮食中的大麦β-葡聚糖能够减少餐后血糖和胰岛素含量,同时也可减少高胆固醇男性的血脂水平。Kim等[10]发现谷物中可溶性膳食纤维(β-葡聚糖)在调节血糖和胰岛素分泌等方面具有显著的益处。有研究表明,阿魏酸能够调节脂质水平、葡萄糖稳态以及干预胰岛素抵抗[11-12]。LFBE调节肥胖大鼠口服糖耐量和胰岛素分泌,可能与其富含的多酚和β-葡聚糖相关。
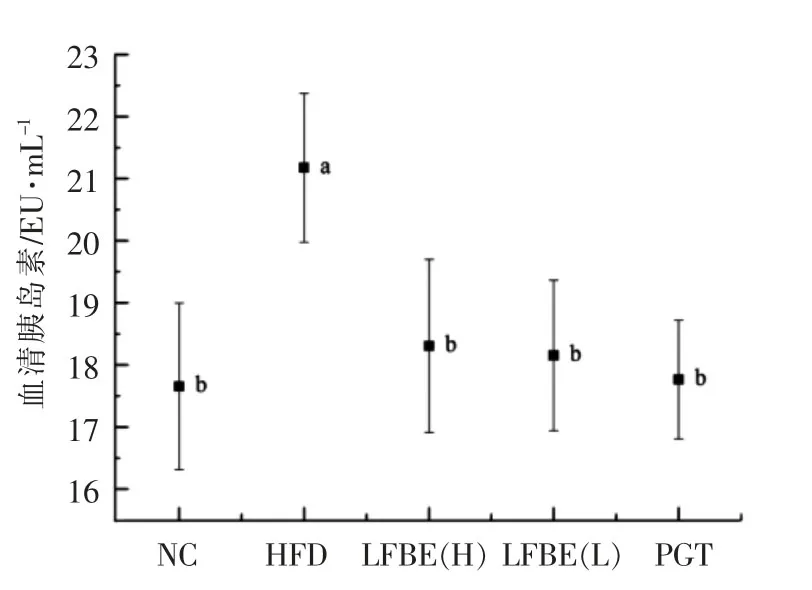
图3 LFBE对肥胖大鼠血清胰岛素的影响Fig.3 Effects of LFBE oninsulin levels in obese rats
2.3 LFBE对肥胖大鼠血脂水平的影响
机体血脂水平异常改变,可导致体内脂质异常蓄积,诱发机体产生高脂血症,严重者可引起动脉粥样硬化、冠心病等。有研究报道,肥胖大鼠出现胰岛素抵抗的同时,还伴随脂代谢紊乱[13]。从表1可知,与正常对照组相比,HFD组大鼠的血清TG和TC含量显著升高,HDL含量显著降低,而LDL含量无显著性的差异,这显然与肥胖伴随的高脂血症有关。灌胃LFBE 8周后,与HFD组相比,LFBE组大鼠的血清中TG和TC含量均显著降低,大鼠血清中HDL含量升高,无显著性差异。LFBE组大鼠的血清LDL含量与HFD组相比没有显著差异(P>0.05),其中LFBE高剂量组优于低剂量组。与HFD组相比,PGT组大鼠的血清中TG和TC含量均显著降低,HDL和LDL均无显著差异(P>0.05)。
虽有研究报道,大麦中富含的β-葡聚糖具有降低机体LDL的作用[14-15],但本研究中并未见LFBE降低肥胖大鼠血清LDL的试验结果,其原因可能是LFBE中β-葡聚糖的含量尚未达到影响LDL的水平[16]。吡格列酮通过促进脂肪干细胞向成熟脂肪细胞分化,增加小脂肪细胞数量,减少大脂肪细胞的数量,从而降低FFAs含量和血脂水平[17]。
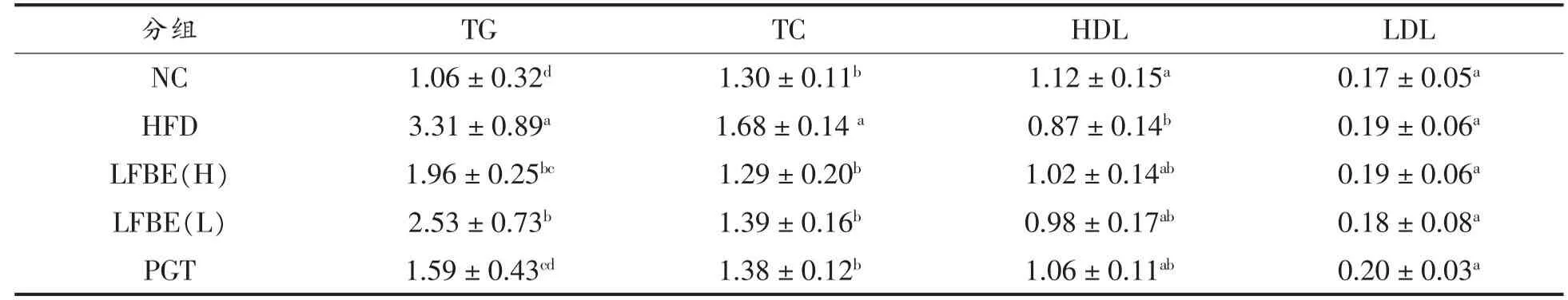
表1 LFBE对肥胖大鼠血脂水平的影响(mmol/L)Table1 Effects of LFBE on serum lipid in obese rats(mmol/L)
2.4 LFBE对肥胖大鼠炎症因子的影响
近年来的研究表明,肥胖诱发胰岛素抵抗与慢性低度系统性炎症密切相关。肥胖机体的促炎因子如白细胞介素(IL-1β、IL-6)、肿瘤坏死因子(TNF-α)、单核细胞趋化蛋白1(MCP-1)等的分泌增加,抗炎因子如白细胞介素(IL-10)分泌减少。LFBE对炎症因子的影响见表2。与正常组相比,HFD组血清中IL-1β、IL-6、TNF-α和MCP-1含量显著增加(P<0.05),而血清中IL-10分泌明显减少(P<0.05);与HFD组相比,LFBE高剂量组血清中IL-1β、IL-6、TNF-α和MCP-1含量均显著降低(P<0.05),而LFBE高剂量组血清中IL-10含量显著上升(P<0.05);LFBE低剂量组血清中仅IL-1β含量显著降低(P<0.05),其余炎症因子并无显著性变化,说明LFBE具有减少促炎因子表达和增加抗炎因子表达的作用。与HFD组相比,PGT组血清中IL-1β、IL-6和TNF-α含量显著减少(P<0.05),而MCP-1和IL-10含量并无显著性变化。
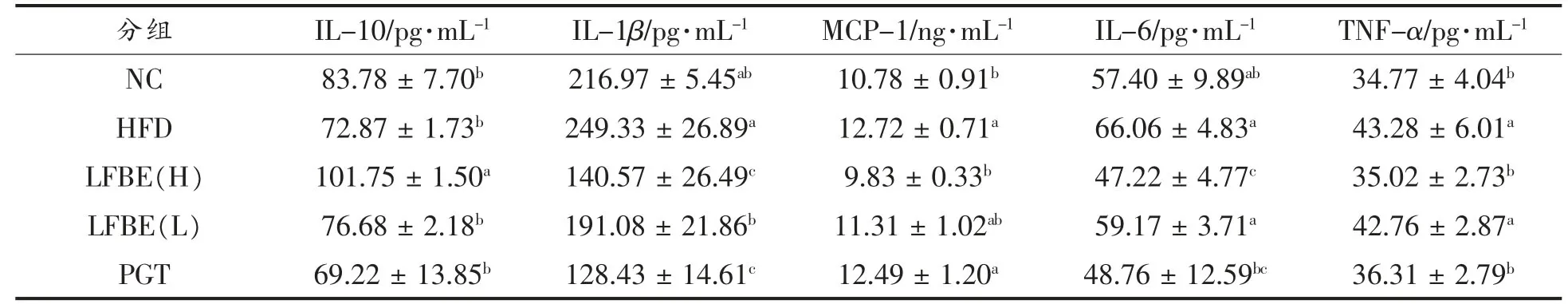
表2 LFBE对肥胖大鼠血清炎症因子水平的影响Table2 Effects of LFBE on inflammatory cytokines in obese rats
TNF-α是第1个被发现把肥胖与慢性系统炎症联系起来的炎性因子。TNF-a功能的缺陷可以干预肥胖鼠胰岛素敏感性和血糖的平衡[18]。有研究表明,在肥胖者的血清和脂肪组织中,TNF-a,IL-1α和IL-1β炎性因子的表达显著升高,并且其含量的减少与体重减轻也呈正相关[19-20]。IL-1β和IL-6都是系统胰岛素抵抗的重要炎性标记物,血浆中IL-1β与IL-6浓度同时升高在很大程度上预示发生2型糖尿病风险增加[21]。吡格列酮调节炎症因子表达已有很多研究[22]。Grosso等[23]发现吡格列酮能够抑制IL-6和TNF-α的表达。许多研究表明,富含多酚的谷物具有抗氧化和抗炎症因子的作用[4,11,24]。LFBE和吡格列酮可通过抑制机体产生IL-1β、IL-6和TNF-α等炎性因子干预胰岛素抵抗。
2.5 LFBE对肥胖大鼠脂肪组织中MAPK和NF-B表达水平的影响
炎症是肥胖诱导胰岛素抵抗的主要原因之一,虽然脂肪组织和肝脏都是重要的代谢器官,但肥胖诱发的系统炎性似乎主要由脂肪组织引发。磷酸化MAPK和NF-κB途径在激活炎性基因的表达中扮演着重要的角色。
近来有研究证明JNK在与高脂饮食生活方式有关的代谢综合征及炎症反应中扮演着重要的角色。当受到高脂饮食的驱动时,JNK基因可诱发导致糖尿病的炎症[25]。p38也是MAPK家族的一员,机体发生炎症反应时与p38被激活密切相关[26]。图4是采用Western blot检测LFBE对大鼠脂肪组织中p-JNK和p-p38蛋白表达水平的影响。如图4所示,与正常组相比,高脂饮食导致脂肪组织中p-JNK和p-p38的表达量显著上调。与HFD组相比,灌胃LFBE 8周后,脂肪组织中p-JNK和p-p38的表达量显著下调(P<0.05)。而灌胃吡格列酮8周,脂肪组织中p-JNK和p-p38的表达量均无显著性的变化(P>0.05)。
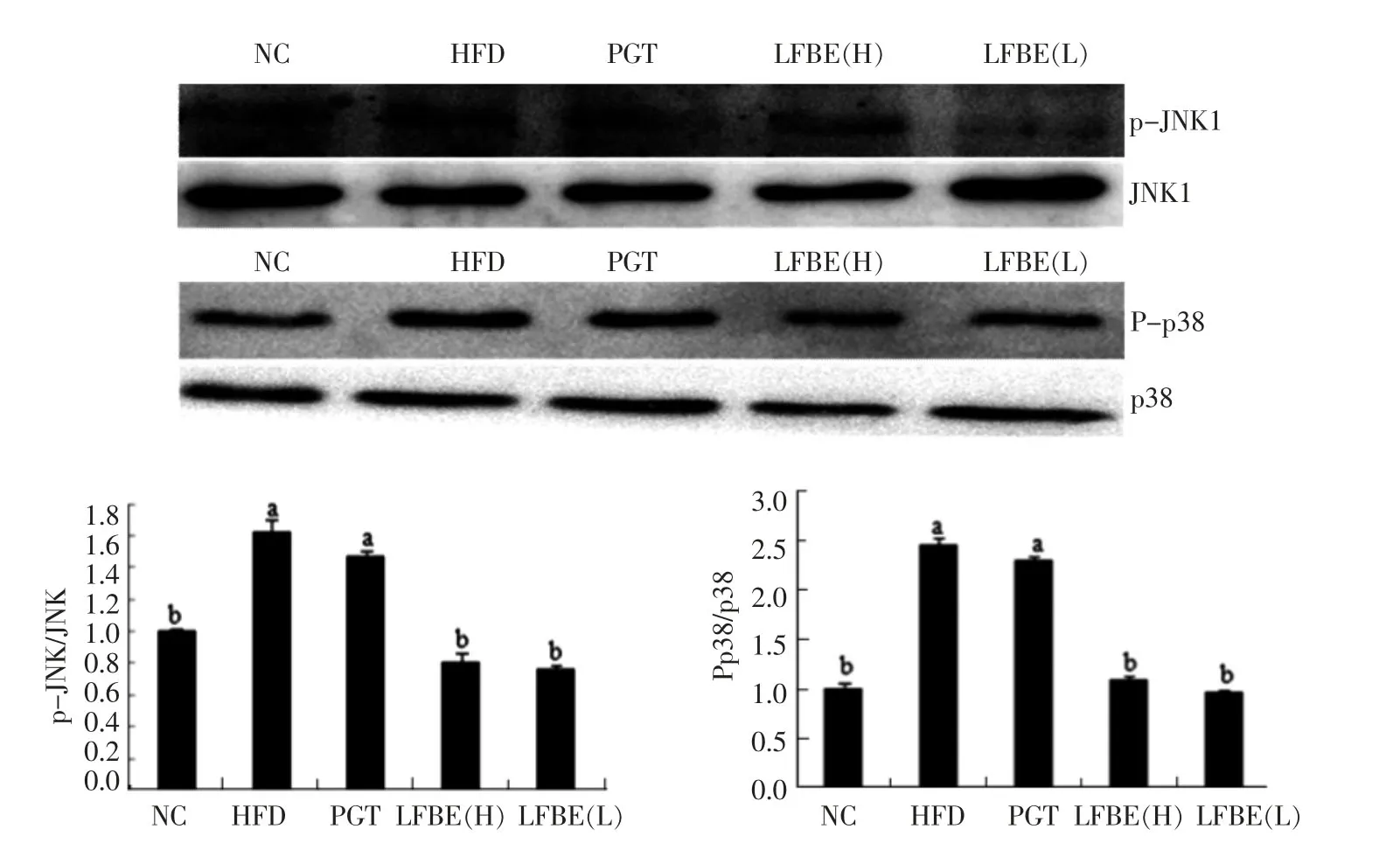
图4 LFBE对肥胖大鼠脂肪组织中JNK和p38磷酸化的影响Fig.4 Effects of LFBE in inhibiting phosphorylation of JNK and p38
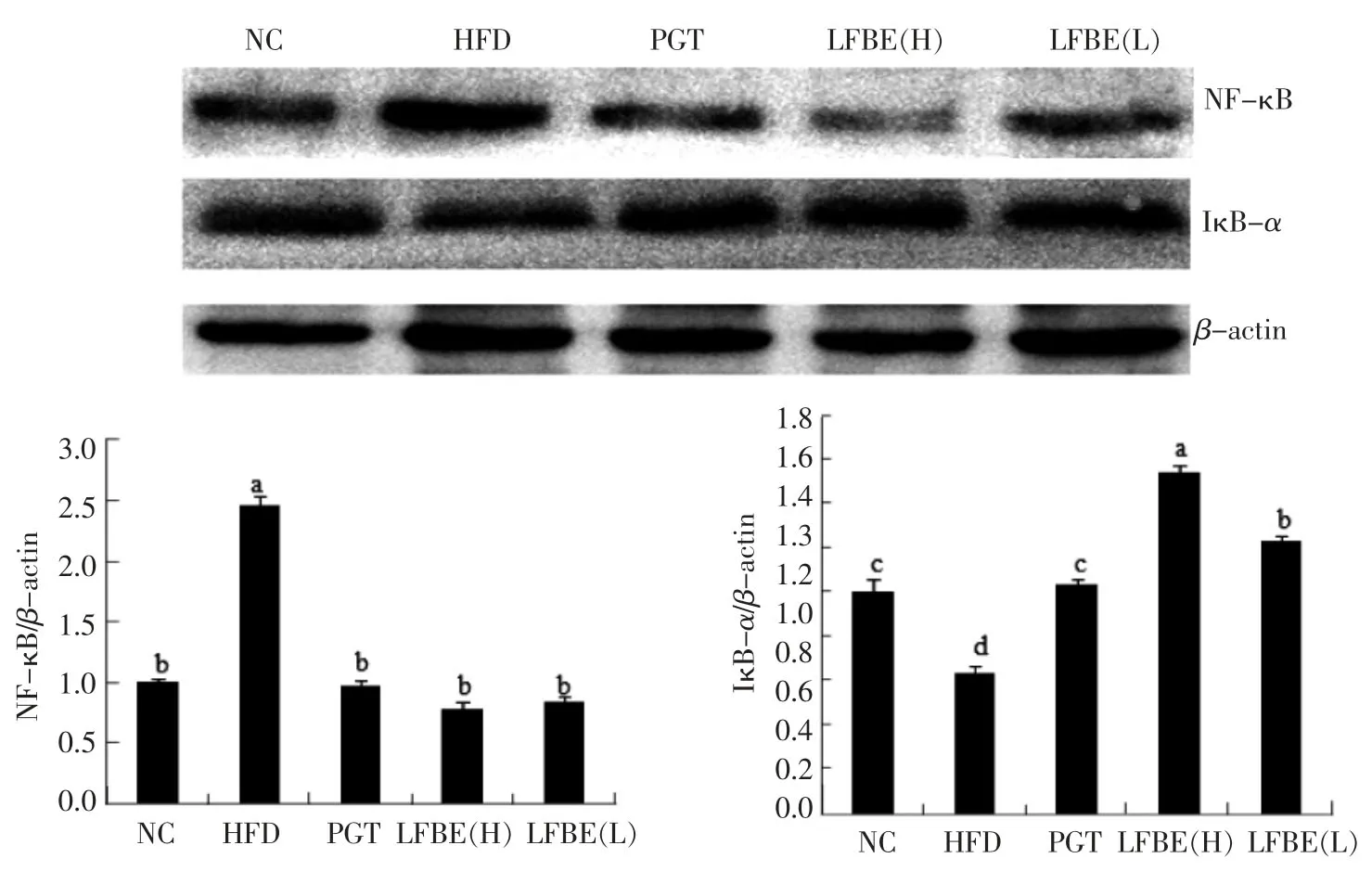
图5 LFBE对肥胖大鼠脂肪组织中NF-κB和IκB-α表达的影响Fig.5 Effects of LFBE on NF-κB and IκB-αprotein expression
NF-κB存在于多种细胞内,是一种具有多向性调节作用的核转录因子,参与炎症、免疫、细胞增殖和细胞凋亡等多种生理与病理过程的基因调控。在脂肪细胞中,炎性因子可导致NF-κB的抑制物IκB-α磷酸化,磷酸化的IκB-α发生降解,导致NF-κB的活化[27]。图5是采用Western blot检测LFBE对大鼠脂肪组织中IκB-α和NF-κB蛋白表达水平的影响。如图5所示,与正常组相比,高脂饮食导致脂肪组织中IκB-α的表达量显著下调,NF-κB的表达量显著上调(P<0.05)。与HFD组相比,灌胃LFBE 8周后,脂肪组织中IκB-α的表达量显著上调,NF-κB的表达量显著下调(P<0.05)。灌胃吡格列酮8周后,脂肪组织中IκB-α的表达量显著上调,NF-κB的表达量显著下调(P<0.05),而效果差于LFBE。Gang等[28]研究发现,吡格列酮可通过抑制NF-κB信号途径激活并控制高糖饮食诱导的胰岛素抵抗和2型糖尿病大鼠的肾损伤。
本研究表明,肥胖大鼠脂肪组织的p-JNK、pp38和NF-κB表达水平显著上调,IκB-α表达水平显著下调,说明饲喂高糖高脂饲料可激活MAPK和NF-κB的表达,而LFBE可下调MAPK和NF-κB的表达。有研究表明,高含量TNF-a能激活MAPK和NF-κB的表达,从而导致炎症和胰岛素抵抗[29]。LFBE可通过调节MAPK和NF-κB信号通路表达干预胰岛素抵抗。
3 结论
乳酸菌发酵大麦提取物能显著降低营养型肥胖大鼠的体重、血清TG、TC和胰岛素水平,提高口服糖耐量,并能显著降低肥胖大鼠血清中IL-1β、IL-6、TNF-α和MCP-1的表达和增加抗炎因子IL-10的表达。其主要的机制是通过抑制MAPK(JNK、p38)的磷酸化以及NF-κB的表达来干预胰岛素抵抗的。吡格列酮也能缓解肥胖大鼠胰岛素抵抗症状,且能上调IκB-α的表达和下调NF-κB的表达水平。吡格列酮对p-JNK和p-p38的表达、减缓体重增长等无显著性作用。

