大剂量甲氨蝶呤治疗血液系统恶性肿瘤后排泄延迟的影响因素及其与不良反应的相关性研究Δ
钱 卿,胡 楠,陈 荣,蒋 艳,凌 静,邹素兰
(常州市第一人民医院药剂科,江苏 常州 213003)
甲氨蝶呤(methotrexate,MTX)作为二氢叶酸还原酶抑制剂,可竞争性抑制二氢叶酸转化为有生理活性的四氢叶酸,从而影响胸腺嘧啶核苷酸和嘌呤核苷酸的生物合成过程,最终导致DNA的合成受阻而抑制肿瘤细胞的增殖。大剂量甲氨蝶呤(high-dose methotrexate,HDMTX)被定义为MTX的剂量>500 mg/m2,常作为联合化疗的组成部分用于治疗儿童及成人的血液系统恶性肿瘤,如急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)、非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)及骨肉瘤等[1-2]。HDMTX方案可通过增加MTX血药浓度,使MTX向细胞内转运增加,从而增强疗效,但同时也会产生显著的毒性作用,如急性肾损伤、骨髓抑制、黏膜炎、肝毒性及胃肠道反应等[3]。在HDMTX方案中,即使采用固定的剂量与输注时间,MTX的体内药动学过程在不同患者或同一患者不同治疗周期间仍有很大差异性,尤其是排泄延迟现象[4]。因此,通过治疗药物监测(therapeutic drug monitoring,TDM),观察患者是否出现MTX排泄延迟以及把握亚叶酸钙(calcium folinate,CF)的解救时机和剂量具有重要的临床价值。本研究统计分析了常州市第一人民医院(以下简称“我院”)血液科进行HDMTX化疗患者的临床资料及血药浓度监测数据,观察不同时间点的MTX血药浓度分布和排泄延迟情况,探讨导致MTX排泄延迟的有关影响因素及其与不良反应的相关性。
1 资料与方法
1.1 资料来源
选取2016年7月至2018年6月于我院血液科进行HDMTX化疗并监测血药浓度的血液系统恶性肿瘤患者34例,搜集其病历资料,其中,ALL患者13例,NHL患者21例(包括弥漫大B细胞淋巴瘤9例、T淋巴母细胞淋巴瘤5例、B淋巴母细胞淋巴瘤3例、NK-T细胞淋巴瘤3例和滤泡性淋巴瘤1例)。HDMTX化疗患者的人口学统计资料及实验室指标见表1。本研究经我院医学伦理委员会审批通过。

表1 HDMTX化疗患者的人口学统计资料及实验室指标Tab 1 Demographic data and biological characteristic of patients with chemotherapy of high-dose methotrexate
1.2 治疗过程和相关方案
1.2.1 HDMTX用药方案:每次化疗给予HDMTX 1.0~5.0 g/m2,溶于0.9%氯化钠注射液;先予总量1/10的负荷剂量,在0.5 h内快速静脉输注,剩余剂量在23.5 h内匀速静脉泵入。MTX输注必须在24 h内完成,未完成者在24 h时停止输注。
1.2.2 CF解救方案:MTX开始用药后第36 h(即MTX静脉滴注结束后第12 h)开始给予CF,首剂30 mg/m2,静脉注射;此后15 mg/m2,静脉注射或肌内注射,每6 h给药1次,共6~8次[5]。CF总解救剂量<10% MTX总剂量;解救次数和剂量根据MTX血药浓度进行调整,并持续至MTX血药浓度≤0.1 μmol/L,见表2。
1.2.3 化疗前后的支持治疗:化疗前检查血常规、肝肾功能

表2 根据MTX血药浓度的CF解救剂量Tab 2 Dosage of calcium folinate according to the blood concentration of methotrexate
注:MTX血药浓度>5 μmol/L时,按我院血液科经验性用药公式计算CF剂量,CF剂量(mg)=MTX血药浓度(μmol/L)×体质量(kg);同时,CF给药途径改为静脉滴注
Note:to calculate the CF dose according to empirical formula when the blood concentration of methotrexate >5 μmol/L, CF dose(mg)=the blood concentration of methotrexate (μmol/L) × body mass (kg); meanwhile, the administration route changed to intravenous drip
等,确认无化疗禁忌证。HDMTX用药前1 d及开始后3 d内给予充分的水化、碱化和利尿等支持治疗;每日补液量>3 000 ml,并告知患者尽量多饮水、多排尿;治疗前24 h开始口服碳酸氢钠片1.0 g,1日3次,别嘌呤醇片0.1 g,1日3次;治疗开始后3 d内,每日静脉滴注5%碳酸氢钠注射液200 ml,保持尿液pH≥7.0,记录出入量,保持尿量>3 000 ml/d。
1.3 血药浓度监测
于开始静脉滴注HDMTX后24、48、72和96 h时,取患者静脉血2 ml至不抗凝管,采用原理为酶扩大免疫分析法(enzyme multipliedimmunoassay technique,EMIT)的Viva-E药物浓度分析仪(德国Dade Behring公司)测定血清MTX浓度,检测下限为 0.01 μmol/L。根据MTX血药浓度调整监测次数,即血药浓度超出安全范围时,需持续检测至血药浓度<0.1 μmol/L。既往文献定义的MTX安全浓度范围为:开始给药后24 h时的血药浓度<10.0 μmol/L,开始给药后48 h时的血药浓度<1.0 μmol/L,开始给药后72 h时的血药浓度<0.2 μmol/L[6];但亦有研究结果表明,采用EMIT法测定时,开始给药后48 h时的血药浓度>1.16 μmol/L、开始给药后72 h时的血药浓度>0.22 μmol/L为排泄延迟[7]。本研究采用后者的数据。
1.4 不良反应观察
监测患者化疗前与化疗结束后的血常规、肝肾功能等生化指标,同时观察患者化疗后的其他临床症状或表现。不良反应评价标准参考美国国立癌症研究所的肿瘤化疗药物《通用不良事件术语标准》(CTCAE Version 4.0)以及世界卫生组织的《抗癌药物急性及亚急性毒性反应分级标准》。
1.5 统计学方法
采用Excel 2010、SPSS 17.0统计学软件处理数据。两组间数据比较,首先考察数据分布的正态性和方差齐性,两者均满足者采用t检验;正态分布但方差不齐,则采用t′检验;非正态分布数据采用非参数检验(Mann-Whitney检验);P<0.05为差异具有统计学意义。患者因素对排泄延迟的影响及不良反应发生率的比较采用χ2检验。
2 结果
2.1 不同时间点MTX血药浓度分布及药物排泄情况
开始静脉滴注HDMTX后24、48、72及96 h时的MTX血药浓度监测结果见表3。开始给药后48 h时,排泄延迟(MTX血药浓度>1.16 μmol/L)共18例次,占该时间点检测例次数的25.71%;开始给药后72 h时,排泄延迟(MTX血药浓度>0.22 μmol/L)共21例次,占该时间点检测例次数的30.00%。
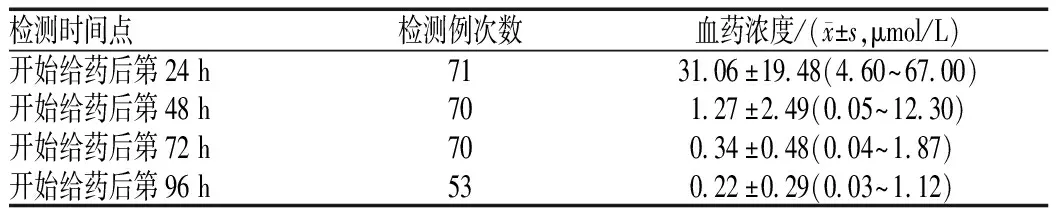
表3 不同时间点MTX血药浓度监测结果Tab 3 Results of monitoring on blood concentration of methotrexate at different time points
2.2 MTX排泄延迟的相关影响因素
与正常排泄患者比较,排泄延迟患者在开始给药后48、72 h时的MTX血药浓度明显升高,差异均有统计学意义(P<0.01);此外,MTX剂量、MTX体表面积剂量是开始给药后48、72 h时出现排泄延迟的显著影响因素,见表4。
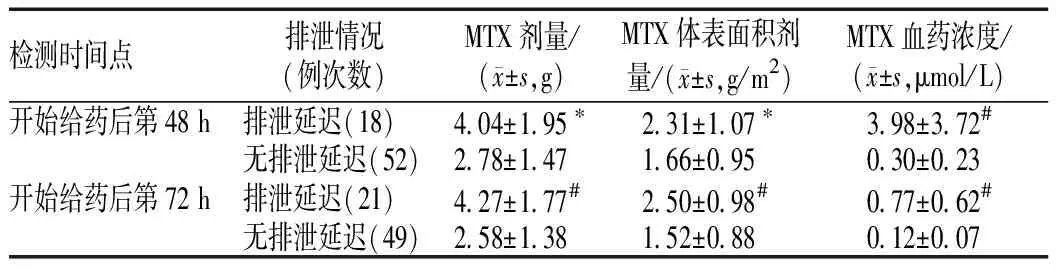
表4 MTX剂量、MTX体表面积剂量对不同时间点排泄延迟的影响Tab 4 Effects of dosage and body surface area dosage of methotrexate on delayed excretion at different time points
注:与无排泄延迟患者比较,*P<0.05,#P<0.01
Note: compared with normal excretion group,*P<0.05,#P<0.01
患者因素方面,性别对不同时间点的排泄延迟情况均无显著影响(P>0.05);但与≤60岁患者比较,老年患者(>60岁)在开始给药后72 h时更易出现排泄延迟(P=0.003);不同年龄患者开始给药后48 h时排泄情况的差异无统计学意义(P=0.094),见表5。
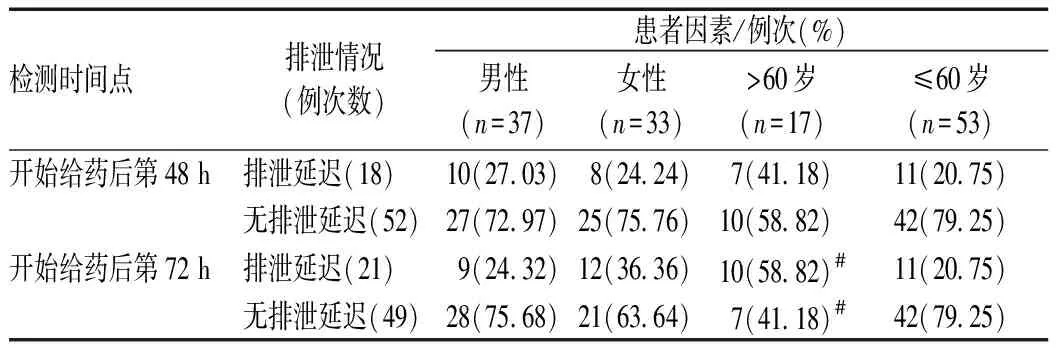
表5 患者因素对不同时间点排泄延迟的影响Tab 5 Effect of patient’s characteristics on delayed excretion at different time points
注:与≤60岁患者比较,#P<0.01
Note: compared with patients ≤60 years old,#P<0.01
2.3 不同时间点MTX排泄延迟对不良反应发生率的影响
71例次HDMTX化疗致不良反应合计139例次,感染性疾病发生率为49.30%(35例次),骨髓抑制发生率为61.97%(44例次),急性肾损伤发生率为5.63%(4例次),肝功能异常发生率为33.80%(24例次),黏膜炎发生率为19.72%(14例次),胃肠道反应发生率为25.35%(18例次)。其中,感染性疾病主要为呼吸道感染(24例次,占68.57%),其次为泌尿系统感染(5例次,占14.29%)、口腔真菌感染(3例次,占8.57%)、肠道感染(2例次,占5.71%)和皮肤软组织感染(1例次,占2.86%)。与正常排泄患者比较,开始给药后48 h时排泄延迟患者更易发生肝损伤(P=0.027);开始给药后48 h时排泄延迟患者的急性肾损伤发生率为16.67%,为正常排泄患者的8.7倍,但差异无统计学意义(P=0.083);排泄延迟对其他类型不良反应发生风险的影响不显著,见表6。
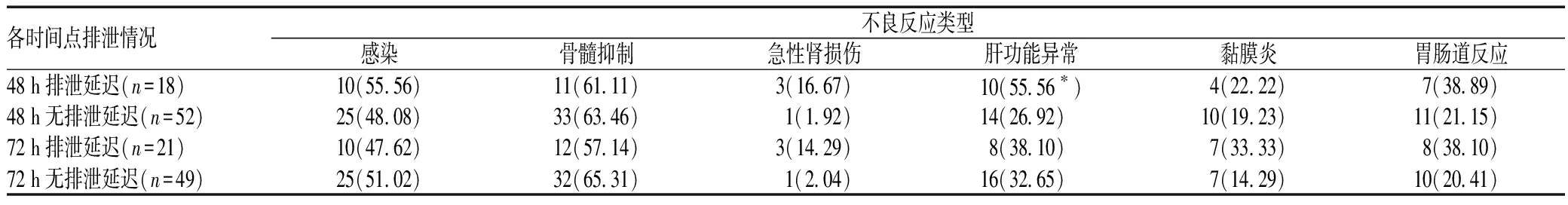
表6 MTX排泄延迟对各类型不良反应发生率的影响 [例次数(%)]Tab 6 Effect of delayed excretion on the incidences of various adverse drug reactions[case-times(%)]
注:与无排泄延迟患者比较,*P<0.05
Note: compared with normal excretion group,*P<0.05
3 讨论
MTX主要通过细胞膜上的还原型叶酸载体(reduced folate carrier,RFC)进入细胞内,当血药浓度明显升高时也可通过被动扩散方式转移至细胞内,因此,采用HDMTX化疗方案,可以克服因肿瘤细胞RFC数量降低或功能下调而产生的耐药性;此外,高剂量时亦可促进其活性代谢产物甲氨蝶呤多聚谷氨酸盐(methotrexate polyglutamate,MTXPG)的生成[8]。然而,HDMTX方案也会引起很多严重的不良反应,甚至威胁患者生命,因此,严密的血药浓度监测、合理的CF解救剂量和疗程以及充分的水化与碱化支持,是保护其他脏器、降低治疗风险的关键。本次治疗药物监测结果显示,开始给药后48、72 h时,MTX排泄延迟率分别为25.71%和30.00%。有文献报道,采用MTX 3或5 g/m2剂量化疗方案的排泄延迟发生率为26.2%~40.4%[9]。但本次调查中,MTX平均剂量低于上述文献,仅为(1.8±1.0) g/m2。
本研究结果显示,HDMTX体内排泄延迟的影响因素包括药物剂量、体表面积剂量以及患者年龄(>60岁),与童彤等[10]的研究结果一致。该研究对MTX血药浓度的影响因素进行多元线性回归分析发现,MTX剂量、患者年龄、体质量以及联合使用质子泵抑制剂均存在一定程度的影响,其中第1位因素为MTX剂量。老年患者更易出现排泄延迟的原因可能为该类人群均存在不同程度的肾功能降低,而肾功能不全会引起MTX肾脏清除率的降低及体内暴露量的增加。但是,MTX需要进行剂量调整的肌酐清除率折点至今尚未十分明确,折点上限约为50~60 ml/min,若肌酐清除率降低至10~30 ml/min时,应停止HDMTX治疗[1]。本次调查未发现不同性别患者的MTX排泄情况具有显著差异,与Zhang等[11]的报道相同。但该研究结果还显示,对于出现严重排泄延迟(开始给药后24 h时MTX血药浓度>20 μmol/L)的患者,男性与女性之间的差异具有统计学意义(0.37%vs.1.75%,P=0.024)。本调查中,由于严重排泄延迟的病例数较少,因此未做统计学分析,有待进一步扩大样本量后再做探讨。
本研究结果显示,HDMTX所致急性肾损伤的发生率为5.63%,与其他文献报道的发生率(5.56%~7.80%)相近[12-13];其中,开始给药后48 h时,排泄延迟患者急性肾损伤发生率为16.67%,非排泄延迟患者为1.92%,但两者间的差异无统计学意义(P>0.05)。亦有文献指出,肾毒性与MTX排泄延迟无关,即排泄延迟与非排泄延迟患者的肾损伤发生率相似[14]。
相对于类风湿性关节炎长期口服低剂量MTX的方案,血液系统恶性肿瘤采用HDMTX化疗引起肝纤维化、肝硬化等肝毒性的风险很低,但较多患者会出现氨基转移酶升高,这种肝功能异常通常是短暂且可逆的,无需调整后续化疗方案。本研究结果显示,肝损伤总发生率为33.80%,开始给药后48 h时排泄延迟患者的肝损伤发生率为55.56%,与李静等[15]报道的给药后42 h后排泄延迟患者的肝损伤发生率(55.1%)相近。但该研究未发现不同MTX血药浓度与肝损伤风险的相关性,而本研究结果则显示,开始给药后48 h时不同排泄状态患者肝损伤发生率的差异存在统计学意义(P<0.05)。王欣晨等[16]对56例骨肉瘤患者使用HDMTX的研究结果表明,开始给药后48 h时,肝损伤组、正常组患者MTX血药浓度分别为(2.90±0.78)、(0.44±0.34) μmol/L,两组的差异有统计学意义(P<0.05),提示开始给药后48 h时的MTX血药浓度对于预测肝损伤更具临床意义,与本研究结论一致。另有研究结果显示,血液肿瘤患者中多药耐药基因C3435T多态性可能增加了肝毒性发生风险[17]。故今后的研究可进一步探讨基因多态性与MTX排泄延迟、肝脏不良反应的相关性。本研究未能发现MTX排泄延迟对其他系统不良反应发生风险的影响,可能与研究样本量较小有关。

