B细胞调控动脉粥样硬化性卒中研究进展
邹钰钿 张艳林 曹勇军
自1986年Hansson等[1]在动脉粥样硬化斑块(以下简称粥样斑块)中检出淋巴细胞以来,免疫细胞对动脉粥样硬化和缺血性卒中的调控作用逐渐受到关注。尽管时至今日,淋巴细胞的具体作用机制仍未阐明,而且由于各项研究所采用的实验模型和操作方法存在的差异,使得许多研究结果或结论完全相悖,但淋巴细胞对粥样斑块的形成和缺血性卒中的影响已取得共识[2⁃3],尤其是对 B 淋巴细胞(以下简称B细胞)调控机制的研究日益增多。据研究显示,不同B细胞亚群通过在不同部位产生不同类型的免疫球蛋白或细胞因子,从而对疾病产生正性或者负性调节作用[4],因此,分析不同B细胞亚群在动脉粥样硬化形成和缺血性卒中发病过程中的作用,可以为明确其发病机制和治疗策略提供参考依据。
一、B细胞来源与功能
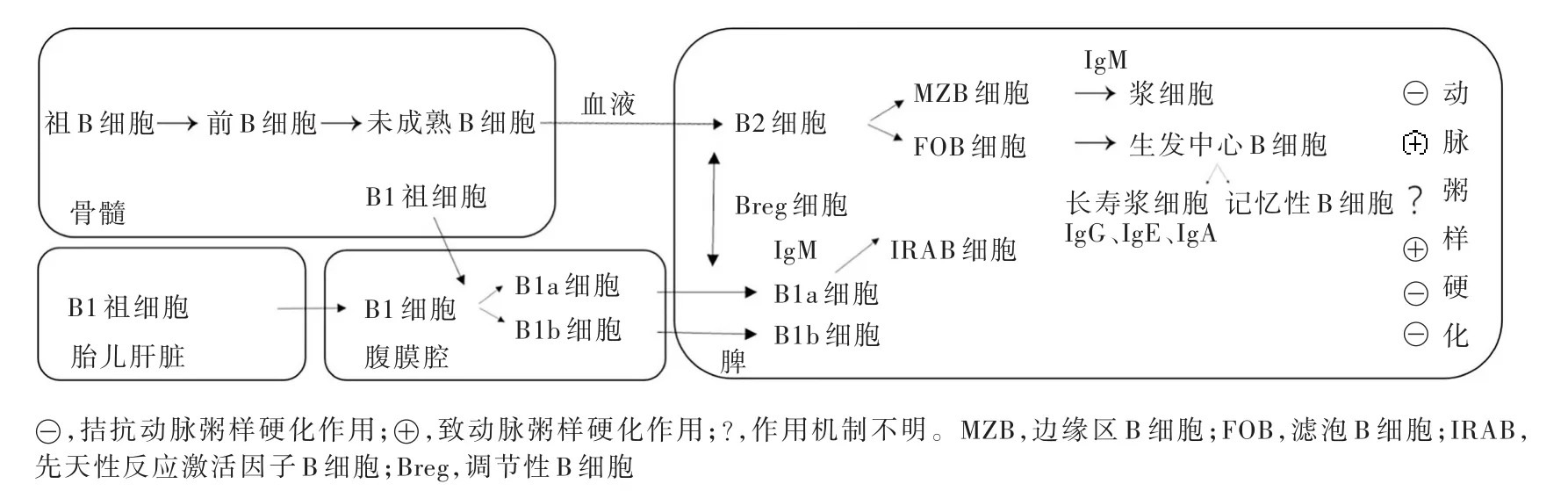
图1 B细胞亚群发育过程及其功能Figure 1 Development and function of B cell subsets.
1.B细胞发育过程与分布 人体内的B细胞大多来自骨髓,然后在脾或其他次级淋巴组织中生长、发育为完全成熟的感受态B细胞,并在抗原呈递细胞(APC)的辅助下,活化增殖形成生发中心,分化为记忆性B细胞或浆细胞,最终通过浆细胞分泌的特异性抗体参与机体免疫应答反应。根据Houtkamp等[5]早年对动脉粥样硬化患者粥样斑块的检测,B细胞主要存在于动脉第三淋巴器官,于动脉粥样硬化晚期浸润动脉外膜、产生局部免疫应答,且随着粥样斑块体积的增大,B细胞数目亦相应增加[6]。
2.B细胞亚群及其功能 B细胞可以分为B1和B2细胞谱系。其中,B1细胞主要来自胎儿的肝脏和骨髓前体,可进一步分为B1a和B1b亚群,无需感染或免疫诱导即可自发产生IgM,识别氧化修饰低密度脂蛋白(ox⁃LDL)、病原体,提供即时的抗原捕获,阻断巨噬细胞对ox⁃LDL的摄取、阻碍动脉粥样硬化进程,赋予保护作用。B1a细胞的主要功能为产生自发性IgM,但目前对B1b细胞的功能了解甚少[7]。有研究显示,衍生自B1a亚群的先天性反应激活因子B细胞(IRAB),通过产生粒细胞⁃巨噬细胞集落刺激因子(GM⁃CSF),从而促进动脉粥样硬化的发生与发展[8]。在成熟B细胞中,以B2细胞为主,后者可进一步分化为边缘区B细胞(MZB)和滤泡B细胞(FOB)。其中,边缘区B细胞由脾边缘窦所产生,可分化为主要分泌IgM的浆细胞,后者为先天性免疫细胞,目前的研究提示其具有动脉粥样硬化保护潜能,可抑制动脉粥样硬化的病理过程,呈负性调控作用[9];滤泡B细胞为外周血循环中的主要B2细胞群体,参与适应性免疫应答,通过接受抗原刺激与抗原特异性滤泡辅助性T细胞(Tfh)相结合,成为生发中心B细胞,然后分化为记忆性B细胞和长寿浆细胞[10]。目前尚无单纯针对滤泡B细胞的相关研究,但通过对B2细胞研究所获得的证据,可以间接证实该细胞具有致动脉粥样硬化作用。此外,B细胞还可通过分泌细胞因子而调节炎症反应,不过作为白细胞介素(IL)⁃10和35主要生产者的调节性B细胞(Breg)在粥样斑块形成过程中的作用尚存争议[11⁃12](图 1)。
二、B细胞调控动脉粥样硬化与缺血性卒中的机制
1.B细胞与动脉粥样硬化病变严重程度 动脉粥样硬化是以大动脉炎症反应为主要病变的慢性炎症性疾病,其主要病理改变为,聚集于动脉管壁上的低密度脂蛋白(LDL)经氧化成为ox⁃LDL,后者与氧化磷脂结合产生新的表位,即氧化特异性表位,先天性免疫细胞和适应性免疫细胞在识别新表位的过程中触发一系列免疫反应,使脂质进一步聚集[2]。关于全基因组关联和转录组数据的分析提示,B细胞参与动脉粥样硬化的形成过程,B细胞的活化和增殖是诱发缺血性脑血管病的重要危险因素[13]。最初的动物实验结果发现,接受全脾B细胞移植后,脾切除和载脂蛋白E(ApoE)敲除组小鼠(ApoE-/-)主动脉根部粥样斑块与假手术组小鼠相比明显缩小,提示B细胞对动脉粥样硬化具有保护作用[14];经铯射线致死剂量(9 Gy)照射的LDL受体(LDLR)敲除小鼠(Ldlr-/-)尾静脉注射B细胞缺陷型小鼠(μMT-/-)供体的骨髓后,与假手术组相比,主动脉近端和远端血管横截面斑块面积均显著增加[15]。B细胞是一种具有异质性的免疫细胞群体,对不同亚群B细胞基因敲除小鼠模型的研究均显示其同时兼具有促动脉粥样硬化或抗动脉粥样硬化的潜力[16]。近年针对不同B细胞亚群开展了一系列动物实验,深入探索B细胞调控动脉粥样硬化的机制。(1)B细胞生长因子增殖诱导配体(APRIL)过表达与粥样斑块体积无关,但在动脉粥样硬化病变进展至晚期时显示出潜在的稳定斑块的特征,推测可能与APRIL促进B1a细胞表达而提高ox⁃LDL特异性血清 IgM 水平有关[17]。(2)为确定 Toll样受体(TLR)是否在B1a细胞介导的动脉粥样硬化保护中起作用,选择性地将TLR2、TLR4、TLR9缺失或髓样分化主要反应88(MyD88)缺失的B1a细胞过继转移至脾切除导致B1a细胞缺失的ApoE-/-小鼠中,发现TLR4和MyD88可以通过提高外周血IgM水平而减弱动脉粥样硬化的病理损害,在减少凋亡细胞和坏死核心的同时,降低肿瘤坏死因子(TNF)、IL⁃1β和 IL⁃18 等炎性因子的表达水平[18]。(3)在 ApoE-/-动脉粥样硬化小鼠模型中,地塞米松可通过提高疾病相关抗原特异性B1细胞和调节性T细胞(Treg)数目而降低动脉粥样硬化的严重程度,并增加B1细胞表面 IL⁃10 的表达[19]。(4)抑制巨噬细胞 G12/13信号强度可以增强B1细胞亚群的功能,使模型小鼠动脉粥样硬化病情得以改善[20]。(5)对敲除唾液酸结合免疫球蛋白样凝集素G(Siglec⁃G)的动脉粥样硬化易感小鼠的观察结果发现,敲除Siglec⁃G的小鼠B1细胞IgM表达水平升高,其粥样斑块进程明显受到抑制[21]。(6)将 TLR调控因子 RP105(CD180)敲除的小鼠骨髓转移至Ldlr-/-模型小鼠,与转移野生型骨髓相比,通过下调B2细胞和IgG表达水平,抑制粥样斑块的形成,显示出由TLR途径介导的动脉粥样硬化的新方式[22]。(7)在高脂血症情况下,肠道共生菌特异性激活动脉粥样硬化小鼠B2细胞亚群,导致血管周围脂肪组织中的B2细胞募集,随后增加外周循环中的IgG,促进疾病发展[23]。(8)B 细胞表面TNF⁃α敲除的小鼠,比未敲除小鼠的动脉粥样硬化程度降低,由B2细胞产生的TNF⁃α具有促进主动脉和巨噬细胞表面TNF⁃α分泌的作用,进而使凋亡细胞和炎性因子 IL⁃1β和单核细胞趋化蛋白⁃1(MCP⁃1)表达水平升高、动脉粥样硬化病变进展以及粥样斑块破裂[24]。(9)ApoB100衍生肽 p210 和霍乱毒素 B 亚基(CTB⁃p210)脉冲B细胞可诱导膜结合转化生长因子⁃β(mTGF⁃β)和Treg细胞表达升高,使ApoE-/-小鼠动脉粥样硬化程度得到缓解[25]。(10)血管紧张素Ⅱ与B细胞活化因子(BAFF)协同作用具有诱导调节性B细胞(Breg)分泌IL⁃10的作用,使小鼠动脉粥样硬化炎症反应减弱[26](表 1,图 2)。

表1 B细胞和动脉粥样硬化相关动物实验Table 1. Animal studies on B cells and atherosclerosis
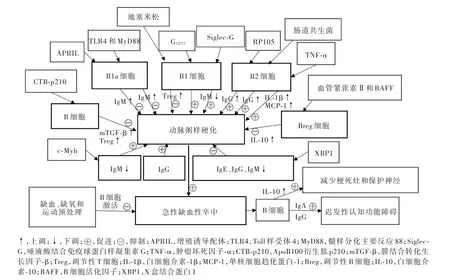
图2 B细胞对动脉粥样硬化和缺血性卒中的调控机制Figure 2 Regulation of B cells in atherosclerosis and ischemic stroke.
另有一些动物研究主要针对B细胞分泌抗体。例如,小鼠骨髓造血来源核转录因子c⁃Myb具有抑制B细胞分泌IgM的功能,降低ox⁃LDL特异性IgM表达水平,可使动脉粥样硬化炎症反应加剧[27];由ApoE-/-小鼠脾脏、淋巴结生发中心产生的IgG可促进动脉平滑肌细胞增殖,使动脉粥样硬化进一步恶化,但具有维持粥样斑块稳定的作用[28];对B细胞特异性X盒结合蛋白1(XBP⁃1)敲除小鼠的观察证实,XBP⁃1可减弱浆细胞产生抗体,使血清IgG、IgE和IgM表达水平降低,并使粥样斑块局部无抗体沉积,主动脉根部和弓部横截面斑块面积增大,促进病情进展[29](表1,图2)。除了对IgM和IgG的研究,IgE的潜在致动脉粥样硬化作用也日益得到认识,经IgE治疗后,动脉粥样硬化小鼠斑块区域的肥大细胞释放减少,而由肥大细胞释放的组胺则具有致动脉粥样硬化效应[30]。虽然IgA与人类小血管炎存在正相关关系,但IgA在动脉粥样硬化中的作用还有待进一步研究[16]。动脉粥样硬化机制的复杂性影响我们对其分子水平机制的了解,未来更精确地靶向不同功能的B细胞是重要的研究方向。
2.B细胞相关动脉粥样硬化性急性缺血性卒中及其预防 当粥样斑块进展并阻塞颅内大动脉血流时即可诱发缺血性卒中,其发生率在亚洲人、黑种人和西班牙裔人中较高,且明显高于白种人[31],而B细胞则可正性或负性调节动脉粥样硬化进程并影响疾病的发生与发展。一项针对心血管病的队列研究随机选择700例正常受试者进行为期15年的随访,其结果显示,CD19+CD40+B细胞可降低缺血性卒中的发生风险,这一作用与单核白细胞对IL⁃10的释放有关;反之,CD19+CD86+B细胞可使缺血性卒中事件的发生风险增加,与单核白细胞所释放的多种促炎性因子的释放增加有关[32]。业已证实缺血、缺氧、运动预处理能有效预防脑卒中,当实验动物或患者预先暴露于短暂的刺激环境中,可以诱使机体产生保护性炎症反应,减少梗死灶体积和血⁃脑屏障(BBB)的破坏,改善其神经功能和认知功能的恢复[33]。动物研究表明,缺氧预处理后12小时,外周循环中的B细胞数目即显著增加,并可以透过受损的血⁃脑屏障进入脑组织,诱导CXC型趋化因子配体12(CXCL12)表达水平升高,以增强抗炎症反应作用[34];此外,高海拔地区的人群长期暴露于低氧环境中,脑卒中风险较低海拔地区人群降低,而健康个体暴露于低氧环境4周后即可出现外周血B细胞相关性IgG、IgM和IgA表达水平的升高[35]。动物实验结果显示,强迫运动可使缺血性卒中模型大鼠梗死灶体积缩小,而自愿运动大鼠则运动功能获得明显改善,自愿运动可提高腹腔B1细胞含量,并使外周循环中的IgM表达水平随之相应升高[36]。而缺血预处理可上调缺血模型小鼠IL⁃1β表达水平,诱导B细胞激活和免疫球蛋白分泌[37]。
3.B细胞对急性缺血性卒中的保护作用及其不良反应 目前,有关B细胞在急性缺血性卒中恢复期的作用尚未达成共识。大脑中动脉闭塞(MCAO)动物实验结果显示,通过立体定向细胞递送方法,可避开血⁃脑屏障直接将B细胞植入B细胞缺陷模型(μMT-/-)小鼠之纹状体,移植治疗后大脑皮质梗死灶体积显著缩小,提示B细胞对急性缺血性卒中恢复期神经元损伤具有保护作用,可以作为急性缺血性卒中恢复期的新型免疫治疗剂[38]。此外,无论缺血之前或之后经尾静脉注射过继转移IL⁃10+B细胞,对防止梗死灶体积的扩大和预防神经性炎症反应均有效,表明IL⁃10分泌型B细胞是缺血性卒中的主要调节细胞类型[39⁃41]。与此同时,B 细胞亦参与缺血性损伤,有研究显示,急性缺血性卒中患者会发生B细胞对脑卒中的聚集反应,即在梗死区域聚集,产生IgA和IgG抗体,从而诱发痴呆[42]。目前,已有多种针对B细胞的自身免疫性疾病治疗药物经美国食品与药品管理局(FDA)批准上市,预示急性缺血性卒中患者的致病性B细胞免疫应答是可以治疗的[43](图2)。
4.B细胞在急性缺血性卒中预防与治疗中的临床价值 靶向B细胞亚群的B细胞耗竭疗法对动脉粥样硬化具有保护作用,目前最为常用的药物是针对B细胞特异性细胞表面分子(如CD20)和生存因子(如BAFF)的单克隆抗体。研究表明,通过尾静脉注射抗CD20特异性单克隆抗体,以优先耗竭ApoE-/-和Ldlr-/-模型小鼠体内的B2细胞,达到保留天然抗体IgM、延缓动脉粥样硬化进程的目的,有助于缺血性卒中的预防[44]。此外,根据BAFF受体缺失ApoE-模型小鼠的动脉粥样硬化保护作用,可考虑采用抗BAFF单克隆抗体,通过阻断其与受体结合,选择性耗竭致动脉粥样硬化性B2细胞,保留B1a细胞,在缺血性卒中的病理学过程中发挥预防性 保 护 作 用[45]。 目 前 Belimumab、Tabalumab 和Blisibimod等抗BAFF单克隆抗体已用于自身免疫性疾病和慢性淋巴细胞白血病的治疗,有助于启发B细胞治疗人类中枢神经系统疾病的探索[46]。值得注意的是,长期B细胞耗竭疗法可导致体液免疫缺陷,使感染性疾病和心脑血管病的发生风险增加。目前,人类用于治疗急性缺血性卒中的方案主要局限于重组组织型纤溶酶原激活物(rt⁃PA)静脉溶栓和机械取栓等血管内治疗,而由IL⁃10介导的Breg细胞免疫疗法是治疗急性缺血性卒中炎症反应的突破口。动物实验提示,于大脑中动脉缺血后24小时尾静脉注射Breg细胞,可使小鼠梗死灶体积缩小、神经功能改善,这一治疗时间窗超过rt⁃PA静脉溶栓治疗时间窗,提示Breg细胞对治疗急性缺血性卒中具有一定临床参考价值[47]。
三、展望
目前对于B细胞的功能和作用机制的研究正在进行中,我们对B细胞免疫调控动脉粥样硬化和缺血性卒中的理解也在进一步加深。B细胞的靶向治疗在实验性动物中取得了很大进展,临床上也已经用于其他免疫相关疾病的治疗。通过开展更多高质量临床试验,B细胞免疫治疗有望在未来为缺血性卒中提供更为精确和有效的治疗选择。
利益冲突无

