PD-L1及CD8+TIL在前庭神经鞘膜瘤中的表达及意义
尹晓玲 火子榕 严爽 张治华
1上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科(上海200029)
2上海交通大学医学院耳科学研究所(上海200029)
3上海市耳鼻疾病转化医学重点实验室(上海200029)
前庭神经鞘膜瘤(Vestibular schwannoma,VS)是内听道及桥小脑角最为常见的良性肿瘤(约占80~90%),瘤体增大压迫颅内重要血管、神经及小脑、脑干导致耳聋、耳鸣、眩晕,严重者更可出现颅高压、偏瘫,甚至威胁生命[1,2](图1)。绝大多数VS为散发性(约95%),小部分属于神经纤维瘤病Ⅱ型(Neurofibromatosis type2,NF2),后者以双侧VS为典型特征,手术切除是主要治疗手段,但同时也易造成颅神经及颅内重要血管的不可逆损伤,导致面瘫、听力丧失等并发症,严重影响患者生活质量,对于生物学行为多变的部分听神经瘤患者(如立体定向放射治疗后复发者、手术不耐受患者等)行手术治疗风险较大[3],因此对听神经瘤非侵入性治疗的研究具有重要意义。
近年来作为肿瘤免疫治疗新靶点的程序性死亡蛋白-1(PD-1)通路抑制剂引起了广泛关注。作为免疫检查点家族的成员,T细胞上的PD-1能与肿瘤细胞上程序性死亡蛋白配体-1(PD-L1)相结合抑制T细胞免疫反应并帮助肿瘤细胞实现免疫逃逸[4,5]。大量研究已证实PD-L1的高表达与多种肿瘤的预后不良密切相关[6]。使用PD-1和PD-L1抑制剂,可下调对T细胞的抑制性作用,使T细胞重获免疫杀伤功能,目前FDA批准抗PD1和抗PD-L1抗体治疗药物用于越来越多的癌症,包括结肠癌、直肠癌,膀胱癌,头颈部鳞状细胞癌,霍奇金淋巴瘤和黑色素瘤等[7]。PD-1/PD-L1表达在前庭神经鞘膜瘤发生发展方面研究相对较少。最近的研究已经证实,与正常颅神经组织相比,散发性VS组织中的促炎症细胞因子如白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)以及白细胞粘附分子(ALCAM)表达均上调[8],de Vries M[10]等证实在快速生长的散发性VS中M2型巨噬细胞和微血管密度显着升高,肿瘤巨噬细胞的表达与肿瘤大小和肿瘤生长指数呈显著正相关,巨噬细胞集落刺激因子(M-CS)及IL-34(可调节肿瘤浸润巨噬细胞的细胞因子)在散发性VS中均有表达,且在生长迅速及发生囊性变的VS中表达更高[9],这些观察结果共同暗示T细胞介导的免疫反应在散发性VS的肿瘤免疫微环境中起重要作用,免疫检查点抑制剂可能是靶向治疗VS的新策略,本次研究我们通过免疫组织化学染色阐明了PD-L1在散发性VS组织中的蛋白表达,通过评估CD8+肿瘤浸润性淋巴细胞(Tumor infiltrating lymphocyte,TIL)表达密度,进一步探究散发性VS的CD8+TIL相关的肿瘤免疫微环境。
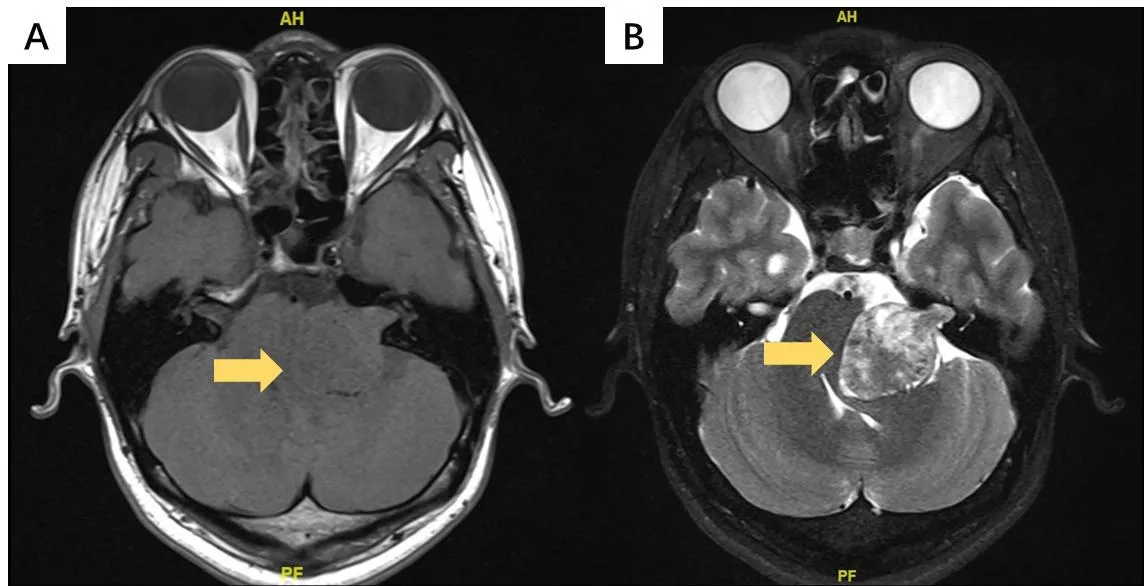
图1 典型前庭神经鞘膜瘤影像学资料。A:T1加权像水平位示混杂低密度影;B:T2加权像水平位示多灶高密度影。Fig.1 Imaging data of typical vestibular schwannomas.A:T1 weighted image horizontal position shows mixed low density shadow;B:T2 weighted image horizontal position shows multi-focal high density shadow
1 材料与方法
1.1 病例收集
收集2018年11月至2019年4月于上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科手术治疗的散发性VS患者15例,排除神经纤维瘤病Ⅱ型、立体定向放射治疗或手术治疗后复发患者,所有患者临床诊断均依据内听道增强MRI中的特征性表现,术后常规病理结果为最终确诊依据。所有标本均取自手术切除5分钟之内的新鲜肿瘤组织,取下后肿瘤组织分别置于盛有4%多聚甲醛的EP管中固定。
1.2 免疫组织化学技术
取经4%多聚甲醛固定后的肿瘤样本进行石蜡包埋,分别切片,厚度为5μm。石蜡切片经二甲苯、梯度乙醇脱蜡水化。对切片用0.01mol/L柠檬酸缓冲液进行经抗原修复后使用免疫组化试剂盒(武汉赛维尔生物技术有限公司)进行实验,CD8、及PD-L1(SP142)抗体均购自上海爱博抗生物公司,并按照1:50比例稀释,4℃孵育过夜,PBS清洗后滴加生物素标记的二抗(浓度为1:100),37℃孵育30分钟,DAB显色15min,自来水冲洗,苏木素复染,二甲苯透明树脂封片,光镜下观察、拍照。目前PD-L1在前庭神经鞘膜瘤中的阳性阈值及判读方法尚未明确,综合各文献的研究方法[10,11],细胞膜或胞质阳性表达率<5%为阴性表达,>5%且≤20%为低表达,>20%为高表达,每张切片随机选取5个高倍视野(high power field,HPF)。排除不在肿瘤背景中出现的免疫阳性细胞(例如血管周围出血区域)或假阳性表达的区域。对于CD8淋巴细胞,随机选择5个HPF,计算CD8阳性个数绝对值[12]。
1.3 统计学方法
采用SPSS23.0统计软件,连续型变量用均值±标准差表示,分类变量用频数(%)表示,连续型正态分布变量采用Fisher精确概率检验,非参数检验按实际情况采用卡方检验或Fisher确切概率法。采用单因素方差分析方法逐一将各临床特征及CD8阳性细胞个数与PD-L1表达,相关性分析探究临床资料与组织标本检测结果之间关系,以P<0.05表示结果具有统计学意义。
2 结果
2.1 一般临床资料
纳入研究的15例患者中,男性7例(46.7.0%),女性8例(53.3%)。年龄28~62岁,平均年龄(44.3±10.9)岁。所有患者临床诊断均依据内耳道增强MRI特征性表现,术中病理结果为最终确诊依据。肿瘤大小以影像学桥小脑角区域最大直径表示,本研究根据吴皓等[13]听神经瘤分级标准,将肿瘤分为5级。15例患者肿瘤直径7.0~36.0mm,平均(17.3±7.5)mm。全部患者术前常规行听力学检查,包括声导抗、纯音听力测定及言语识别率等,听力水平根据美国耳鼻咽喉头颈外科学会(American Academy of Otolaryngology Head and Neck Surgery,AAOHNS)标准进行分级[14]。术前听力水平A~D级者分别为3例(20%)、6例(40%)、5例(33.3%)和1例(16.7%)。面神经功能评估采用House Brackmann(HB)分级,囊性听神经瘤2例(13.3%)(见表1)。
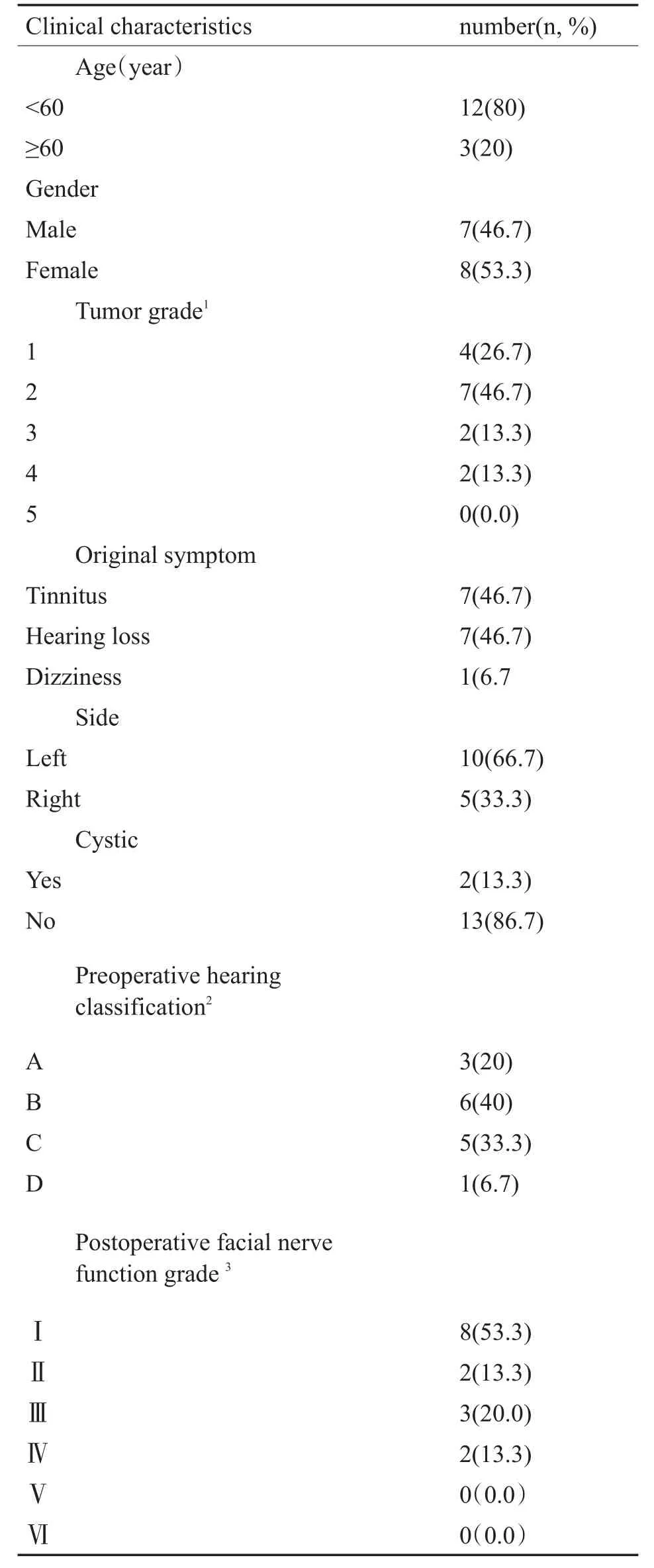
表1 患者基本资料总结Table 1 Patient characteristics
2.2 PD-L1表达与临床特征及CD8+细胞个数的相关性
肿瘤细胞膜上的PD-L1表达已被认为是与抗PD-1/抗PD-L1检查点抑制剂治疗相关的预测标志物[15]。PD-L1主要表达在肿瘤细胞及其间质淋巴细胞的细胞膜与细胞质上,PD-L1膜染色阳性率>5%定义为阳性表达,>5%且≤20%为低表达,>20%为高表达,基于形态学鉴定肿瘤细胞,我们发现在14例(93.3%)的散发性VS组织切片中观察到阳性表达,其中7例(46.7%)为高表达(图2),这些数据表明PD-L1在散发性VS中特异性表达。研究证明具有CD8淋巴细胞浸润的肿瘤细胞对免疫检查点抑制剂的治疗有较好的反馈[16]。我们在15例(100%)的散发性VS样本中CD8均呈现阳性表达,CD8+细胞个数与PD-L1表达具有统计学差异(P<0.05)。进一步分析PD-L1表达与各临床特征包括年龄、性别、肿瘤大小分级、首发症状、侧别、囊性变、术前听力分级及术后面神经功能都无统计学差异(P>0.05)(表2)。
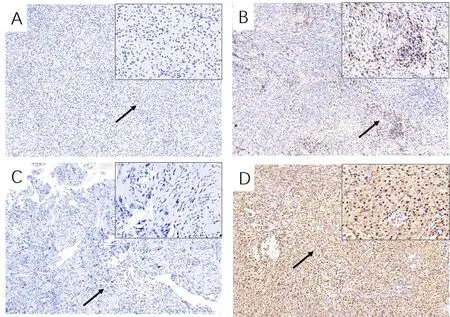
图2 光镜下前庭神经鞘膜瘤组织中PD-L1及CD8淋巴细胞表达,免疫组化(低倍镜×100及高倍镜×400)。A~B分别为CD8淋巴细胞在前庭神经鞘膜瘤中阴性表达及阳性表达;C~D分别为PD-L1的阴性表达及阳性表达。Fig.2 PD-L1 and CD8 lymphocyte expression in vestibular schwannomas under light microscopy,immunohistochemistry(× 100 and × 400).A~B was negatively expressed and positively expressed in vestibular schwannoma respectively;C~D was negative expression and positive expression of PD-L1 respectively.
2.3 PD-L1表达与CD8+淋巴细胞的相关性
我们发现在散发性VS组织切片中PD-L1阳性表达和CD8+TIL密度之间皮尔逊相关系数为0.82,存在显著正相关,PD-L1阳性肿瘤中CD8+细胞浸润水平较PD-L1表达阴性的组织高(表3)。该结果更进一步阐明了细胞介导的适应性免疫反应在散发性VS的肿瘤免疫微环境中起重要作用。

表2 PD-L1表达与临床特征及CD8+个数相关性Table 2 The correlation of PD-L1 expression with clinical characteristic and CD8+number
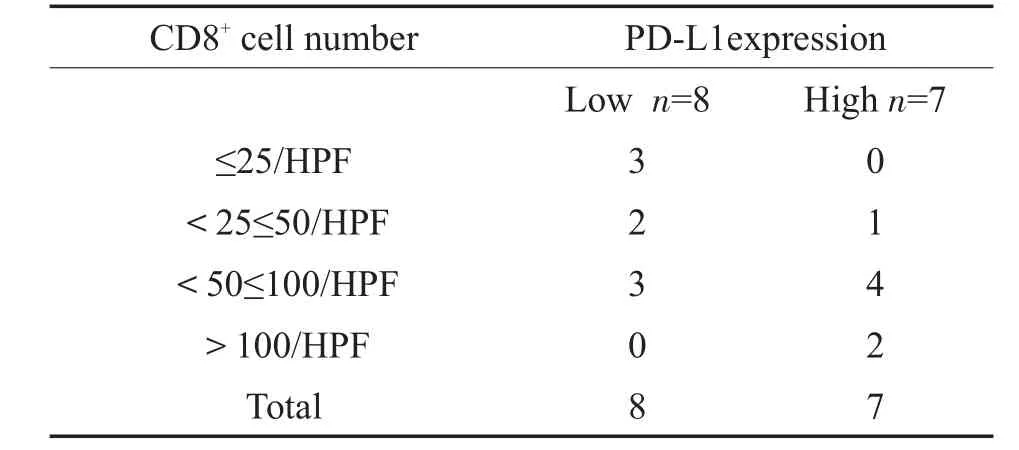
表3 CD8+淋巴细胞密度与PD-L1表达的相关性Table 3 Correlation analysis between CD8+lymphocyte density and PD-L1 expression
3 讨论
免疫系统具有免疫监视、防御、调控的作用,而免疫逃逸是指通过降低肿瘤细胞的免疫原性或通过改变随后的炎症反应来促进肿瘤细胞存活[17]。参与免疫编辑的一类蛋白质如B7-H1、B7-H1是PD-1的配体,PD-1是在T细胞和B细胞上表达的Ig超家族的跨膜受体[18]。在既往的研究中,Archibald DJ[18]等通过在其收集的48个散发性前庭神经鞘膜瘤组织中发现81%样本B7-H1表达阳性,且在立体定向放射治疗失败后通过手术切除的肿瘤中呈现较高表达,提示免疫逃避可能在散发性VS的持续生长中起一定作用。免疫检查点PD-L1/PD-1轴的阻断可以重新激活CD8+细胞毒性T细胞以识别和消除肿瘤细胞。Shiyang Wang[19]等人检测了NF1相关肿瘤(10例皮肤和6例神经纤维瘤)和NF2相关肿瘤(10例脑膜瘤和10例神经鞘膜瘤)组织中 PD-L1(克隆SP142和E1L3N),CD3,CD20,CD8和CD68的表达,研究结果表明,细胞免疫在NF1和NF2相关肿瘤的肿瘤免疫微环境中起主要作用,PD-L1在肿瘤细胞上的表达和TIL的存在表明这些肿瘤可能对免疫检查点抑制剂的免疫治疗有反应。
TIL是一类浸润到肿瘤细胞中的淋巴细胞,包括B细胞、T细胞、NK细胞等具有特异性杀伤肿瘤功能的细胞。CD8+T淋巴细胞,又称为细胞毒T细胞,在机体识别抗原后能够对带有相应抗原的细胞发挥特异性杀伤作用,是机体发挥肿瘤免疫作用的主要成分[20]。多项研究表明肿瘤浸润性CD8+T细胞的数量越多,患者使用PD-L1抗体的治疗反应的预测性更好[21,22]。这意味着PD-L1在肿瘤组织中的预测作用在有激活的T细胞反应情况下更可信。
在本研究中,我们研究了散发性VS肿瘤中PD-L1及CD8+TIL的表达,且PD-L1表达与CD8+TIL表达呈正相关。尽管PD-L1较多报道在恶性肿瘤中呈现高表达,散发性VS作为良性肿瘤,也高表达PD-L1,这一发现也提示我们PD-L1可能参与调节该肿瘤的免疫逃逸,该肿瘤可能对免疫检查点抑制剂的免疫治疗有反应,在未来临床试验中可进一步探索。本研究目前主要分析讨论PD-L1在散发性VS组织中的高表达及与TIL的表达关系,这一结果提示散发性VS患者可能对免疫检查点抑制剂的免疫治疗有反应,由于正常前庭神经组织较难获取,今后还会完善相关伦理工作增加正常对照组研究,并扩大肿瘤组织样本量进一步分析,也为今后指导药物治疗散发性前庭神经鞘膜瘤提供更大价值。

