基于锰矿石载氧体的宁东煤化学链燃烧特性
梁文政, 王 坤, 赵荣洋, 苑仕瑞, 王翠苹,
(1.青岛大学 机电工程学院,山东 青岛 266071;2.山东科技大学 土木工程与建筑学院,山东 青岛 266590)
化学链燃烧(Chemical looping combustion,CLC)是一种新型燃烧技术,其反应机理与反应过程的研究始终备受关注[1]。研究发现[2],CLC技术减少了燃烧中无序混合带来的冮损失,具有提高热力系统效率的潜力;且CLC可实现能量的分级利用,因此,该清洁高效的燃烧方式[3]近期成为研究热点。CLC中载氧体(通常为金属氧化物MeOα)在燃料反应器与空气反应器之间循环,传递反应所需要的晶格氧与热功率,因空气与燃料分隔而达到CO2易于分离捕集的目的[4-5],其循环过程如图1所示。发展至今,化学链技术的研究已经由气体燃料燃烧、重整拓展到了固体燃料、液体燃料的燃烧、气化、重整,甚至制氧、制氢等领域。

图1 煤化学链燃烧循环原理图Fig. 1 Schematic diagram of coal CLC cycleAR—Air reactor; FR—Fuel reactor
煤的化学链燃烧/气化具有低NOx排放和CO2内分离的固有特性。研究表明[5],煤的化学链燃烧主要包含4个反应过程:煤的热解过程、载氧体与热解气反应过程、煤焦气化过程、载氧体与煤气化气的反应过程。因此,煤的化学链转化过程更为复杂,对载氧体的要求更为严格。载氧体(Oxygen carriers,OC)为CLC技术的核心要素,其性能与价格决定了CLC可行性。目前,人工制备的常用载氧体为金属氧化物载氧体,其活性组分主要为Fe、Mn、Ni、Cu等金属的氧化物,惰性载体包括Al2O3、SiO2、TiO2、ZrO2、MgAl2O4等[6-11]。其中Mn基载氧体活性较高、具有较好的抗高温能力、较高的活性和载氧量,且价格相对低廉,是一种很有潜力的载氧体[12]。
相对于人工制备载氧体的昂贵价格,天然矿石载氧体更具经济优势。目前,对矿石载氧体的研究主要集中在其反应活性及机械强度上。在锰矿石载氧体的研究中,Frohn等[13]和Arjmand等[14-15]均发现锰矿石可催化煤气化过程,且不受H2的抑制影响,对比钛铁矿锰矿石展现出了更好的焦炭气化率。Fossdal等[16]发现,锰矿石与H2和CH4间的反应速率比其他矿石更高。而Sundqvist等[17-18]对比多种锰矿石发现,不同锰矿石与燃料气均呈现高反应性,说明锰矿石普遍具有高活性,因此认为锰矿石作为载氧体在流化床CLC工艺中具有很高的应用价值。但是,在实际循环实验中,Leion等[18-19]发现锰矿石的机械稳定性和流化性能较差。但也有学者[20]认为锰矿石的机械稳定性和反应活性可能与其自身的组成和性质有关,因而需要优选适宜的锰矿石作为载氧体。
为探究锰矿石与煤粉化学链燃烧的反应活性与反应特性,笔者以中国耒阳天然锰矿石为载氧体,以宁东煤为燃料,在小型流化床系统上进行了煤化学链气化/燃烧实验;结合热化学分析软件(HSC)计算该反应的热力学参数与产物组成分布,考察锰矿石载氧体与煤反应产物的变化规律、优化反应参数;并采用修正反应动力学模型对该反应系统进行热-质衡算,优化该实验规模的燃料反应器(FR)与空气反应器(AR)的系统工况,探究该系统自热平衡的可能性。
1 实验部分
1.1 实验物料
实验用煤选用宁东煤,粉碎筛分至粒径 0.2~0.5 mm 的煤粉备用,其元素分析与工业分析数据如表1。

表1 宁东煤的元素分析及工业分析Table 1 Composition analysis of the Ningdong coal
锰矿石为大吉锰业公司提供的天然锰矿石,其中氧化锰质量分数40%,先粉碎筛分至粒径 0.1~0.3 mm 的颗粒,于马弗炉中1173.15 K空气氛围下煅烧4 h,然后再次筛分至粒径 0.1~0.3 mm,获得成品锰矿石载氧体颗粒。使用荷兰帕纳科Panalytical Axios顺序式波长色散型X射线荧光光谱仪对煅烧后锰矿石进行组成分析,结果如表2所示。

表2 煅烧锰矿石成分质量组成Table 2 Composition data of the calcined manganese ore w/%
由表2可以看出,煅烧后天然锰矿石的主要活性组分为Mn3O4、Fe2O3,惰性载体的组分为SiO2、Al2O3,还有少量的碱金属氧化物(K2O、CaO、MgO)。结合文献[12]可以确定,载氧体的主要反应体系为Mn3O4/MnO与Fe2O3/Fe3O4。
石英砂,自取,筛分粒径为0.1~0.3 mm,与锰矿石共同组成流化床床料,起到蓄热作用。蒸馏水,自制,作为蒸汽发生源,蒸汽产生流量为1 g/min。
1.2 反应方程式
锰矿石载氧体与煤粉的化学链燃烧过程可能发生的反应过程如式(1)~(8)所示,其中载氧体与煤粉的总反应式为式(1),Me代表了锰矿石中的金属(锰、铁等)。通过HSC分步模拟计算,进而可分为3个主要反应过程:煤气化过程(式(2)~(5)),载氧体与煤合成气反应过程(式(6)~(7)),载氧体氧化再生过程(式(8)),各方程式所涉及热力学参数将在后文展示。
CnH2m+(2n+m)MexOy=
nCO2+mH2O+(2n+m)MexOy-1
(1)
C+H2O=H2+CO
(2)
C+CO2=2CO
(3)
1/2C+MexOy=MexOy-1+1/2CO2
(4)
C+MexOy=MexOy-1+CO
(5)
CO+MexOy=MexOy-1+CO2
(6)
H2+MexOy=MexOy-1+H2O
(7)
MexOy-1+1/2O2=MexOy
(8)
1.3 鼓泡流化床实验
鼓泡流化床实验系统如图2所示。该实验装置包括流化床反应器、温控装置、进气装置、水蒸气发生器、过滤装置、冷凝装置、气体分析仪。流化床装置由耐高温的钢管制作,其内径为32 mm,高度800 mm;布风板位于距反应器底部100 mm处,孔径为1.5 mm;采用外部电加热套管进行加热,温控仪进行内部温度控制;对于进气装置,所需气体(Air、N2)流量由浮子流量计进行控制。

图2 鼓泡流化床FR/AR实验系统图Fig.2 FR/AR experiment system diagram of bubbling fluidized bed reactor
实验中,煤粉质量均为0.1 g,待炉膛达到预定温度1173.15 K时,通过炉膛上部的漏斗加入载氧体,并保持通入2 L/min空气流化15 min,以保证载氧体达到反应温度且处于充分氧化状态,后通过调节流量计关闭空气,切换为N2载气吹扫炉膛5 min;煤气化反应所需水蒸气由蒸汽发生器产生,通过载气带入炉膛。气化燃烧结束后,切换为空气,进行载氧体循环,即FR/AR的连续切换。实验分为以惰性石英砂为床料空白对照组1和以煅烧锰矿石载氧体混合床料的实验组2(载氧体初始加入量为2 g,之后以2 g/次递增,共5个工况,第5次实验载氧体为10 g),采用烟气分析仪(英国凯恩,KANE 9506型)对炉膛出口气体进行在线检测。
1.4 HSC模拟
采用HSC Chemistry 6.0软件的Reaction equations模块对实验中所涉及的反应进行相关热力学参数计算,用Equilibrium compositions模块对锰矿石载氧体化学链气化/燃烧反应产物进行模拟计算,并与实验所获的数据对比,判断模拟结果的准确性,从而为后续的热平衡计算提供合理的计算模型基础。
HSC的计算遵循最小吉布斯自由能原理:即当系统处于平衡时,系统的吉布斯自由能最小,由此可以确定系统内稳定的相、各相的组成及各相的相对量,从而可以预测并计算可能的生成产物。
1.5 数据处理方法
煤粉完全燃烧需氧量(nO2-coal,mol)、煅烧锰矿石理论释氧量(nO2-OC,mol)由式(9)~(11)计算:
VAir-coal=0.0889×(wC+0.375×wS)+
0.265×wH-0.0333×wO
(9)
(10)
(11)
其中:VAir-coal为燃烧需理论空气量,m3/kg;wi为i元素或组分(i为C、S、H、O、Mn3O4、Fe2O3)的质量分数,%;moc为载氧体质量,g;M为对应氧化物的摩尔质量,g/mol。
在化学链燃烧实验中,鼓泡流化床出口气体中各组分生成总量(Qi,mg)计算公式为:

(12)
其中:FN2为载气流量,m3/s;q(i,t)为i气体(i=CO、H2、CO2等)在t时刻的质量浓度,mg/m3;t0为反应开始时间,s。则该时间段内i气体对应煤中元素的转化率(αi,%)为:
(13)
其中:Mi为i气体摩尔质量,g/mol;Mi-ele为煤中对应元素摩尔质量,g/mol;mcoal为煤粉质量,g;wi-ele为煤粉中对应元素质量分数,%。元素转化率主要用以计算煤中对应元素C转化成CO、CO2等气体的效率,用以判断反应特性并进行元素平衡计算。
2 结果与讨论
2.1 化学反应HSC模拟结果
以Mn3O4作为载氧体主要活性组分,AR、FR中主要化学反应(式(2)~(8))的平衡常数对数(lgk)随温度的变化及其在900 ℃下反应热如图3所示。由图3(a)可知,在模拟温度1125~1225 K下,各反应平衡常数的对数值均大于零,表明在此温度区间各反应较为彻底,均为有效反应。在固定碳的气化路径中,C与H2O反应及C与CO2反应(式(2)和式(3))的lgk非常接近,表明C与2种气化剂的反应程度相似。相似现象也发生在Mn3O4的2个还原反应(4)和(5)中。C与Mn3O4理论上可彻底反应,但是鉴于固-固反应的反应速率较小,其对整个化学链过程的影响远低于气-固和气-气反应。图3(b)显示,在FR中,除载氧体还原反应(式(6)~(7))外,其他反应(式(2)~(5))以吸热(正值)为主;在AR中,载氧体再生反应为放热(负值)反应(式(8))。为实现载氧体从FR到AR循环过程的热功率平衡,需要进行反应系统的热功率、质量衡算,包括砂子等载体用量的计算。

图3 AR、FR中各主要反应的反应常数随温度变化及其1173.15 K时的反应热Fig.3 The equilibrium constants of main reactions in AR and FR and chemical reaction heats at 1173.15 K(a) lg k; (b) Chemical reaction heat at 1173.15 K (2) C+H2O=H2+CO; (3) C+CO2=2CO; (4) C+2Mn3O4=6MnO+CO2; (5) C+Mn3O4=3MnO+CO; (6) CO+Mn3O4=3MnO+CO2;(7) H2+Mn3O4=3MnO+H2O; (8) MnO+1/6O2=2Mn3O4
2.2 载氧体/煤粉质量比对化学链反应的影响
分析两组实验的6种工况,实验组2每次实验递增2 g载氧体;通过式(9)~(11)计算得知,2 g载氧体的供氧能力(含氧量)为0.0064 mol。根据流化床反应器出口CO、CO2质量浓度,通过式(12)~(13)可计算固定碳的转化率,用以判断煤粉气化/燃烧情况,结果如图4。由图4可以看出,实验组2和对照组1的反应过程都分为2个阶段:第一阶段,煤粉被载氧体和石英砂加热而迅速升温,大量的CO、CO2来自于煤的挥发分和煤的热裂解(约前90 s内);第二阶段,煤焦的气化反应阶段(图4(a))。由于载氧体与部分CO接触反应生成CO2,煤热解阶段CO峰值下降,煤气化阶段CO整体质量浓度降低(图4(b))。此外,图4(c)显示,随着载氧体添加量的增加,C转化率有所降低,CO生成率降低,CO2生成率增高,表明锰矿石载氧体与CO具有良好的反应特性;同时煤样完全反应所需时间也不断减少(图4(b)反应终点),说明煅烧锰矿石载氧体具有催化、加速煤气化的作用。
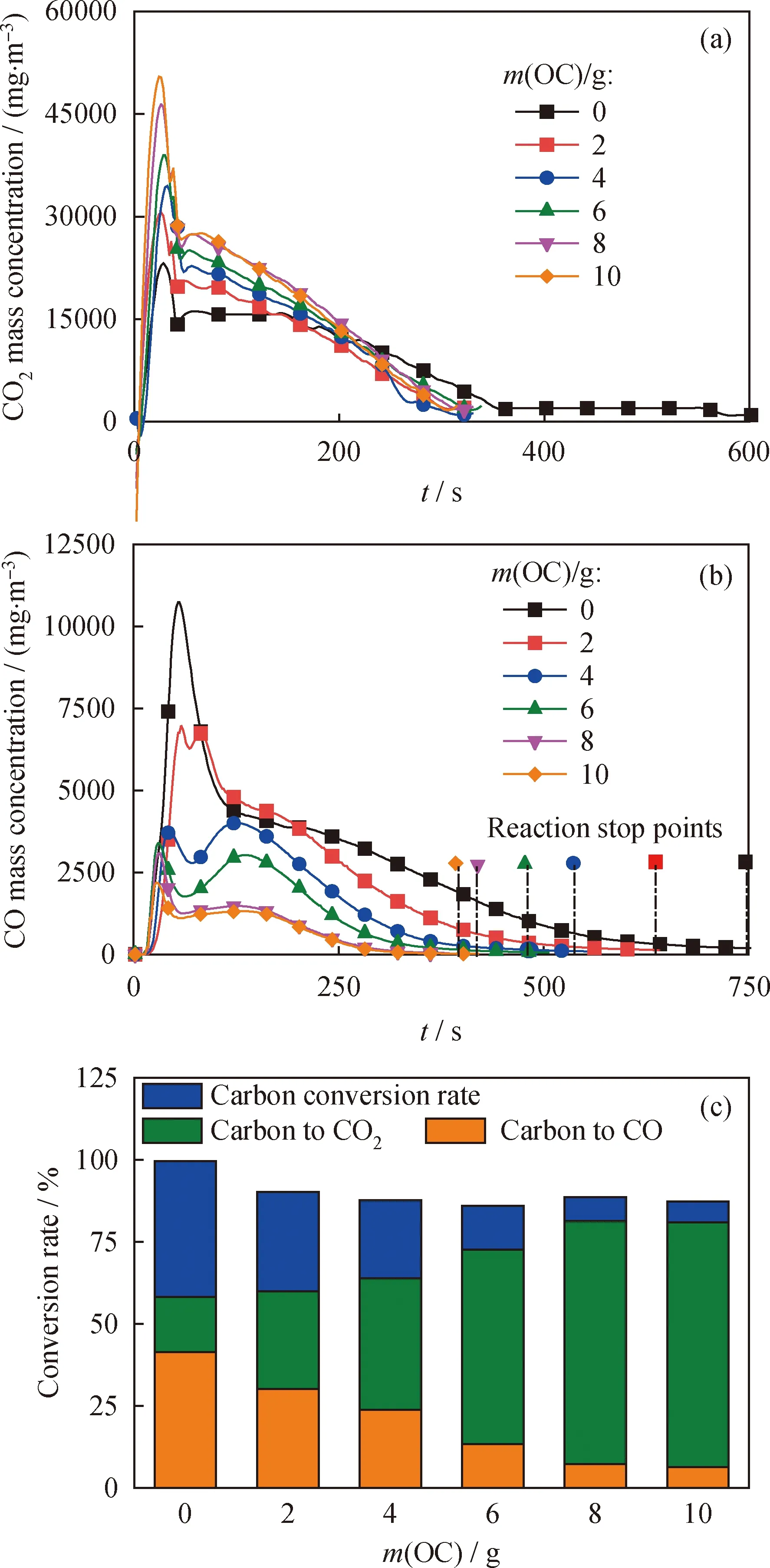
图4 载氧体用量对化学链反应的影响Fig.4 Effects of OC mass on chemical looping reaction(a) Mass concentration of CO2; (b) Mass concentration of CO;(c) Conversion rate of carbon OC—Oxygen carrier
图5为FR出口各气体体积的实验测试数据与模拟计算数据的比较。由图5可知,随着载氧体质量逐步增加,可燃气体组分的产量逐步减少,其中以H2产量减少最明显和快速,表明煅烧锰矿石载氧体与H2明显发生了反应。HSC equilibrium compositions对于出口气体中各气体组分体积的模拟结果与实验结果基本上一致,二者间的差值随载氧体加量的增加先扩大后减小,并趋于一个较小的固定值。如:计算和实验的CO2数值差在0 g载氧体时为0.004 L,6 g载氧体时最大0.032 L,8 g载氧体之后稳定在0.024 L;其他气体也有相同变化趋势。造成这一现象的原因是煤粉颗粒与载氧体颗粒之间存在密度差异,在输送中发生分层;且流化反应中煤粉颗粒不断破碎,也导致二者分层,从而造成载氧体颗粒与煤气化组分不能充分接触,出现了H2、CO和CH4体积的实验结果略高于模拟结果,而CO2体积的实验结果略低于模拟结果,但其差值均为可接受误差。因此,该计算模型的模拟结果有效,且实验结果准确,可为热-质平衡计算提供可靠数据支持。
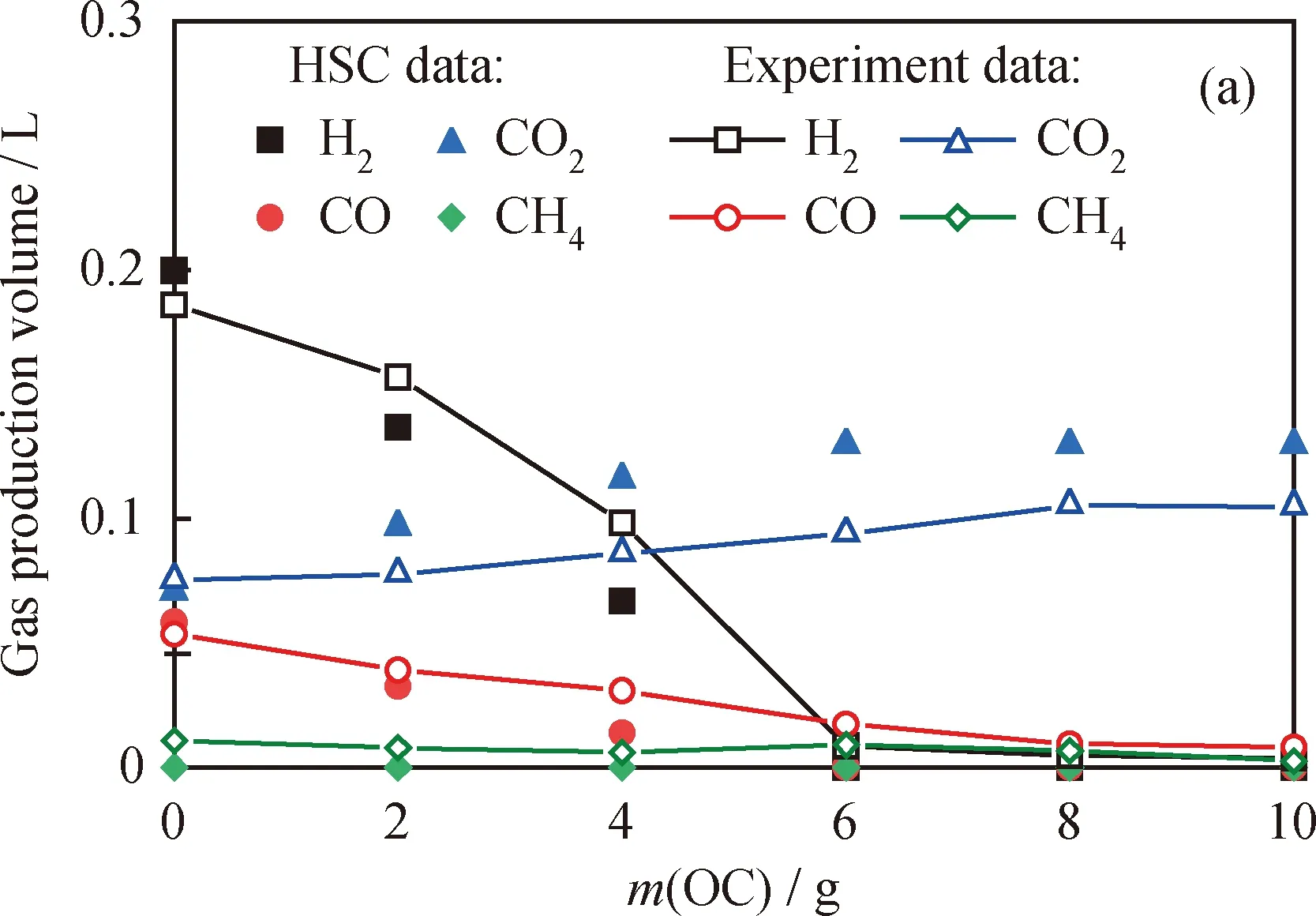
图5 尾气中各组分体积的实验值与模拟值Fig.5 Experimental and simulated values of the cumulative emission volume of tail gas
3 热、质平衡计算
对本研究燃料处理的化学链系统模型,包括燃料反应器(FR)和空气反应器(AR)系统,进行满足自热平衡的热、质平衡估算,即:假设系统自热平衡时,FR中载氧体及热功率均来自AR。假定燃料煤完全燃烧转化,对AR、FR中反应物料进行质量衡算,并对其反应的吸、放热进行热功率衡算,并在一定热损失条件下,确定系统自热平衡时的热、质流率。为简化计算,忽略连接部分(如碳分离器、返料阀等)的热、质变化。其中,锰矿石物性及流化床反应器的参数如表3、4所示。

表3 煅烧锰矿石的物性参数Table 3 Physical properties of calcined manganese ore

表4 流化床运行参数Table 4 Parameters of fluidized bed reactor
3.1 质量衡算
在对AR-FR反应系统进行质量衡算时,需通过反应动力学分析求出AR、FR中各反应的反应时间(τchr)。假设反应过程遵循粒子收缩核模型[21],且由固体扩散控制,则可通过化学反应控制的颗粒均匀反应模型和颗粒变径模型来确定反应的动力学参数,从而由式(14)~(15)可以计算出AR、FR中各反应的反应时间(τchr,s)。
(14)
(15)
其中:ρm为反应温度下颗粒表观密度,kg/m3,取值3680 kg/m3;rg为颗粒的平均半径,mm;b为化学计量数;ks为对应H2、CO、CH4还原锰矿石和O2氧化锰矿石的反应速率常数,mol1-n·m3n-3/s;cg为气体浓度,mol/m3;Xi为i气体转化率,%;t为气体转化率Xi时的反应时间,s;n为反应级数。借助τchr积分可得各气体反应的级数n,如式(16)所示。
(16)
假定反应速率常数ks与温度的函数关系为Arrhenius型,如式(17)所示:
(17)
其中:E为各反应的活化能,kJ/mol;R为理想气体常数,kJ/(mol·K);T为反应器温度,K。
FR中单位时间煤炭消耗量(mCoal,kg/h)可由实验确定平均数据。根据煤元素分析结果可以计算出此时晶格氧的所需量(mO,kg/h)为:
(18)
其中:wi(i为C、H、S、O)为煤中不同元素的质量分数,%;如果煤在FR被完全氧化,则根据元素质量比可知产出烟气体积(VCoal,L)为:
(19)
其中,wH2O为烟气中水蒸气的质量分数,%。载氧体在AR中完全再生所需空气体积(VAR-air,L)计算公式:
(20)
其中:MO2为氧气摩尔质量,g/mol;α为空气过量系数;则满足质量衡算的载氧体的循环流率(ms-mass,kg/h)为:
(21)
其中:ΔX为载氧体在FR中还原质量分数,%;R0为载氧体载氧能力,为晶格氧占载氧体的质量分数。实验结果表明ΔX×R0≈1.8%,由公式(19)和已知R0对ΔX进行初步估计。
对AR-FR反应系统进行质量衡算,结果如表5所示。由表5可知,该工况下,煤的消耗量为0.648 kg/h。由式(18)和(21)计算可得,FR-AR实验系统质量平衡的载氧体循环流率为72.36 kg/h。按照实验的燃料处理量规模,由公式(15)计算所得AR、FR中各反应的反应时间,结合式(21)所得载氧体循环流率,可得到FR中载氧体质量保持为1.26 kg,AR中载氧体质量保持为0.201 kg,符合载氧体还原缓慢,但氧化再生快速的特点。

表5 实验进料规模下AR-FR反应系统质量衡算结果Table 5 Mass balance results of AR-FR system at the scale of experiment feed
3.2 热功率衡算
当AR-FR能够自热循环时,FR内煤气化/燃烧反应所需热功率主要来自于AR再生载氧体带入的显热量QFR-inOC。此外,FR内反应热平衡主要涉及煤升温吸热量Qheat、煤气化吸热量Qgasification、载氧体还原反应放热量QOC-gas、还原后载氧体带走显热量QFR-outOC,外加流化气带入FR的热量QFR-ingas及带出FR的热量QFR-outgas,单位均为kW,因此FR内反应热平衡计算如式(22):
QFR-inOC+QFR-ingas-QFR-outgas-QFR-outOC=
Qheat+Qgasification+QOC-gas
(22)
其中:煤气化吸热量(Qgasification)和载氧体与煤合成气的反应放热量(QOC-gas)可根据反应方程式通过HSC reaction equations模块计算获得;煤升温吸热量Qheat由同步热分析仪(北京恒久,HTC-4)测试获得;进出口气体显热量QFR-ingas和QFR-outgas由温差和体积流量测试后计算得到。
AR内反应热主要是载氧体氧化再生放热量QOC-re,用以提供系统所需热功率。此外,AR内反应热平衡主要涉及还原载氧体带入显热量QFR-outOC、再生载氧体带走的显热量QFR-inOC、外加流化气带入AR的热量QAR-ingas与带出AR的热量QAR-outgas。因此AR热平衡计算如式(23)。
QOC-re=QAR-ingas+QFR-outOC-QAR-outgas-QFR-inOC
(23)
其中,载氧体再生放热量(QOC-re)同样由HSC reaction equations模块计算获得。
同时,通过经验系数估算2个反应器的散热损失量QAR-loss、QFR-loss,因此AR-FR系统总热量平衡计算如式(24):
QAR-ingas+QFR-ingas-QAR-outgas-QFR-outgas-QAR-loss-QFR-loss=Qheat+Qgasification+QOC-gas+QOC-re
(24)
实验中,FR外置加热装置为系统唯一供热热源,即为自热循环系统中载氧体带入FR中热量QFR-inOC,其值可由外置仪器获取,则根据热功率衡算计算载氧体循环流率(ms-heat,kg/h)为:
(25)
比较质量衡算载氧体循环流率(ms-mass)和热功率衡算的载氧体循环流率(ms-heat),取其中较大值(ms-max)。
表6为实验燃料处理规模下对应的FR-AR反应系统热功率衡算结果。由表6可知,FR中,载氧体带入的热功率为1.426 kW,其中煤热解吸收热功率、煤合成气反应总体吸热功率、流化气吸收热功率分别占载氧体释放热功率的7.43%、25.2%、53.23%,因而可知高温载氧体释放热功率多用于来流气体的加热,FR整体达到热平衡。AR中,载氧体氧化反应产出热功率2.63 kW,其中,被载氧体自身吸收的热功率占总热功率的56.6%,热功率损失和外加流化气带出AR的热功率分别占总热功率的8.3%、17.1%;此外0.47 kW的热功率可供输出,参与其他热交换过程。

表6 实验进料规模下AR-FR反应系统热功率衡算Table 6 Heat balance results of AR-FR system at the scale of experiment feed Q/kW
4 结 论
以煅烧锰矿石为载氧体,采用HSC模拟计算不同载氧体/煤粉质量比下煤化学链气化/燃烧产物组成的变化;并在鼓泡流化床上进行了煤化学链气化/燃烧实验,验证计算结果和实验结果的一致性。结果表明:
(1)在1173.15 K下,锰矿石载氧体与煤合成气有良好的反应活性,可显著提高煤气化速率;随载氧体质量增加,燃烧效率不断提高;计算结果与实验结果相符,计算模型可靠有效、误差小。
(2)在鼓泡床反应器中,煤合成气很难一次性燃尽,煤与载氧体的质量比为1∶80~1∶100,因而载氧体要多次循环再生、并连续补充进FR。AR-FR反应系统热、质衡算发现,载氧体在FR中反应速率较低,需要较长停留时间,而在AR中反应速率较高、时间较短。
(3)当煤耗为0.648 kg/h、固体流率为72.36 kg/h、FR载氧体为1.26 kg、AR载氧体为0.201 kg时,系统可达到自热平衡。此时锰矿石载氧体再生过程中产热功率2.63 kW,其中1.49 kW的热功率用于自身循环,0.47 kW的热功率可输出。

