CO2对高铁高钙煤灰载氧体炉内脱汞的影响
刘 壮, 刘敦禹, 金 晶, 冯 亮, 倪明国
(上海理工大学 能源与动力工程学院 上海市动力工程多相流动与传热重点实验室,上海 200093)
煤化学链燃烧技术可有效实现CO2的捕集和封存[1-4],从而减小CO2排放给人类和生态环境所带来的危害[3,5]。然而,由于煤中汞(Hg)元素的存在,煤化学链燃烧过程产生的Hg污染问题同样值得关注[6]。一般而言,燃煤烟气中的Hg主要以单质汞(Hg0)、氧化态汞(Hg2+)和颗粒态汞(Hgp)3种形态存在[7-8]。其中,Hg2+易溶于水,可被湿法烟气脱硫装置去除[9];Hgp一般存在于飞灰等固体颗粒物表面,可通过静电除尘器或袋式除尘器去除[10];而Hg0易挥发且难溶于水[11-12],因而难以被现有的烟气净化设备有效去除。考虑到Hg0的剧毒性、迁移性和生物累积性,有效处理煤化学链燃烧过程中产生的Hg0是十分必要的[13-14]。
由于Hg2+易被去除,将Hg0氧化成Hg2+是一种有效减少Hg0排放的方法[8]。烟气中HgCl2是Hg2+的主要形态[15],因而HCl被视为烟气中参与Hg0氧化的主要成分[16]。在化学链气化及燃烧过程中,载氧体是氧传递的重要媒介[3,17-19]。如果载氧体具备氧化Hg0的能力,将有助于解决煤化学链燃烧过程中的Hg0污染问题。Lin等[20]发现高铁高钙煤灰(High iron and calcium coal ash,以下简称为HICCA,主要活性成分为Fe2O3和CaSO4)具有较高的活性,可作为一种新型载氧体应用于煤化学链燃烧技术中。Ni等[21]通过实验和热力学计算发现,CaSO4和Fe2O3在900 ℃、HCl气氛下均表现出良好的Hg0氧化效率。这归因于Fe2O3和CaSO4可分别与HCl反应生成Cl、Cl2、Cl2O、ClO、HOCl、FeCl3及SCl2等活性物质,有利于Hg0向HgCl2的氧化。由于HICCA载氧体的主要成分为Fe2O3和CaSO4,因而推测HICCA载氧体也可能作用于Hg0的氧化。
与传统燃烧方式相比,煤化学链燃烧烟气中富含CO2。已有研究发现CO2对Hg0的氧化产生了不同程度的影响[22-26]。因此,探讨CO2对煤灰脱汞的影响规律对于揭示煤化学链燃烧炉内脱汞机理是十分必要的。然而,目前关于CO2对煤灰炉内脱汞影响的相关研究还比较缺乏。
为探究CO2气氛对HICCA载氧体在化学链燃烧温度下脱汞的影响,笔者采用水平管式炉反应器模拟炉内高温环境,分别对比N2惰性气氛和CO2气氛下‘Hg0+HICCA’和‘Hg0+HCl+HICCA’反应系统的脱汞效率,并对HICCA样品进行XRD和EDS表征,结合热力学计算揭示不同气氛下Hg0氧化为HgCl2和HgCl2还原为Hg0的路径。
1 实验部分
1.1 实验原料
HICCA用煤来源于中国准噶尔盆地将军庙煤田的将军煤。HICCA制备过程见参考文献[20]。HICCA中未燃尽碳的量可忽略不计[20],表1为HICCA样品中主要无机成分分析结果。

表1 HICCA主要组分质量组成[20]Table 1 Mass fraction of main inorganic compositions in HICCA w/%
1.2 实验系统
采用自组装固定床实验系统(图1所示)测量燃煤烟气的脱汞效率。固定床实验系统主要包括Hg0蒸气发生器、模拟烟气、水平管式炉反应器、Hg0测量和尾气处理部分。Hg0蒸气发生器由Hg0渗透管(苏州青安仪器有限公司产品)、U型管和水浴锅组成。实验时,将安装有Hg0蒸气渗透管的U型管放置于50 ℃水浴锅中。在化学链气化/燃烧过程中,烟气中CO2的浓度远高于Hg0蒸气和HCl气体的浓度。为了模拟实际工况,并考察CO2对反应系统脱汞效果的影响,分别使用N2或CO2(体积分数均为99.99%)作为携带Hg0蒸气的载气。

图1 固定床实验系统Fig.1 The fixed-bed experimental system
参考文献[27],设定模拟烟气中Hg0蒸气质量浓度为100 ng/L,HCl的体积分数为50 μL/L。反应时间为1 min,烟气总量为1 L。标准状况下,烟气摩尔体积为22.4 L/mol,因而1 L烟气中有Hg0蒸气、HCl、CO2(或N2)物质的量分别为5×10-10mol、2.23×10-6mol、4.46×10-2mol。固定床床料由0.2 g HICCA和1.0 g石英砂混合组成,由表1数据可计算得出0.2 g HICCA样品中Fe2O3和CaSO4分别为3.72×10-4mol和6.30×10-4mol。在样品两侧分别放置石英棉以防止样品被气流吹走。为保证实验数据准确性,设置空白实验组(只有石英棉和石英砂,没有载氧体)。设定实验温度均为850 ℃,并假设HICCA中未燃尽碳的量可忽略不计[20]。
Hg0的测量采用测汞仪(QM201H,苏州青安仪器有限公司产品)。脱汞效率(η,%)按公式(1)[28]计算。
η=[(Cin-Cout)/Cin]×100%
(1)
式(1)中,Cin和Cout分别为管式炉进口和出口处Hg0质量浓度,μg/m3。
1.3 表征测试
为了剖析CO2对‘Hg0+HICCA’和‘Hg0+HICCA+HCl’系统脱汞效率的作用机理,分别对HICCA、HICCA(HCl)、HICCA(CO2)、HICCA(HCl+CO2)样品进行XRD(6100,日本岛津仪器公司产品)和EDS(S-4800,日本日立仪器公司产品)表征测试。其中:HICCA(HCl)、HICCA(CO2)、HICCA(HCl+CO2)分别是指‘Hg0+HICCA+CO2’、‘Hg0+HICCA+HCl’、‘Hg0+HICCA+HCl+CO2’系统反应完毕后的样品。
2 结果与讨论
2.1 CO2对‘Hg0+HICCA’和‘Hg0+HICCA+HCl’系统脱汞效率的影响
图2为CO2对各实验系统脱汞效率的影响。由图2可知:‘Hg0+CO2’系统的脱汞效率略高于空白实验,说明单纯CO2对Hg0几乎无氧化作用;与‘Hg0+HICCA’系统相比,‘Hg0+HICCA+CO2’系统的脱汞效率更高,且二者均高于空白实验结果,表明HICCA对于Hg0的脱除有一定的作用,并且CO2增强了HICCA的脱汞效果。
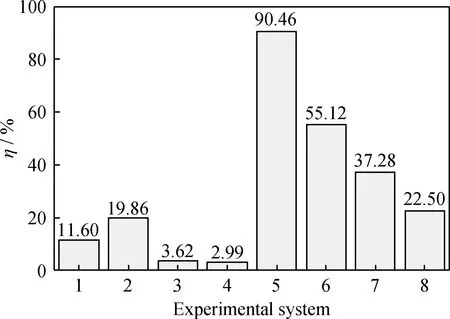
图2 不同反应系统脱汞效率图Fig.2 The Hg0 removal efficiency of different experimental systemsExperimental system: 1—‘Hg0+HICCA’;2—‘Hg0+HICCA+CO2’;3—‘Hg0+CO2’; 4—‘Blank test’;5—‘Hg0+HICCA+HCl’; 6—‘Hg0+HICCA+HCl+CO2’;7—‘Hg0+HCl’; 8—‘Hg0+HCl+CO2’
‘Hg0+HICCA+HCl’系统的脱汞效率高于‘Hg0+HCl’系统,表明HICCA样品中某些活性物质(Fe2O3、CaSO4)可能参与了HCl与Hg0的反应。而‘Hg0+HICCA+HCl+CO2’系统的脱汞效率低于‘Hg0+HICCA+HCl’系统,表明CO2严重降低了‘Hg0+HICCA+HCl’系统的脱汞效果。‘Hg0+HCl+CO2’系统的脱汞效率低于‘Hg0+HCl’系统,表明CO2抑制了HCl与Hg0的反应。由于CO2对‘Hg0+HICCA+HCl’系统脱汞作用的抑制(脱汞效率下降35.34百分点)远大于其对‘Hg0+HCl’系统的抑制作用(脱汞效率下降14.78百分点),表明CO2还可能抑制了‘Hg0+Fe2O3/CaSO4+HCl’的反应过程。
2.2 HICCA样品表征
2.2.1 XRD分析
图3为HICCA、HICCA(HCl)、HICCA(CO2)、HICCA(HCl+CO2)样品的X射线衍射图。由图3可知,4种HICCA样品的主要成分均为CaSO4、SiO2、CaO、Fe2O3、Al2O3等反应生成的混合物(CaFe2O4和Ca3Al2O6等)。此外,4种HICCA样品的特征峰位置均无明显变化,说明没有新的晶相生成。

图3 不同样品X射线衍射图Fig.3 XRD patterns of different HICCA samples1—CaSO4; 2—SiO2; 3—CaFe2O4; 4—Ca3Al2O6;5—CaSiO3; 6—Na2SO4; 7—Al2O3; 8—Al(OH)3;9—Na2Ca(CO3)2;10—Ca2Fe2O5;11—Ca2Fe7O11; 12—CaAl2Si7O18
表2为4种HICCA样品中CaSO4特征峰强度(I)对比。由表2可知,与HICCA样品相比,HICCA(CO2)、HICCA(HCl)、HICCA(HCl+CO2)样品中CaSO4的特征峰强度均呈现出不同程度的下降,其中HICCA(HCl+CO2)样品中CaSO4的特征峰强度下降最显著。因此,推测CO2对HICCA脱汞的促进作用,及对‘Hg0+HICCA+HCl’系统的抑制作用均可能与CaSO4有关。
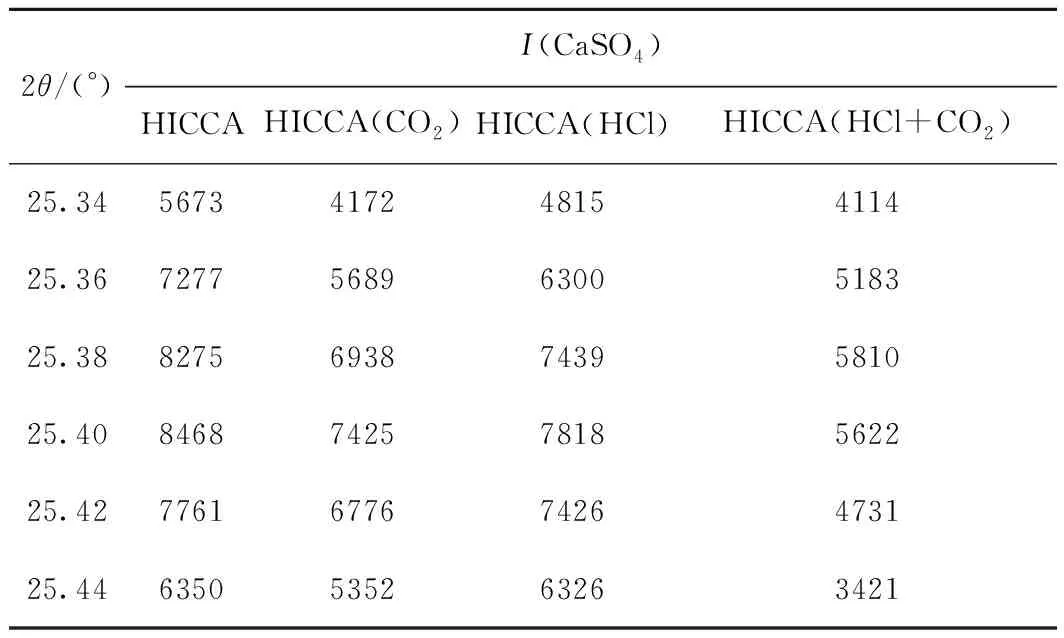
表2 4种HICCA样品CaSO4特征峰强度对比Table 2 The comparison on the characteristic peak intensity of CaSO4 in four kinds of HICCAs
2.2.2 EDS分析结果
表3为HICCA、HICCA(HCl)、HICCA(CO2)、HICCA(HCl+CO2)样品表面主要元素种类及其质量组成。由表3可知,与HICCA样品相比,HICCA (CO2)样品中Ca、S和O元素质量分数均下降。由于EDS结果中各元素比例为相对百分比,因而HICCA(CO2)中Ca、S和O元素质量分数的减少导致Fe元素质量分数的相对增加,但是HICCA(CO2+HCl)样品中Fe的质量分数也显著下降,因而推测CO2对‘Hg0+HICCA+HCl’的抑制作用也可能与Fe2O3有关,即CO2可能抑制了‘Hg0+Fe2O3+HCl’系统的Hg0的氧化。

表3 4种HICCA样品表面主要元素种类及其质量分数Table 3 The EDS analysis of four HICCA samples
3 CO2作用机理分析
3.1 CO2对‘Hg0+HICCA’系统的作用机理
根据XRD和EDS表征测试结果,CO2对HICCA脱汞的促进作用可能与CaSO4有关。为了揭示CO2对CaSO4氧化Hg0的作用机理,使用热力学计算软件Factsage中的Equilibrium模块对‘Hg0+CO2’、‘Hg0+CO2+CaSO4’和‘Hg0+CaSO4’系统进行热力学计算。
表4为‘Hg0+CO2’、‘Hg0+CaSO4+CO2’和‘Hg0+CaSO4’系统各物种物质的量对比。由表4可知:‘Hg0+CO2’系统中存在一定的CO,可能为系统中CO2分解而来;与‘Hg0+CO2’系统相比,‘Hg0+CaSO4+CO2’系统中CO有所减少;与‘Hg0+CaSO4’系统相比,‘Hg0+CaSO4+CO2’系统中CaO、SO2和CaS均有所增加。CO的减少和CaO的增加来源于CO与CaSO4的反应[29]:一方面,CaSO4可以和CO反应生成CaS和CO2(R1,文中的Rm(m为1~99)均为描述系统中反应的编号);另一方面,CaSO4可以和CO反应生成CaO、SO2和CO2(R2)。这表明,HICCA存在时,其组分CaSO4与CO的反应导致CO数量减少,从而减弱了其对HgO的还原反应(R3),反过来又促进CO2的分解朝着正反应方向进行(R4),使O物种增加,进而增强了Hg0向HgO的氧化。因此,表现为CO2对HICCA脱汞的促进作用。
3.2 CO2对‘Hg0+HICCA+HCl’系统的作用机理
3.2.1 CO2对‘Hg0+HCl’系统的抑制作用机理
为了揭示CO2对HCl转化Hg0反应抑制作用的机理,采用热力学计算软件Factsage中的Equilibrium模块对‘Hg0+HCl’和‘Hg0+HCl+CO2’系统进行计算。表5为‘Hg0+HCl’和‘Hg0+HCl+CO2’系统各物种物质的量对比。由表5可知,‘Hg0+HCl’系统中主要物种有H、H2、Cl和Cl2等, ‘Hg0+HCl+CO2’系统中主要物种有H、H2、Cl、Cl2、CO、ClO、HOCl、ClO2、Cl2O、O、OH、HOO和HOOH等。其中,H和Cl来自于HCl的分解(反应R5)[21];H与H合并生成H2(反应R6),Cl与Cl合并生成Cl2(反应R7);H2可以将CO2还原成CO,同时生成H2O蒸气(反应R8),H2O分解产生O和H2(反应R9)[21];O可以和Cl反应生成ClO(反应R10),也可以与H反应生成OH(反应R11)。HOCl的来源包括3方面:ClO和H之间的反应(反应R12)、Cl和OH之间的反应(反应R13),以及HCl和O之间的反应(反应R14)。ClO2来自于ClO和O之间的反应(反应R15),Cl2O来自于Cl2和O之间的反应(反应R16)[21]。HOO来自于OH和O之间的反应(反应R17);HOOH既可以来自于OH之间的反应(反应R18),也可以来自于HOO和H之间的反应(反应R19)。
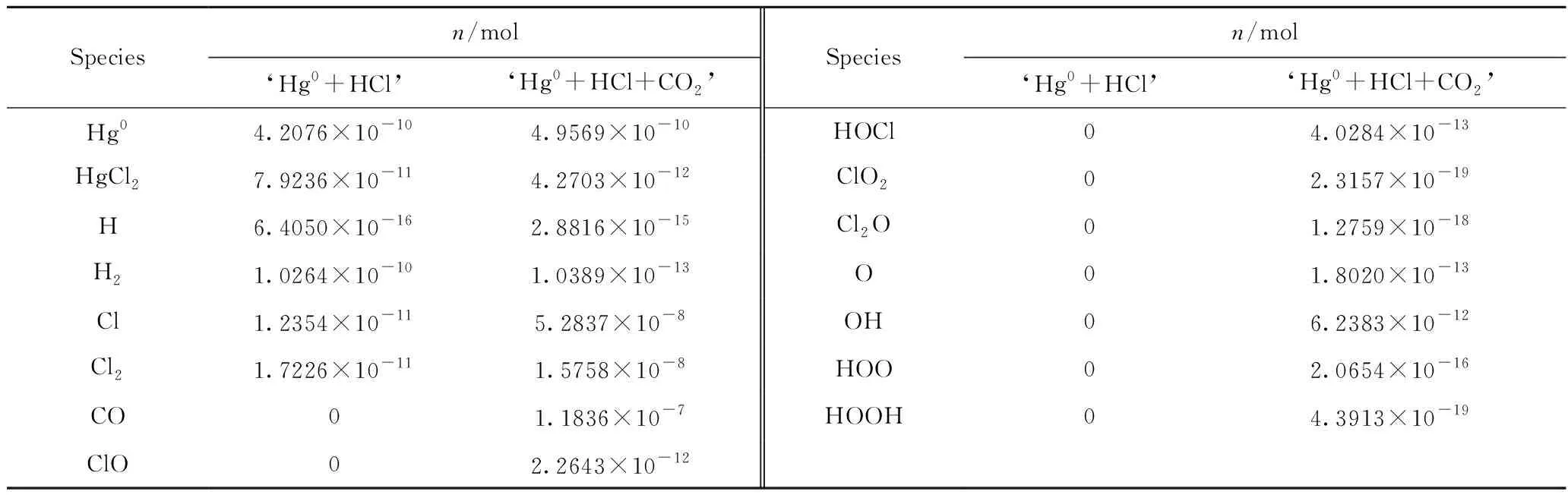
表5 ‘Hg0+HCl’和‘Hg0+HCl+CO2’系统各物种物质的量对比Table 5 The quantity comparison of materials in ‘Hg0+HCl’ and ‘Hg0+HCl+CO2’ systems
在确定‘Hg0+HCl’和‘Hg0+HCl+CO2’系统的主要产物物种后,采用热力学计算软件Factsage中的Reaction模块,对‘Hg0+HCl’和‘Hg0+HCl+CO2’系统中Hg0氧化为HgCl2及HgCl2还原为Hg0的所有相关反应进行吉布斯自由能变(ΔG)计算。表6为‘Hg0+HCl’和‘Hg0+HCl+CO2’系统中可以发生的47个反应方程式。其中,尽管反应R4、R5和R9产生的O、H和Cl等产物数量有限,但由于CO2和HCl物质的量远大于Hg0的,因而O、H和Cl的生成也会影响Hg0的氧化[21]。
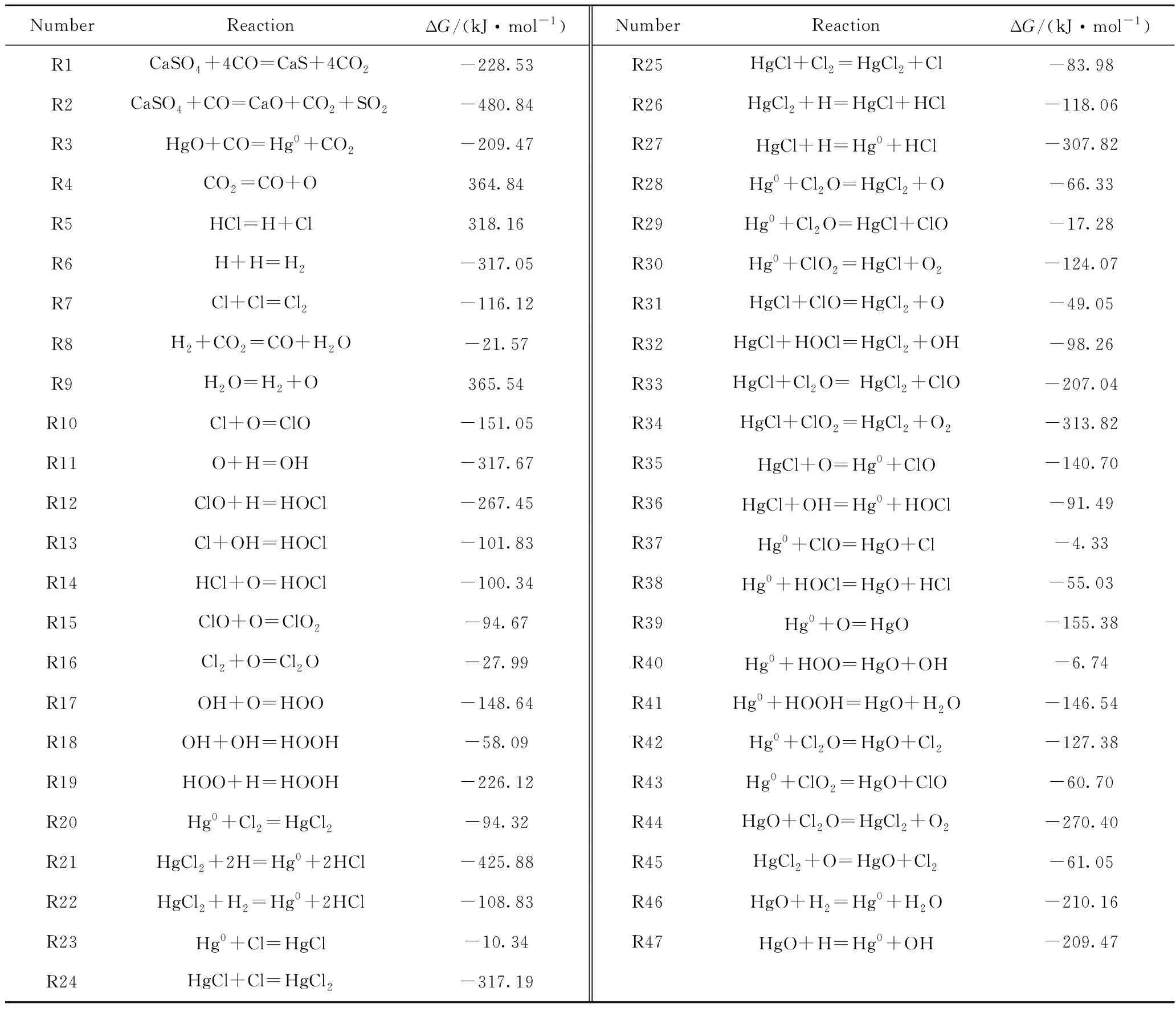
表6 不同反应在850 ℃下的吉布斯自由能变值(ΔG)Table 6 The changes of Gibbs free energy (ΔG) from different reactions at 850 ℃
根据表6结果,图4给出了‘Hg0+HCl’和‘Hg0+HCl+CO2’系统中Hg0与HgCl2之间的转化路径。由图4(a)可知,在‘Hg0+HCl’系统,Hg0与HgCl2之间的转化可能包括2种路径:
(Ⅰ)Hg0被Cl2直接氧化成HgCl2(R20);HgCl2被H(R21)、H2(R22)直接还原成Hg0。
(Ⅱ)Hg0先被Cl氧化成HgCl(R23),HgCl再被Cl(R24)、Cl2(R25)氧化成HgCl2;HgCl2先被H还原成HgCl(R26),HgCl再被H还原成Hg0(R27)。
由图4(b)可知,在‘Hg0+HCl+CO2’系统中,Hg0与HgCl2之间的转化可能包括3种路径:

图4 ‘Hg0+HCl’和‘Hg0+HCl+CO2’系统中Hg0与HgCl2之间转化路径图Fig.4 The transformation between Hg0 and HgCl2 in ‘Hg0+HCl’ and ‘Hg0+HCl+CO2’ systems(a) ‘Hg0+HCl’; (b) ‘Hg0+HCl+CO2’
(Ⅰ)Hg0被Cl2(R20)、Cl2O(R28)直接氧化成HgCl2;HgCl2被H(R21)、H2(R22)直接还原成Hg0。
(Ⅱ)Hg0先被Cl(R23)、Cl2O(R29)、ClO2(R30)氧化成HgCl,HgCl再被Cl(R24)、Cl2(R25)、ClO(R31)、HOCl(R32)、Cl2O(R33)、ClO2(R34)氧化成HgCl2;HgCl2先被H还原成HgCl (R26),HgCl再分别与H(R27)、O(R35)、OH(R36)反应生成Hg0。
(Ⅲ)Hg0先被ClO(R37)、HOCl(R38)、O(R39)、HOO(R40)、HOOH(R41)、Cl2O(R42)、ClO2(R43)反应生成HgO,HgO再与Cl2O反应生成HgCl2(R44);HgCl2先与O反应生成HgO (R45),HgO再分别被CO(R3)、H2(R46)、H(R47)还原成Hg0。
对于转化路径(Ⅰ),与‘Hg0+HCl’系统相比,‘Hg0+HCl+CO2’系统中Cl2、Cl2O、H增加,H2减少(见表5)。由于Cl2的增加量远大于H的增加量,因而CO2在整体上促进了转化路径(Ⅰ)中Hg0向HgCl2的氧化。对于转化路径(Ⅱ),‘Hg0+HCl+CO2’系统中Cl、Cl2、ClO、HOCl、Cl2O、ClO2、OH、H和O均增加。由于Cl和Cl2的增加量远大于OH、H和O的增加量,因而CO2在整体上促进了转化路径(II)中Hg0向HgCl2的氧化。CO2对转化路径(Ⅰ)和(Ⅱ)中Hg0向HgCl2氧化的促进作用将在一定程度上导致Hg0的减少和HgCl2的增加,而实验结果显示CO2抑制了HCl对Hg0的氧化,因此CO2抑制作用不发生在转化路径(Ⅰ)和(Ⅱ)上。
对于转化路径(Ⅲ),‘Hg0+HCl+CO2’系统中ClO、HOCl、O、HOO、HOOH、Cl2O、ClO2、CO和H增加,H2减少。一方面,ClO、HOCl、O、HOO、HOOH、Cl2O和ClO2的增加促进了Hg0向HgO的氧化;但另一方面, CO、H的增加则促进了HgO向Hg0的还原。由于CO的增加量远大于ClO、HOCl、O、HOO、HOOH、Cl2O和ClO2等物质的增加量,因而CO2在整体上促进了转化路径(Ⅲ)中HgO向Hg0的还原。因此,在转化路径(Ⅲ)中,CO2未促进Hg0向HgO的转化,反而促进了HgO的Hg0的还原,转化路径(Ⅲ)是CO2抑制HCl转化Hg0的途径。
3.2.2 CO2对‘Hg0+Fe2O3+ HCl’系统的抑制作用机理
为了揭示CO2对‘Hg0+Fe2O3+HCl’系统的抑制作用机理,采用热力学计算软件Factsage中的Equlibrium模块对‘Hg0+Fe2O3+HCl’和‘Hg0+Fe2O3+HCl+CO2’系统进行计算。表7为‘Hg0+Fe2O3+HCl’和‘Hg0+Fe2O3+HCl+CO2’系统各物种物质的量对比。由表7可知,与‘Hg0+HCl+CO2’系统相比,‘Hg0+Fe2O3+HCl+CO2’系统中增加了FeO、Fe、FeCl、FeCl3等产物物种。其中,FeO来源于H2对Fe2O3的还原(反应R48),Fe来源于H2对FeO的还原(反应R49),FeCl来自于Fe和Cl之间的反应(反应R50),FeCl3一方面来自于FeCl和Cl2之间的反应(反应R51)[21]。
根据表7结果,采用Reaction模块对‘Hg0+Fe2O3+HCl’和‘Hg0+Fe2O3+HCl +CO2’系统中可能发生的反应进行吉布斯自由能变(ΔG)计算,取ΔG<0的反应为确定可以发生的反应。表8为不同反应方程式在850 ℃下的吉布斯自由能变值。(为了避免和表6重复,表8只展示了与含Fe物种相关的13个反应式。)
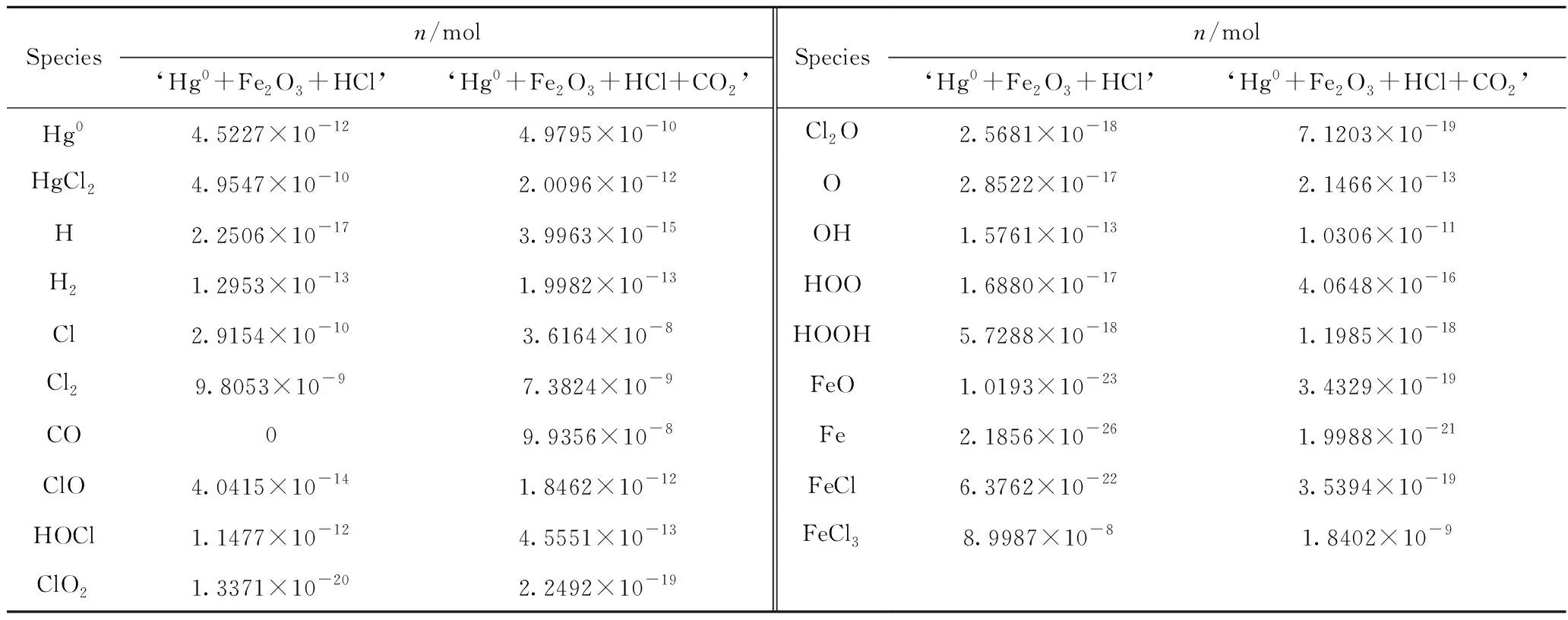
表7 ‘Hg0+Fe2O3+HCl’和‘Hg0+Fe2O3+HCl+CO2’系统各物种物质的量对比Table 7 The quantity comparison of species in ‘Hg0+Fe2O3+HCl’ and ‘Hg0+Fe2O3+HCl +CO2’ systems
根据表8结果, Hg0+Fe2O3+HCl’和‘Hg0+Fe2O3+HCl+CO2’系统中Hg0与HgCl2之间的转化路径如图5所示。由图5(a)可知,在‘Hg0+Fe2O3+HCl’系统中,Hg0与HgCl2之间转化可能包括以下3条路径:
表8 不同反应方程式在850 ℃下的吉布斯自由能变值(ΔG)Table 8 The changes of Gibbs free energy (ΔG) from different reactions at 850 ℃
(Ⅰ)Hg0被Cl2(R20)、Cl2O(R28)直接氧化成HgCl2;HgCl2被H(R21)、H2(R22)、FeCl(R52)、Fe(R53)直接还原成Hg0。
(Ⅱ)Hg0被Cl(R23)、Cl2O(R29)和ClO2(R30)氧化成HgCl,HgCl与Cl(R24)、Cl2(R25)、ClO(R31)、HOCl(R32)、Cl2O(R33)、ClO2(R34)、FeCl(R54)反应生成HgCl2;HgCl2与H(R26)、FeCl(R55)反应生成HgCl,HgCl与H(R27)、OH(R35)、O(R36)、FeCl(R56)、Fe(R57)、FeCl2(R58)反应生成Hg0。
(Ⅲ)Hg被ClO(R37)、HOCl(R38)、O(R39)、HOO(R40)、HOOH(R41)、Cl2O(R42)、ClO2(R43)氧化成HgO,HgO与Cl2O(R44)反应生成HgCl2;HgCl2与O(R45)、FeO(R59)反应生成HgO,HgO被H2(R46)、H(R47)、Fe(R60)还原成Hg0。
由图5(b)可知,与‘Hg0+Fe2O3+HCl’系统相比,‘Hg0+Fe2O3+HCl+CO2’系统中Hg0和HgCl2之间转化仅多出一个反应,即HgO被CO还原成Hg0(R3)。
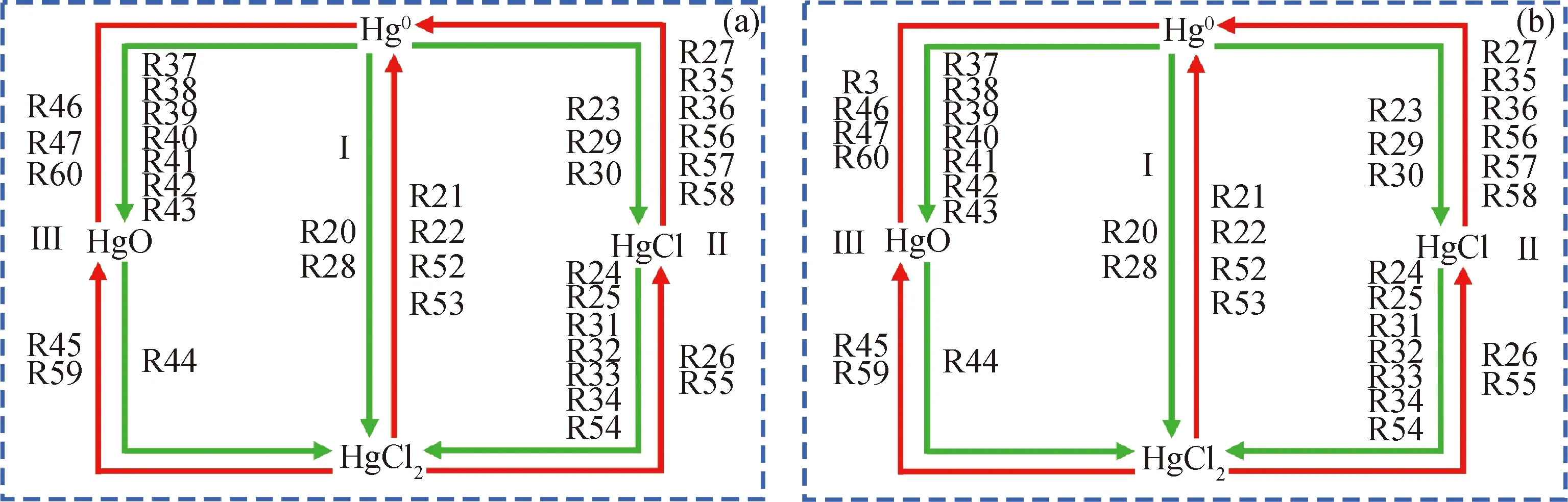
图5 ‘Hg0+Fe2O3+HCl’和‘Hg0+Fe2O3+HCl+CO2’系统中Hg0与HgCl2之间转化路径Fig.5 The transformation between Hg0 and HgCl2 in ‘Hg0+Fe2O3+HCl’ and ‘Hg0+Fe2O3+HCl+CO2’ systems(a) ‘Hg0+Fe2O3+HCl’; (b) ‘Hg0+Fe2O3+HCl+CO2’
对于转化路径(I),与‘Hg0+Fe2O3+HCl’系统相比,‘Hg0+Fe2O3+HCl+CO2’系统中Cl2和Cl2O减少,Fe和FeCl增加(见表7)。Cl2和Cl2O的减少抑制了Hg0向HgCl2的氧化,而Fe和FeCl的增加则促进了HgCl2向Hg0的还原。因此,CO2在整体上抑制了转化路径(Ⅰ)中Hg0的氧化。
对于转化路径(Ⅱ),与‘Hg0+Fe2O3+HCl’系统相比,‘Hg0+Fe2O3+HCl+CO2’系统中Cl、ClO2、FeCl、FeCl2、OH、H、Fe、ClO增加,Cl2、Cl2O、HOCl减少。其中,Cl可以将Hg0氧化成HgCl,但FeCl2也可以将HgCl还原成Hg0,且FeCl2的增加量大于Cl的增加量。因此,CO2抑制了Hg0向HgCl的氧化。由表7可知,与‘Hg0+Fe2O3+HCl’系统相比,‘Hg0+Fe2O3+HCl+CO2’系统中HgCl减少,表明该推论正确。对于HgCl向HgCl2的氧化反应,尽管Cl的增加量远大于H和FeCl的增加量,但由于受到CO2影响,中间产物HgCl减少,使HgCl氧化生成的HgCl2减少。因此,CO2在整体上抑制了转化路径(II)中Hg0向HgCl2的氧化。
对于转化路径(Ⅲ),‘Hg0+Fe2O3+HCl+CO2’系统中CO、H2、H、Fe、FeO、ClO、O、HOO、ClO2增加,HOCl、HOOH、Cl2O减少。由于CO可以将HgO还原成Hg0,虽然O的增加促进了Hg0向HgO的氧化,但由于CO的增加量远大于O,因此,CO2在整体上抑制了转化路径(Ⅲ)中Hg0向HgO的氧化。HgO和Cl2O的减少均在整体上抑制了HgO向HgCl2的转化。因此,CO2在整体上抑制了转化路径(Ⅲ)中Hg0向HgCl2的氧化。
3.2.3 CO2对‘Hg0+CaSO4+ HCl’系统的抑制作用机理
采用Factsage中的Equlibrium模块对‘Hg0+CaSO4+HCl’和‘Hg0+CaSO4+HCl+CO2’系统进行计算,结果如表9所示。由表9可知,与‘Hg0+HCl +CO2’系统相比,‘Hg0+CaSO4+HCl+CO2’系统中增加了CaO、CaS、CaCl、SO2、SO、S、SCl、SCl2等物种。其中,CaS来自CO与CaSO4的反应(R1)和H2与CaSO4的反应(R61)。
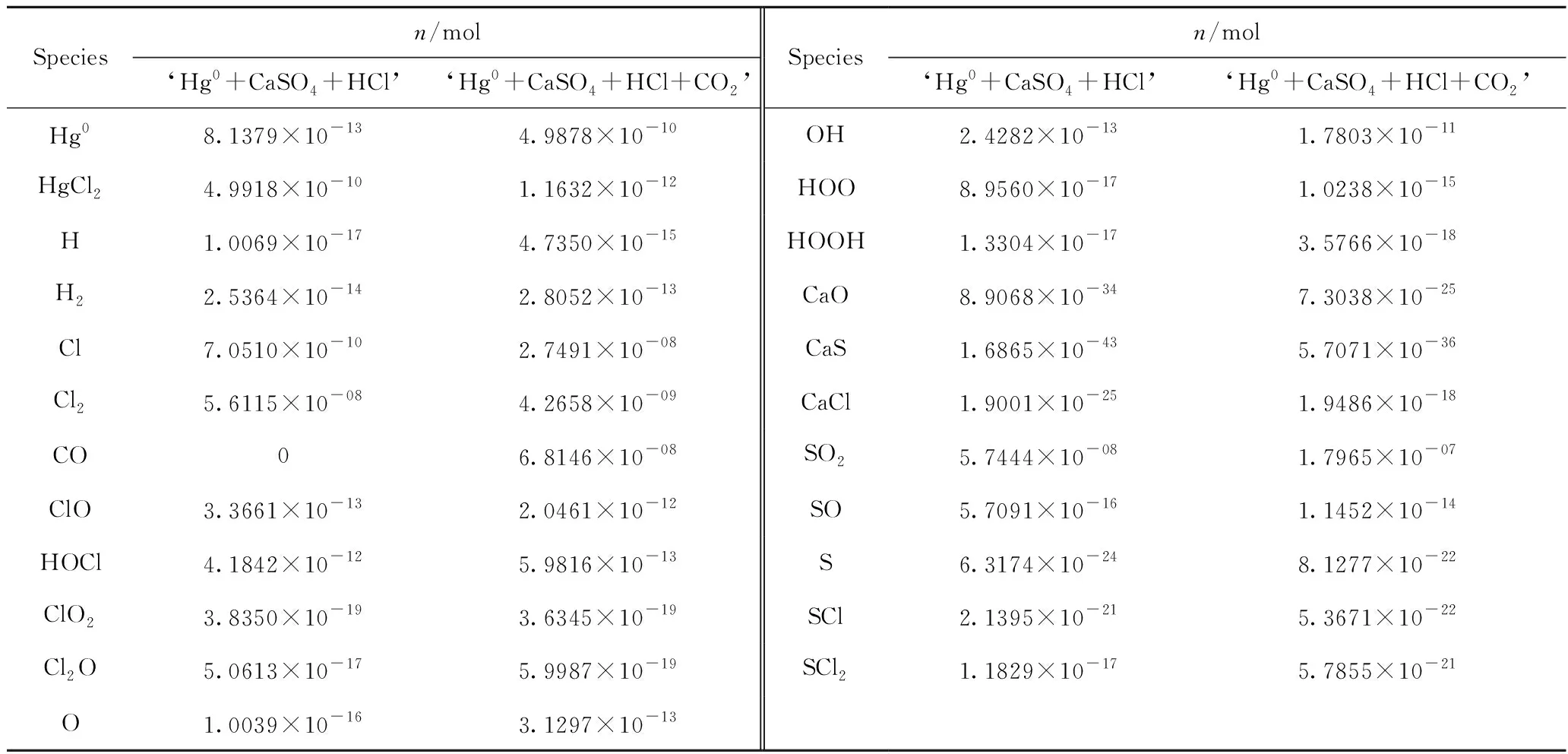
表9 ‘Hg0+CaSO4+HCl’和‘Hg0+CaSO4+HCl+CO2’系统各物质的物质的量对比Table 9 The quantity comparison of materials in ‘Hg0+CaSO4+HCl’ and ‘Hg0+CaSO4+HCl+CO2’ systems
此外,CO可以和CaSO4反应生成CaO(R2)。CaCl一方面来自于CaS分别与Cl(R62)、Cl2(R63)、ClO(R64)、ClO2(R65)的反应,另一方面来自于CaO分别与Cl(R66)、Cl2(R67),Cl2O(R68)、ClO(R69)、HCl(R70)、HgCl(R71)、HOCl(R72)、SCl(R73)的反应。CaS还可以与HCl反应生成CaCl2和H2S(R74)。H2S继而与O反应生成S和H2O蒸气(R75)。S可以与Cl反应生成SCl(R76),SCl与Cl反应生成SCl2(R77)。此外,S也可以与Cl2反应直接生成SCl2(R78)[21]。
根据表9结果,采用Reaction模块对‘Hg0+CaSO4+HCl’和‘Hg0+CaSO4+HCl+CO2’系统中可能发生的反应进行吉布斯自由能变(ΔG)计算。表10为2个系统中确定可以发生的39个反应。(为了避免和表6重复,表10只展示了与含Ca及含S物种相关的39个反应式。)
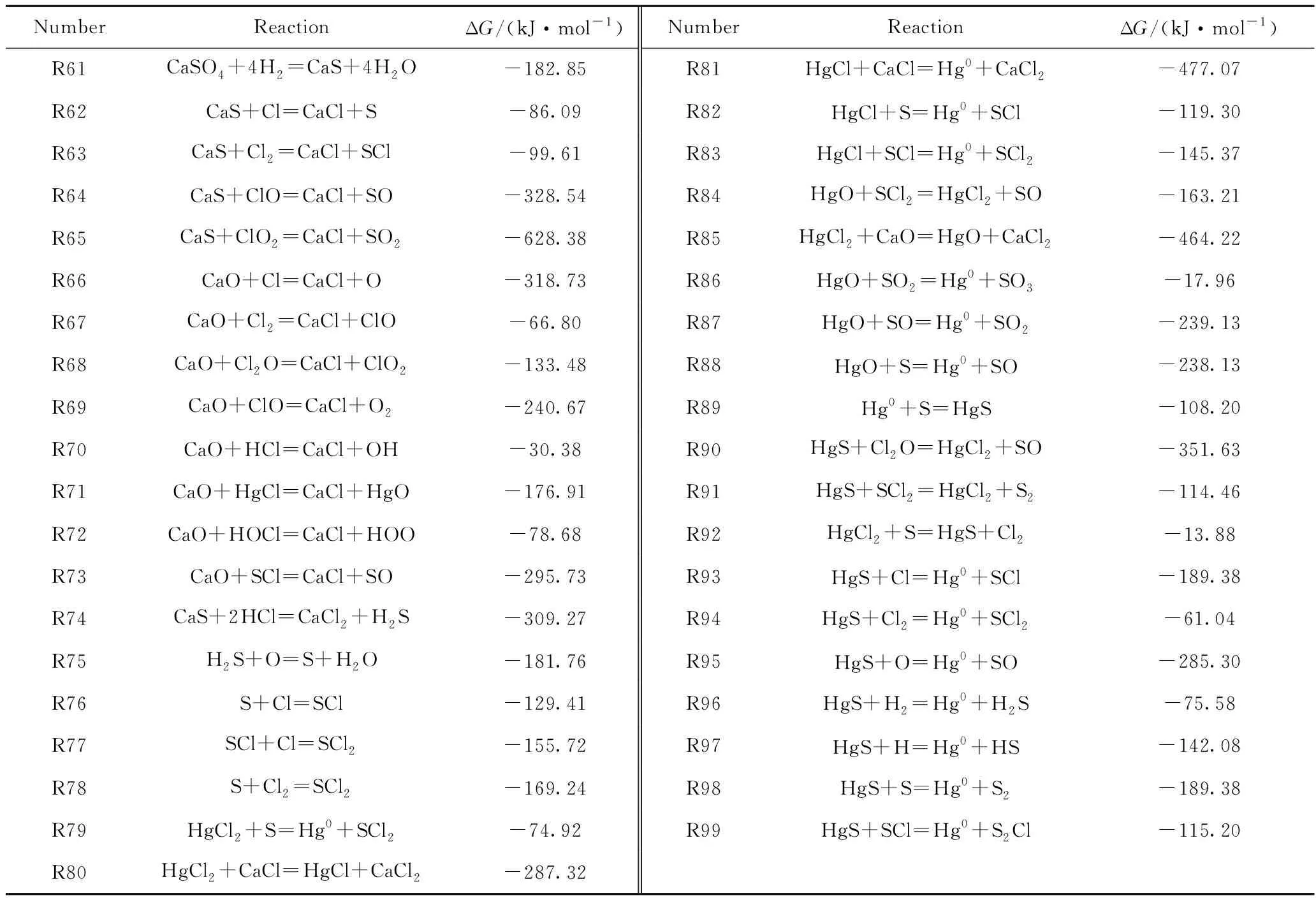
表10 不同反应方程式在850 ℃下的吉布斯自由能变值(ΔG)Table 10 The changes of Gibbs free energy (ΔG) from different reactions at 850 ℃
图6为‘Hg0+CaSO4+HCl’和‘Hg0+CaSO4+HCl+CO2’系统中Hg0与HgCl2间的转化路径。由图6(a)可知,在‘Hg0+CaSO4+HCl’系统中Hg0与HgCl2之间的转化可能包括4条路径:
(Ⅰ)Hg0直接被Cl2(R20)、Cl2O(R28)氧化成HgCl2;HgCl2被H(R21)、H2(R22)、S(R79)还原成Hg0。
(Ⅱ)Hg0先被Cl(R23)、Cl2O(R29)、ClO2(R30)氧化成HgCl,HgCl再被Cl(R24)、Cl2(R25)、ClO(R31)、HOCl(R32)、Cl2O(R33)、ClO2(R34)氧化成HgCl2;HgCl2与H(R26)、CaCl(R80)反应生成HgCl,HgCl分别与H(R27)、OH(R35)、O(R36)、CaCl(R81)、S(R82)、SCl(R83)反应生成Hg0。
(Ⅲ)Hg0先被ClO(R37)、HOCl(R38)、O(R39)、HOO(R40)、HOOH(R41)、Cl2O(R42)、ClO2(R43)氧化成HgO,HgO再与Cl2O(R44)、SCl2(R84)反应生成HgCl2;HgCl2分别与O(R45)、CaO(R85)反应生成HgO,HgO分别被H2(R46)、H(R47)、SO2(R86)、SO(R87)、S(R88)还原成Hg0。
(Ⅳ)Hg0先与S反应生成HgS(R89),HgS再与Cl2O(R90)、SCl2(R91)反应生成HgCl2;HgCl2先与S反应生成HgS(R92),HgS再分别与Cl(R93)、Cl2(R94)、O(R95)、H2(R96)、H(R97)、S(R98)、SCl(R99)反应生成Hg0。
由图6(b)可知,与‘Hg0+CaSO4+HCl’系统相比,‘Hg0+CaSO4+HCl+CO2’系统中仅多出1个反应,即HgO被CO还原成Hg0(R3)。
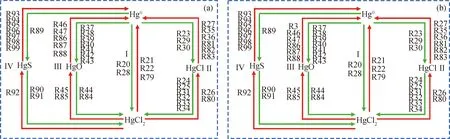
图6 ‘Hg0+CaSO4+HCl’和‘Hg0+CaSO4+HCl+CO2’系统中Hg0与HgCl2之间的转化路径Fig.6 The transformation between Hg0 and HgCl2 in ‘Hg0+CaSO4+HCl’ and ‘Hg0+CaSO4+HCl+CO2’ systems(a) ‘Hg0+CaSO4+HCl’; (b) ‘Hg0+CaSO4+HCl+CO2’
对于转化路径(Ⅰ),与‘Hg0+CaSO4+HCl’系统相比,‘Hg0+CaSO4+HCl+CO2’系统中Cl2和Cl2O减少,H、H2和S增加(见表9)。Cl2和Cl2O的减少抑制了Hg0向HgCl2的氧化,且H、H2和S的增加促进了HgCl2向Hg0的还原。因此,CO2在整体上抑制了转化路径(Ⅰ)中Hg0向HgCl2的氧化。
对于转化路径(Ⅱ),与‘Hg0+CaSO4+HCl’系统相比,‘Hg0+CaSO4+HCl+CO2’系统中Cl、ClO、OH、H、CaCl和S增加,Cl2O、ClO2、Cl2、HOCl和SCl减少。由于Cl的增加量远大于OH、H、CaCl和S的增加量,因而CO2在整体上促进了反应路径(Ⅱ)中Hg0向HgCl的氧化。这与表9中‘Hg0+CaSO4+HCl +CO2’较高的HgCl数量一致。但对于HgCl向HgCl2的氧化;由于Cl2的减少量远大于Cl的增加量,因而抑制了HgCl向HgCl2的氧化,同时H和CaCl的增加也促进了HgCl2向HgCl的还原。因而,CO2在整体上促进了转化路径(II)中Hg0向HgCl的氧化,但抑制了HgCl向HgCl2的氧化。
对于转化路径(Ⅲ),与‘Hg0+CaSO4+HCl’系统相比,‘Hg0+CaSO4+HCl+CO2’系统中CO、H2、H、SO2、SO、S、ClO、O、HOO和CaO增加,HOCl、Cl2O、ClO2和SCl2减少。由于HOCl、HOOH、Cl2O和ClO2的减少量远大于ClO、O和HOO的增加量,从而抑制了Hg0向HgO的氧化,而且CO、H2、H、SO2、SO和S的显著增加也促进了HgO向Hg0的还原。因此,CO2在整体上抑制了转化路径(Ⅲ)中Hg0向HgO的氧化,从而导致了Hg0的增加和HgO的减少。HgO、Cl2O和SCl2的减少则抑制了HgO向HgCl2的转化。因而,CO2在整体上抑制了转化路径(Ⅲ)中Hg0向HgO的氧化以及HgO向HgCl2的转化,导致了Hg0的增加和HgCl2的减少。
对于转化路径(Ⅳ),Cl、O、H2、H和S增加,Cl2、SCl、Cl2O和SCl2减少。其中,S的增加促进了Hg0向HgS的转化;而且由于Cl2的减少量远大于Cl的增加量,因而CO2整体上促进了Hg0向HgS的转化,从而导致Hg0的减少和HgS的增加。这一推论与‘Hg0+CaSO4+HCl+CO2’系统中较高的HgS数量一致。尽管HgS的增加有利于HgS向HgCl2的转化,但Cl2O和SCl2的减少抑制了HgS向HgCl2的转化,而且S的增加也促进了HgCl2向HgS的转化。因此,CO2在整体上促进了转化路径(Ⅳ)中Hg0向HgS的转化,但抑制了HgS向HgCl2的转化。
4 结 论
(1)在化学链气化及燃烧过程中,CO2对Hg0的氧化几乎没有作用,但可以增强HICCA的脱汞效果。这归因于HICCA中CaSO4与CO的反应导致CO数量减少,减弱了CO对HgO的还原,并促进了CO2向O的分解,增强了Hg0向HgO的氧化。
(2)CO2抑制了HCl对Hg0的转化。在‘Hg0+HCl’和‘Hg0+HCl+CO2’系统中,Hg0向HgCl2的氧化可能有3条路径:(Ⅰ)Hg0被直接氧化成HgCl2;(Ⅱ)Hg0先被氧化成HgCl,HgCl再被氧化成HgCl2;(Ⅲ)Hg0先被氧化成HgO,HgO再与其他物质反应生成HgCl2。CO2对路径(Ⅰ)和(Ⅱ)无抑制作用,而对路径(Ⅲ),因CO2生成的CO对HgO的还原作用,抑制了Hg0向HgO的氧化,从而抑制了Hg0对HgCl2的氧化。
(3)CO2降低了‘Hg0+HICCA+HCl’系统的Hg0氧化效率,其抑制作用主要与HICCA中Fe2O3和CaSO4相关。CO2对‘Hg0+Fe2O3+HCl+CO2’系统中Hg0向HgCl2氧化的3条反应路径和对‘Hg0+CaSO4+HCl+CO2’系统中Hg0向HgCl2氧化的4条反应路径均有抑制作用。

