玉米醇溶蛋白水解物的Zn2+螯合能力及抗氧化活性分析
李丹,朱蕊芳,张东杰
(黑龙江八一农垦大学食品学院,大庆 163319)
玉米醇溶蛋白是湿法生产玉米淀粉主要副产物,富含谷氨酰胺,其经酶解后具有螯合微量元素的能力[1-2]。微量元素多肽螯合物是由微量元素与多肽物质以共价键结合而形成的有机微量元素络合物,属新型营养素添加剂[3],相对比微量元素以无机盐形式进入生物体更容易消化吸收[4]、稳定性好[5]、生物效价高[6]、抗干扰性强等,研究价值极大。
锌是人类和动物中许多生理功能所需的关键微量营养素,缺锌的发病率和死亡率逐年上升,引发全球关注[7]。生物锌需要不断补充,因为它主要来自饮食,身体锌储量有限,替代措施是寻求通过改善其生物可接近性来促进锌的生物利用度[8-9]。源自食物的肽可以作为膳食锌载体使用[10],杨杰等[11]研究表明鱼蛋白小肽螯合锌具有明显的补锌效果和抗氧化效果,与同等剂量的葡萄糖酸锌或硫酸锌效果相当。一些研究报道锌-蛋氨酸(Zn-Met)可以改善包括仔猪[12]和肉鸡在内的动物的表现[13]。与其他低剂量组相比,高剂量的Zn-Met 可以增加肝脏和胫骨中的锌含量[14]。Wang 等[16-17]证明适当剂量的锌-甘氨酸(Zn-Gly)可以提高仔猪锌的组织沉积能力[15],另外还有其他研究发现Zn-Gly 可以提高肉鸡的生长性能和改善肠道形态。
针对玉米醇溶蛋白的研究,目前主要集中于采用酸性蛋白酶、中性蛋白酶和碱性蛋白酶单一或复合酶解玉米蛋白制备玉米活性肽,而基于蛋白酶K对玉米醇溶蛋白的酶解作用鲜有报道。蛋白酶K 是一种丝氨酸蛋白酶,能够切割脂肪族氨基酸的羧基端肽键,将蛋白质的羧基暴露,理论上具有增强蛋白水解物螯合微量元素的潜在能力。并且蛋白酶K 的适用pH 范围广,尤其在强碱性条件下仍具有较高活性,鉴于玉米醇溶蛋白在碱性条件下表现出较好溶解性这一特点,实验采用蛋白酶K 水解玉米醇溶蛋白,以锌离子螯合能力为评价指标优化水解条件,并评价了酶解物清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基能力以及ABTS+·清除能力,以期为今后玉米醇溶蛋白锌离子螯合物的研究开发提供一定理论依据,为玉米醇溶蛋白在食品中的应用提供数据参考。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白(蛋白质含量86.41%),上海麦克林生化科技有限公司;蛋白酶K(40 U·mg-1),北京索莱宝科技有限公司;亮氨酸,Biosharp 白鲨生物科技;磷酸二氢钠、硼酸、硼砂、六亚甲基四胺、无水乙醇,辽宁泉瑞试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis -(3 -ethylbenzthiazoline -6 -sulphonate)free radical,ABTS+·),合肥博美生物科技有限责任公司;十二烷基磺酸钠(SDS)、氢氧化钠,天津大茂化学试剂厂;邻苯二甲醛(OPA)、二甲酚橙,Aladdin;β-巯基乙醇,南京森贝伽生物科技有限公司;硫酸锌、乙二胺四乙酸、水杨酸、硫酸亚铁、H2O2、过硫酸钾,天津河东红岩试剂厂;试剂均为分析纯。
1.1 仪器与设备
THZ-82 A 水浴恒温振荡器,常州润华电器有限公司;SPECORD 210 Plus 全自动紫外可见光谱仪,德国耶拿分析仪器股份公司;DELTA 320 pH 计,梅特勒-托利多仪器有限公司;5 430 R 冷冻离心机,Eppendorf 艾本德中国有限公司。
1.3 方法
1.3.1 玉米醇溶蛋白酶解工艺流程
将玉米醇溶蛋白作为酶解底物,利用蛋白酶K作用于玉米醇溶蛋白羧基端肽键将蛋白质水解,通过单因素实验,考查底物浓度、酶添加量、反应时间和反应温度对玉米醇溶蛋白锌离子螯合能力及水解度的影响。
1.3.2 酶解工艺条件单因素试验
将玉米醇溶蛋白配制成浓度为10、20、30、40、50、60 mg·mL-1的溶液,并用0.2 mol·L-1氢氧化钠溶液将蛋白溶液pH 调至12.0,封膜冷藏备用。称取一定量的蛋白酶K,并配制成2.0、2.4、2.8、3.2、3.6、4.0 U·mg-1的酶溶液,分别反应1、2、3、4、5、6 h、同时考查不同反应温度(45、50、55、60、65、70 ℃)对酶解反应水解度及水解产物锌离子螯合能力的影响,按照1.3.3.1 和1.3.3.2 分别计算水解度和锌离子螯合能力。在最适酶解条件下制备玉米醇溶蛋白水解物,冻干备用。
1.3.3 指标的测定
1.3.3.1 水解度测定
OPA 溶液配制[18]:准确称取2.00 g 十二烷基磺酸钠(SDS),加入30 mL 0.4 moL·L-1的硼酸缓冲液(pH9.5),溶解完全后再加入1 mL,80 mg·mL-1的OPA 溶液(无水乙醇溶解)和200 μL β-巯基乙醇,最后用pH 9.5 的硼酸缓冲液定容至100 mL。此溶液现用现配。
测定方法:首先配制600 μg·mL-1的亮氨酸标准溶液,再将其稀释成浓度为(0、12、18、24、30、36 μg·mL-1)的溶液,不同浓度的稀释液与OPA 试剂等体积混合,精准反应5 min,立即测定混合液在340 nm 处的吸光度值;亮氨酸浓度和吸光度值分别设定为横纵坐标,绘制亮氨酸标准曲线。取1 mL 玉米醇溶蛋白酶解物稀释100 倍,按照上述方法测定稀释酶解物的吸光值。样品中游离氨基的浓度(μmoL·mL-1)根据亮氨酸标准曲线所得公式计算。水解度计算方法如公式(1)。

式中:A 为样品浓度(mg·mL-1),hT为样品蛋白质的总肽键数(7.8 mmol·g-1)
1.3.3.2 Zn2+螯合能力测定
在Wang 等[19]的方法基础上稍加改动测定锌离子螯合能力。
锌离子-肽螯合反应:在50 mL 三角瓶中加入1 mL 0.05 mol·L-1的硫酸锌溶液(乙醇溶解),再缓慢加入10 mL 5 mg·mL-1样品溶液(用体积分数为50%的乙醇溶解1.3.2 获得的水解产物),25 ℃水浴摇床振荡反应1 h,直至生成白色沉淀。
螯合态锌离子含量的测定:将上述反应液中白色沉淀浓缩至近干后加15 mL 无水乙醇,混匀,4 ℃、5 000 r·min-1离心20 min。将沉淀悬浮于蒸馏水中并定容至50 mL。用EDTA 络合滴定的方法确定螯合态锌的含量。吸取20 mL 容量瓶中的溶液至锥形瓶中,分别滴加两滴二甲酚橙指示剂(0.5%水溶液)和数滴质量分数20%的六亚甲基四胺—盐酸缓冲溶液(pH5.0),直至溶液呈稳定的紫色后再加入4 mL 缓冲液,用已标定的0.001 mol·L-1EDTA 溶液滴定至溶液由紫红色变成黄色,并记录EDTA 的消耗量(V)。用蒸馏水代替样品做空白对照,并重复上述试验,记录EDTA 的消耗量(V0)。沉淀中Zn2+含量以及样品Zn2+螯合能力计算方法见公式(2)和(3)。

式中:AP为沉淀中Zn2+含量(mg),P 为样品蛋白质含量(g),C 为EDTA 浓度(0.001 mol·L-1),V 为样品滴定过程中消耗EDTA 的体积(mL),V0为空白试验消耗的EDTA 的体积(mL)。
1.3.4 玉米醇溶蛋白肽螯合物抗氧化实验
在最适反应条件下获得玉米醇溶蛋白水解物,并参照1.3.3.2 中锌-肽螯合反应,制备玉米醇溶蛋白水解物锌离子螯合物(ZK),冻干备用。
1.3.4.1 DPPH 自由基清除率的测定
参考赵聪等[20]和Mehmet 等[21]的方法,准确配制浓度为0.0、2.0、4.0、6.0、8.0、10.0 mg·mL-1的ZK 样品溶液,分别取2 mL 不同浓度的样品溶液于试管中,依次加入1 mL 0.2 mol·L-1磷酸盐缓冲液(pH 6.6),2 mL 0.1 mmol·L-1的DPPH 溶液,混合摇匀,室温下避光静置30 min。于517 nm 波长处测定吸光度,蒸馏水作为空白对照。同时用0.0、0.2、0.4、0.6、0.8、1.0 mg·mL-1的VC 溶液作阳性对照。DPPH 自由基清除率计算方法见公式(4)。

式中:A0为样品或VC 的吸光度,A1为样品或VC 加DPPH 的吸光度,A2为DPPH 的吸光度。
1.3.4.2 羟基自由基清除率的测定
参照TIAN 等[22]和Liu 等[23]的方法,分别取2 mL浓度为0.0、2.0、4.0、6.0、8.0、10.0 mg·mL-1的ZK 样品溶液于试管中,分别依次加入3 mL 蒸馏水、0.5 mL 6 mmol·L-1水杨酸溶液、0.5 mL 6 mmol·L-1FeSO4溶液、1 mL 6 mmol·L-1的H2O2溶液,混合摇匀,室温下避光静置30 min。于510 nm 波长处测定吸光度,蒸馏水作为空白对照。同时用0.0、0.2、0.4、0.6、0.8、1.0 mg·mL-1的VC 溶液作阳性对照。羟自由基清除率计算方法见公式(5)。
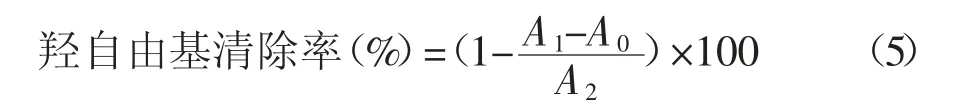
式中:A0为样品或VC 加蒸馏水的吸光度,A1为样品或VC 的吸光度,A2为样品溶液换成等量蒸馏水的吸光度。
1.3.4.3 ABTS+·清除率的测定
ABTS 溶液的配制:用0.2 mol·L-1的磷酸缓冲溶液将0.1 g ABTS+·和0.029 g 过硫酸钾溶解,定容至100 mL,混合后用锡箔纸包紧于25 ℃避光反应16 h备用,吸取2 mL 该反应液和18 mL 磷酸盐缓冲液混合配成ABTS+·储备液,避光储存现用现配。用上述磷酸盐缓冲液稀释ABTS+·储备液,于波长734 nm 处测吸光度值为0.85 左右,即确定为ABTS+·工作液,现用现配。
测定方法:0.1 mL ZK 样品溶液和3.9 mL ABTS+·工作液混匀室温静置10 min,在波长734 nm 处测定吸光度A1,以试样溶剂代替样品溶液测定空白吸光度值A0,以磷酸盐缓冲液代替ABTS+·工作液测得吸光度值A2;VC 做阳性对照[24-26]。ABTS+·清除率计算方法见公式(6)。
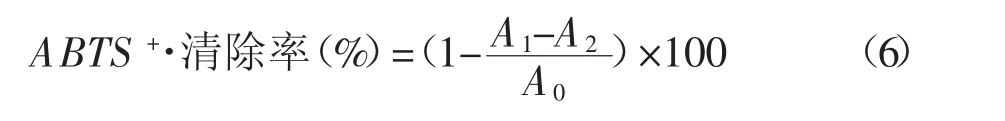
1.4 数据分析
实验数据用Excel 2007 和Origin 8.0 进行数据处理和做图,用SPSS 22.0 进行显著性分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 反应时间对玉米醇溶蛋白Zn2+螯合能力的影响
在反应体系pH 值为12,底物浓度10 mg·mL-1、酶添加量2.8 u·mg-1、反应温度60 ℃条件下,考察反应时间对玉米醇溶蛋白Zn2+螯合能力及水解度的影响,如图1 所示。
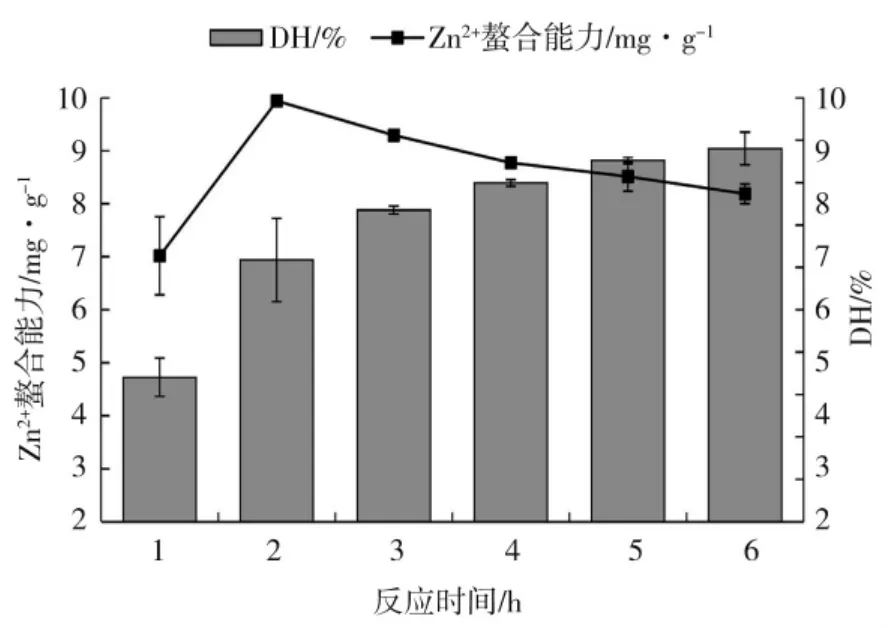
图1 反应时间对玉米醇溶蛋白水解度及其水解物锌离子螯合能力的影响Fig.1 Effect of reaction time on Zn2+chelating ability and degree of hydrolysis of zein and hydrolysate
由图1 可知,随着反应时间增加,水解度呈现逐渐上升且趋于平缓的趋势,而Zn2+螯合能力先增加后下降,在反应2 h 的时候Zn2+螯合能力达到最大值9.95 mg·g-1,此时所对应水解度为6.18%。反应2 h 的Zn2+螯合能力显著高于其他酶解时间玉米醇溶蛋白的螯合能力,故反应最佳时间选为2 h。随着反应时间增加,且初始底物浓度相对较大,酶与底物接触时间延长,接触几率相对较高,故水解度呈现上升趋势;随后底物浓度下降,蛋白酶K 可作用位点减少,酶催化反应趋于平衡状态,水解度成平缓趋势。
2.1.2 底物浓度对玉米醇溶蛋白Zn2+螯合能力的影响
在反应体系pH 值为12,反应时间2 h、酶添加量2.8 U·mg-1、反应温度60 ℃条件下,考察底物浓度对玉米醇溶蛋白Zn2+螯合能力及水解度的影响,如图2 所示。
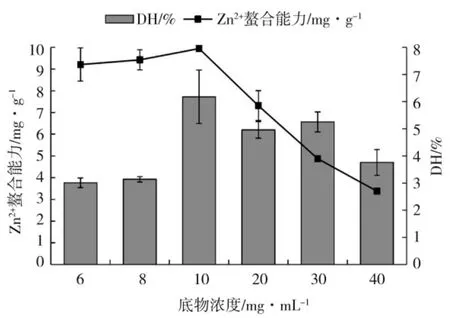
图2 底物浓度对玉米醇溶蛋白水解度及其水解物锌离子螯合能力的影响Fig.2 Effect of substrate concentration on Zn2+chelating ability and degree of hydrolysis of zein and hydrolysate
由图2 可知,随着玉米醇溶蛋白的浓度增加,玉米醇溶蛋白Zn2+螯合能力及水解度呈现先上升后下降的趋势,在玉米醇溶蛋白浓度达到10 mg·mL-1时,Zn2+螯合能力达到最大值9.95 mg·g-1,此时所对应水解度为6.18%,故选定玉米醇溶蛋白浓度为10 mg·mL-1进行后续实验。底物浓度过低,减少底物与酶的结合机会,Zn2+螯合能力及水解度相对低;反应体系分子黏度随着底物浓度增大,蛋白不能充分浸润,即使在加热作用下分子运动相对减缓,不利于蛋白与酶活性部位的结合,多肽也会随之减少,可能与Zn2+结合的分子也产生较少,所以Zn2+螯合能力随着底物浓度增大而降低;玉米醇溶蛋白中可能含有一定的蛋白酶抑制剂,能与蛋白酶K 作用于玉米醇溶蛋白竞争蛋白酶的结合集团,产生竞争性抑制作用,随着玉米醇溶蛋白浓度增大,蛋白酶K 含量相对减少,同时抑制性蛋白酶含量相对会增加,导致玉米醇溶蛋白不能水解完全,水解度出现下降,且Zn2+螯合能力大幅度下降。
2.1.3 酶添加量对玉米醇溶蛋白Zn2+螯合能力的影响
在反应体系pH 值为12,反应时间2 h、底物浓度10 mg·mL-1、反应温度60 ℃条件下,考察酶添加量对玉米醇溶蛋白Zn2+螯合能力及水解度的影响,如图3 所示。
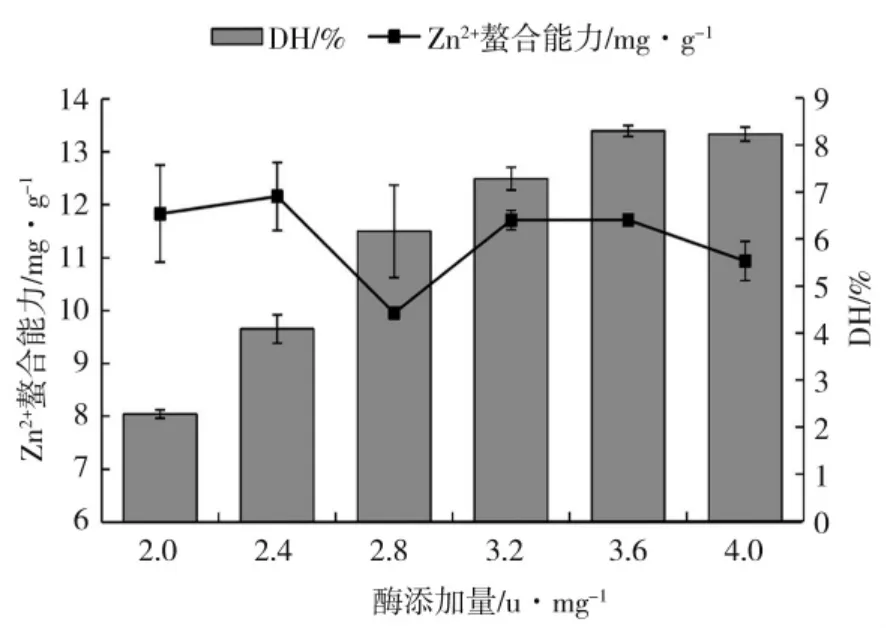
图3 酶添加量对玉米醇溶蛋白水解度及其水解物锌离子螯合能力的影响Fig.3 Effect of enzyme addition on Zn2+chelating ability and degree of hydrolysis of zein and hydrolysate
由图3 可知,在加酶量2.0~2.4 U·mg-1范围内,Zn2+螯合能力呈现小幅度上升的趋势,但是在酶添加量为2.8 U·mg-1时,Zn2+螯合能力突然下降,在加酶量2.8~4.0 U·mg-1范围内呈现先上升后下降的趋势;在酶添加量为2.4 U·mg-1时Zn2+螯合能力相对较高,达到12.16 mg·g-1,此时对应的水解度为4.10%,且从经济角度出发,酶添加量选择2.4 U·mg-1。Zn2+螯合能力突然下降可能是因为在酶添加量为2.8 U·mg-1时可溶性多肽被进一步水解为游离氨基酸,螯合活性也随之降低。水解度随着酶添加量呈现先大幅度增加后趋于平缓的趋势,随着酶添加量不断增加,酶与底物活性部位结合的几率也增加,水解度呈现大幅上升的趋势;随着酶不断增加,玉米醇溶蛋白可作用活性部位相对减少,反应速度降慢,水解度呈现平缓的趋势。
2.1.4 反应温度对玉米醇溶蛋白Zn2+螯合能力的影响
在反应体系pH 值为12,反应时间2 h、底物浓度10 mg·mL-1、酶添加量2.4 U·mg-1条件下,考察反应温度对玉米醇溶蛋白Zn2+螯合能力及水解度的影响,如图4 所示。
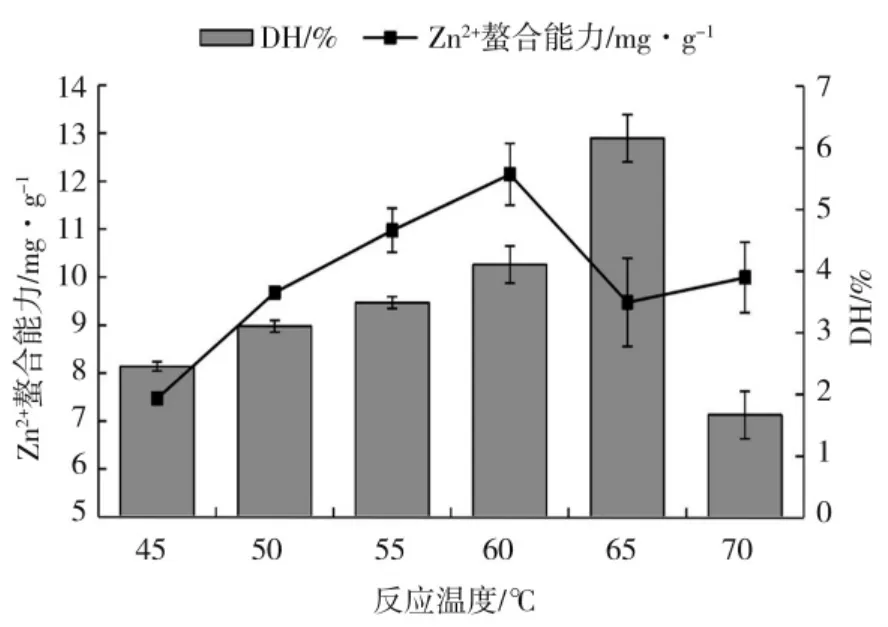
图4 反应温度对玉米醇溶蛋白水解度及其水解物锌离子螯合能力的影响Fig.4 Effect of reaction temperature on Zn2+chelating ability and degree of hydrolysis of zein and hydrolysate
由图4 可知,玉米醇溶蛋白Zn2+螯合能力及水解度随着反应温度呈现先上升后下降的趋势,温度对酶解反应有双重作用,在温度45~60 ℃范围内,温度升高,反应体系分子热运动速度加快,水解度逐步提高,可能产生Zn2+螯合活性较高的多肽,因此水解度和Zn2+螯合能力在此温度范围内逐步升高,Zn2+螯合能力达到最大值12.16 mg·g-1,此时所对应水解度为4.10%;温度继续升高,对蛋白酶K 产生破坏作用,酶活性降低,与玉米醇溶蛋白作用几率减少,产生Zn2+螯合活性较高的多肽含量减少,Zn2+螯合率和水解度也随之降低,故反应温度选在60 ℃。
综上,以玉米醇溶蛋白与Zn2+螯合的能力为主要考察指标,确定的最适反应条件为:玉米醇溶蛋白浓度10 mg·mL-1、酶添加量2.4 U·mg-1、反应温度60 ℃、反应时间2 h。
2.2 玉米醇溶蛋白锌螯合物抗氧化实验结果
2.2.1 玉米醇溶蛋白锌离子螯合物对DPPH 自由基清除效果
由图5 可知,玉米醇溶蛋白锌离子螯合物(ZK)DPPH 自由基清除效果随着其浓度的增加而显著逐步增加,且清除效果显著高于(P<0.5)未反应玉米醇溶蛋白(Zein),在ZK 浓度增大到10 mg·mL-1时,DPPH自由基清除率为88.27%,较之未反应玉米醇溶蛋白的DPPH 清除率(60.10%),提高了28.17%;Vc 溶液DPPH 自由基清除率在其浓度0.2 mg·mL-1时达到最大值84.57%,浓度继续增大时,其清除效果趋于恒定;在ZK 浓度达到8 mg·mL-1时,DPPH 自由基清除率接近Vc 溶液的清除率,当浓度大于8 mg·mL-1时,ZK 的DPPH 自由基清除率效果稍高于Vc 溶液的。木瓜蛋白酶解油茶籽粕蛋白所得水解物对DPPH 自由基清除效果达到85%以上,较ZK 对DPPH 自由基清除效果稍显著,且有较好的金属离子螯合能力[27];刘晓霏[28]采用碱性蛋白酶酶解玉米黄粉,其酶解产物DPPH 清除率达到77.15%,研究中ZK 的DPPH清除效果显著优于基于碱性蛋白酶水解的玉米黄粉酶解产物。
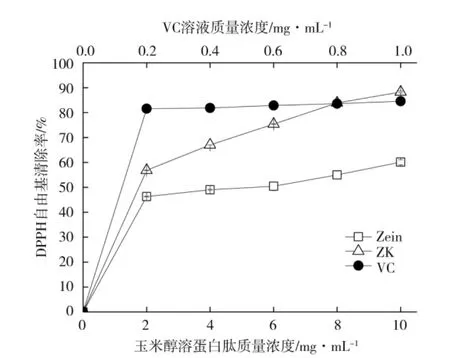
图5 玉米醇溶蛋白及其锌离子螯合物对DPPH 自由基清除效果Fig.5 DPPH radical scavenging capacity of zein and zein-Zn2+chelate
2.2.2 玉米醇溶蛋白锌离子螯合物对羟自由基清除效果
由图6 可知,ZK 的羟自由基清除效果显著优于未反应玉米醇溶蛋白(Zein)(P<0.05),且随着ZK 浓度增大羟自由基清除效果显著增强,当ZK 的浓度增大到10 mg·mL-1时,羟自由基及清除率达到88.60%,而未反应玉米醇溶蛋白的清除率为65.46%,提高了23.14%,ZK 羟自由基清除效果增强趋势同于Vc 溶液,但Vc 溶液清除效果优于ZK。1.0 mg·mL-1的Vc溶液羟自由基清除率达到94.97%,有极强的羟自由基清除效果。胡二坤等[29]采用碱性蛋白酶酶解玉米醇溶蛋白,酶解产物的羟自由基清除效果达到60%~70%,比较而言,实验中ZK 的羟自由基清除效果更显著。
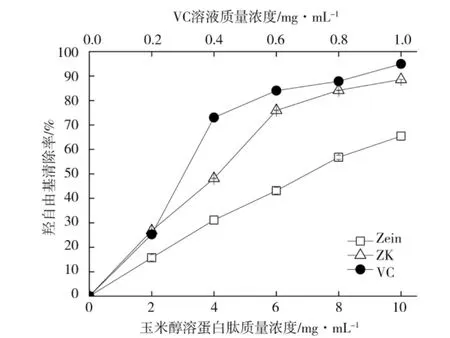
图6 玉米醇溶蛋白及其锌离子螯合物对羟自由基清除效果Fig.6 Hydroxyl radical scavenging capacity of zein and zein-Zn2+chelate
2.2.3 玉米醇溶蛋白锌离子螯合物对ABTS+·清除效果
由图7 可知,10 mg·mL-1的ZK 和未反应的玉米醇溶蛋白ABTS+·清除率分别为77.22%和61.65%,ZK 的ABTS+·清除率相对于未反应的玉米醇溶蛋白显著提高了15.57%,但均低于相同浓度下Vc 对ABTS+·的清除效果。研究表明,蛋白质的抗氧化活性与其分子量和疏水性有显著相关性[30]。李雪芬等[31]研究发现蚕豆蛋白酶解物的铜离子螯合活性越高,其抗氧化活性越高。代衍峰[30]采用碱性蛋白酶酶解玉米蛋白,浓度为10 mg·mL-1水解物对ABTS+·清除率58.00%,略低于本研究中同浓度的ZK 对ABTS+·的清除效果。同是植物蛋白,400 mg·mL-1的玉米胚芽粕清蛋白酶解产物对ABTS+·的清除率为82.87%[32],也逊色于研究中ZK 的清除效果。
3 结论
选用蛋白酶K 对玉米醇溶蛋白进行单因素实验,实验确定了以Zn2+螯合能力为指标的蛋白酶K水解玉米醇溶蛋白的最适条件为:在pH 12 的反应条件下,底物浓度10 mg·mL-1、酶添加量2.4 U·mg-1、反应温度60 ℃、反应时间2 h。在最佳酶解条件下玉米醇溶蛋白Zn2+螯合能力达到12.16 mg·g-1,对应水解度为4.10%。在抗氧化实验中,玉米醇溶蛋白锌离子螯合物清除DPPH 自由基、羟自由基和ABTS+·的效果均显著优于未反应的玉米醇溶蛋白,为今后新型膳食补充剂研究提供理论及数据支持。
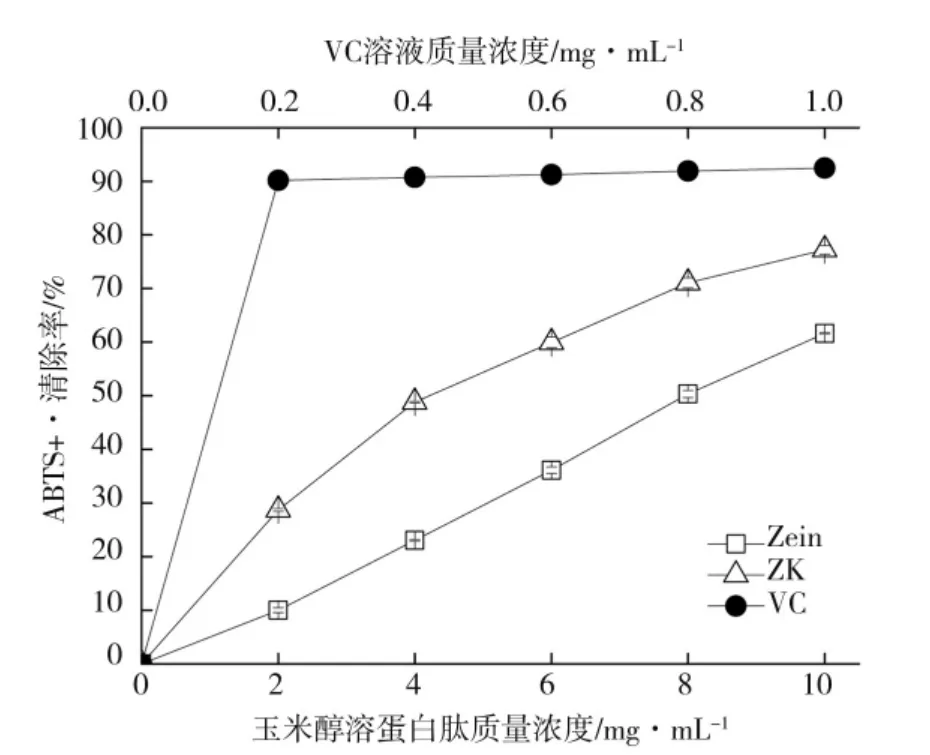
图7 玉米醇溶蛋白及其锌离子螯合物对ABTS+·清除效果Fig.7 ABTS+·scavenging capacity of zein and zein-Zn2+chelate

