DTA-6 对甜叶菊形态建成、酶活性、产量及品质的影响
冯胜杰,王新欣,贾鹏宇,王诗雅,卢洁春,左官强,刘雅,黄文婷,冯乃杰,2,郑殿峰,2
(1.黑龙江八一农垦大学农学院,大庆 163319;2.广东海洋大学农学院;3.国家杂粮工程技术研究中心)
甜叶菊(Bertoni)是菊科的多年生草本植物。在巴拉圭(和巴西),甜叶菊的叶子自几百年前就被当地人称为“甜食”[1-3],其主要用作茶、药品等的添加剂。存在于叶子中的甜菊醇糖苷作为主要次级代谢物是甜叶菊叶片甜度的基础,并且是甜味剂的重要成分。此外,甜菊甙和杜克糖甙也是甜叶菊的次级代谢物,但其含量低于甜菊醇糖苷[4-6]。甜菊甙是甜叶菊干叶中主要的甜味成分(4.13%),而其他重要的化合物为:甜菊双糖甙,瑞鲍迪甙A(2.4%),B,C(1.2%),D,E,F 和杜克甙A(0.3%)。瑞鲍迪甙A/甜菊醇糖苷比率被认为是一个很好的反映甜味的品质指标。甜菊甙是一种高甜度、低热值的非发酵性天然甜味剂,其甜度为蔗糖的200~300 倍,而热量只有蔗糖的1/300,提取于菊科宿根多年生草本植物的甜叶菊茎叶中。甜叶菊叶片中的各种次级代谢产物的合成在开花以后会显著降低,因此为了获得更高含量的甜菊醇糖苷,甜叶菊需要在开花前收获叶片[7]。甜菊甙是一种新型糖源,具有重要的保健功能,如促进新陈代谢、强壮身体和降低血压等,目前在食品、医疗、日用品等领域得到了广泛的应用[8-9]。S.Gregersen[10]研究表明在甜叶菊叶的各时期发现了浓度不同的有甜味的化合物甜菊醇糖苷。在对甜叶菊研究过程中,发现了甜菊甙活性以及几种酶活性。Bailey 和McHargue[11]研究表明番茄果实和叶片中过氧化物酶活性随着叶龄的增加而增加,在衰老过程中活性逐渐下降。有研究表明[12-14],应用植物生长调节剂可控制植株的生长发育,改善植株的光合作用,调控植物的生理代谢功能以及提高作物的产量和品质。张明才等[15]研究表明,DTA-6[16-17]可提高花生器官的生理代谢功能,增加花生产量,改善花生品质。目前大多数研究主要针对甜菊醇糖苷提纯方面做出了研究,而植物生长调节剂在甜叶菊栽培中的应用尚未见报道。因此,研究引入植物生长调节剂DTA-6 并开展了其作用效果和机理研究。试验在大田条件下,探讨调节剂DTA-6 调控甜叶菊形态建成,生理代谢及甜叶菊产量品质的作用机理,进而为调节剂DTA-6 在甜叶菊上的应用提供科学理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验品种
供试品种为惠农3 号,黑龙江省海林市海林农场的主栽品种。
1.1.2 试验地基本情况
试验田地位于黑龙江省海林市海林农场第五作业区(东经128°47′30″~129°7′30″,北纬44°15′~44°25′),试验地气候为大陆性季风气候,土质以岗地白浆土为主,有机质含量27 g·kg-1,含氮为98 mg·kg-1,全磷为94 mg·kg-1,含水解氮为58.8 mg·kg-1,有效磷为15 mg·kg-1。年平均≥10 ℃活动积温2 500 ℃左右,无霜期136 d 左右,年降水量530~550 mm。
1.1 试验设计
试验采用大田试验方法,随机区组试验设计,使用植物生长调节剂2-N,N-二乙氨基乙基己酸酯(DTA-6)进行叶面喷施处理,浓度分别为12.5 mg·L-1(D12.5)、60 mg·L-1(D60)、300 mg·L-1(D300),以叶面喷施清水为对照(DCK)。试验设置四次重复,于8 月15 日(移栽后75 d)进行叶面喷施。小区为6 行区,垄宽0.65 m,行长8 m,小区面积为31.2 m2,区间过道1 m,共16 个小区。于5 月25 日移栽大田,每公顷的保苗株数在18 万株。田间作业均同当地常规生产。
1.3 测定项目与方法
1.3.1 取样及测定方法
(1)形态指标测定:于8 月20 日、9 月7 日、9 月22 日(分别为移栽后80、98、113 d)进行取样,每个处理选取大小长势一致的植株4 株,测量株高、茎粗后,按茎、叶分样,105 ℃杀青30 min,80 ℃烘干至恒重后分别称其干物质量。
(2)生理指标测定:采取植株倒5 叶片,在液氮中速冻30 min,置于-40 ℃低温冰箱中贮存。
(3)产量的测定:在9 月22 日进行收获测产,在每试验小区取1 m2进行测产,放在室内阴干脱叶后进行甜叶菊干叶称重。
1.3.2 酶液提取方法
过氧化物(POD)酶活性的提取和测定采用Sigma 法[18]测定。已知量的新鲜甜菊叶在预冷的研钵中研磨并在50 mmol·L-1预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆。转入离心管中在4 ℃、12 000 g、20 min 的条件下进行离心,取出上清液即为酶粗提液,用于过氧化物酶活性的测定。
多酚氧化(PPO)酶活性的提取和测定方法是根据曹建康等[19]编著的《果蔬采后生理生化实验指导》测定。已知量的新鲜甜菊叶在预冷的研钵中研磨并在含有4% PVPP、1 mmol PEG 和1%TritonX-100 的已知浓度的提取缓冲液中研磨。转入离心管中在4 ℃、12 000 g、20 min 的条件下进行离心,取出上清夜即为酶粗提液,用于多酚氧化酶活性的测定。
1.3.3 酶活性测定
过氧化物酶活性,反应混合物含有在0.2 M 磷酸盐缓冲液(pH6.0)中的愈创木酚,30%H2O2和40 μL酶提取物。通过加入相应的酶开始反应。氧化染料的颜色变化在30 s 的时间间隔在470 nm 读取1 min,重复4 次。过氧化物酶活性单位为u·g-1FW。
多酚氧化酶的活性,反应混合物含有50 mmol·L-1乙酸-乙酸钠缓冲液(pH5.5)、邻苯二酚溶液和50 μL酶提取物。将内容物混合并立即开始计时。将反应混合液倒入比色杯中,置于分光光度计样品室中。以蒸馏水为参比,在反应15 s 时开始记录反应体系在波长420 nm 处吸光度值,作为初始值,然后每隔1 min记录一次,连续测定,至少获取6 个点的数据,重复4次。多酚氧化酶活性单位为ΔOD420/min·g-1。
1.3.4 瑞鲍迪甙A 和甜菊糖苷的提取及测定
酶液提取:称取1 g 干样叶片粉末,加入8 mL 热水,混匀后进行30 min 超声处理,离心4 000 g,15 min,4 ℃进行离心,取上清液,重复3 次。3 次上清液混合均匀待用,进行色谱分析。
检测方法:通过使用安捷伦1 200 型液相色谱仪进行液相色谱分析,采用XDB-NH3(4.6×250 mm,5 μm)色谱柱,柱温40 ℃,流速1 mL·min-1,流动相采用等度洗脱模式,流动相乙腈/水组成比为80∶20(v/v),检测器为紫外-可见检测器,检测波长210 nm。
1.4 数据分析与处理
试验数据的处理与分析采用了SPSS22.0,显著性和极显著性的检验采用Duncan’s 新复极差法,数据整理与图表的绘制是通过Microsoft Office EXCEL2010 进行绘制完成。
2 结果与分析
2.1 喷施DTA-6 对甜叶菊形态建成的影响
如表1 所示,在整个生长期,株高逐渐增加。其中在8 月20 日,叶面喷施D12.5 的处理与CK 相比株高极显著升高,而其他处理则与CK 相比株高无明显差异;在9 月7 日,各处理与CK 相比株高并无显著变化;在9 月22 日,D60 比CK 株高显著升高,而其他处理则与CK 相比株高无明显差异。

表1 叶喷DTA-6 处理对株高的影响Table 1 Effect of leaf DTA-6 spray treatment on plant height
如表2 所示,在整个生长期,茎粗逐渐增粗。其中在8 月20 日,叶面喷施D12.5 的处理与CK 相比株高极显著增粗,而其他处理则与CK 相比茎粗无明显差异;在9 月7 日,D12.5 的处理与CK 相比株高显著增粗,而其他处理则与CK 相比茎粗均无显著差异。在9 月22 日,D12.5 比CK 株高显著增粗,而其他处理则与CK 相比茎粗无明显差异。

表2 叶喷DTA-6 处理对茎粗的影响Table 2 Effect of leaf DTA-6 spray treatment on stem diameter
如表3 所示,在整个生长期,分枝数逐渐增加。其中在8 月20 日,叶面喷施D12.5、D300 处理与CK相比分枝数均极显著增加,而D60 处理则与CK 相比无明显差异;在9 月7 日,各处理与CK 相比分枝数均无显著差异;在9 月22 日,D12.5 处理与CK 相比分枝数显著增加,D60 处理与CK 相比分枝数极显著增加。

表3 叶喷DTA-6 处理对分枝数的影响Table 3 Effect of leaf DTA-6 spray treatment on number of branches
如表4 所示,在整个生长期,单株茎重逐渐增加。其中在8 月20 日与9 月7 日,各处理则与CK 相比单株茎重均无明显差异;在9 月22 日,D60 处理与CK 相比单株茎重显著增加,而其他处理与CK 相比均没有显著变化。

表4 叶喷DTA-6 处理对单株茎重的影响Table 4 Effect of leaf spray DTA-6 treatment on stem weight
如表5 所示,在整个生长期中,除在9 月7 日调查时D12.5 处理与CK 相比降低,其余各处理与CK相比均增加,但均没有达到显著水平。

表5 叶喷DTA-6 处理对单株叶重的影响Table 5 Effect of leaf DTA-6 spray treatment on leaf weight per plant
2.2 喷施DTA-6 对叶片中过氧化物酶活性的影响
随着甜叶菊的抗逆性的增加,过氧化酶活性逐渐降低。喷施调节剂DTA-6 后,各处理的过氧化物酶活性均有变化。如图1 所示,过氧化物酶活性变化为在整个生长期中,氧化物酶(POD)活性呈现先升高后降低的趋势。其中在8 月20 日,各处理中过氧化物酶活性与CK 相比显著提高,并且均达到极显著水平;在9 月7 日,各处理中过氧化物酶活性与CK 相比显著提高,并且均达到极显著水平;在9 月22 日,喷施D12.5 的处理与CK 相比过氧化物酶(POD)活性极显著增加,喷施D300 处理与对照相比过氧化物酶(POD)活性极显著降低,而喷施D60 的处理与CK相比活性显著降低。
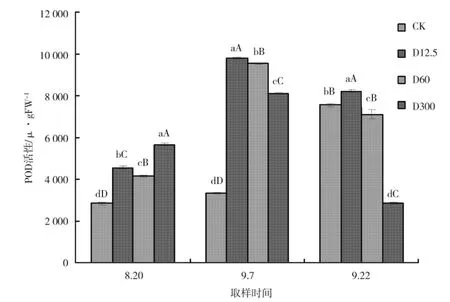
图1 喷施DTA-6 对叶片中过氧化物酶活性的影响Fig.1 Effect of DTA-6 spray on peroxidase activity in leaves
2.3 喷施DTA-6 对叶片中多酚氧化酶活性的影响
甜叶菊的抗逆性与多酚氧化酶活性呈负相关。喷施调节剂DTA-6 后,各处理的多酚氧化酶活性均有变化。如图2 所示,在整个生长期中,氧化物酶(POD)活性变化呈现先升高后趋于平缓的趋势。其中在8 月20 日,D12.5、D60 处理与CK 相比多酚氧化酶活性极显著降低,而D300 处理多酚氧化酶活性降低,但未达到显著水平;在9 月7 日与9 月22 日,各处理多酚氧化酶活性与CK 相比均极显著降低。
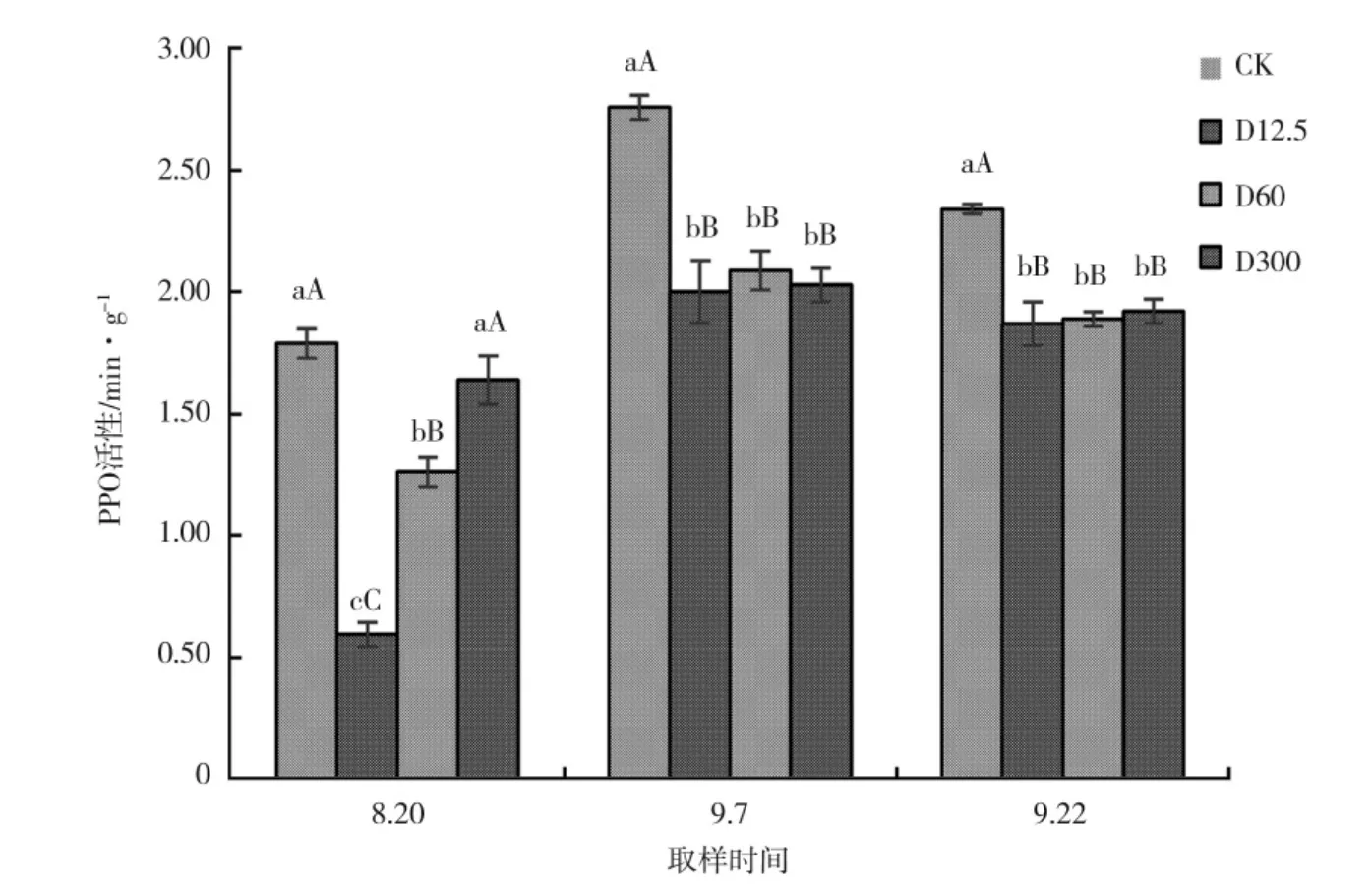
图2 喷施DTA-6 对叶片中多酚氧化酶活性的影响Fig.2 Effect of DTA-6 spray on polyphenol oxidase activity in leaves
2.4 喷施DTA-6 对叶片中瑞鲍迪甙与甜菊苷比值(ReA/ST)的影响
ReA/ST 的比值越高证明甜叶菊品质越好。喷施调节剂DTA-6 后,各处理的ReA/ST 的比值间具有一定的差异。如图3 所示,在8 月20 日,D12.5 处理与CK 相比极ReA/ST 显著提高,而其他处理与CK相比均极显著降低;在9 月7 日,各处理间叶片中ReA/ST 与CK 相比均极显著降低;在9 月22 日,各处理间叶片中ReA/ST 与CK 相比均极显著提高,而D60 处理的ReA/ST 最大。
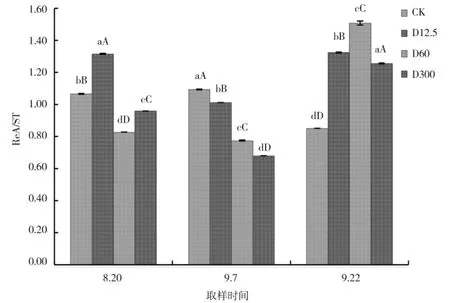
图3 喷施DTA-6 对瑞鲍迪甙与甜菊苷比值的影响Fig.3 Effect of DTA-6 spray on the ratio of rebaudioside and stevioside
2.5 喷施DTA-6 对甜叶菊产量的影响
根据表6 可以看出,在收获测产时,各处理于CK 相比均有增加,其中D12.5 处理增加了3.8%;D60 处理增加了11.2%,并且差异达到了显著水平;D300 处理增加了8.0%。

表6 喷施DTA-6 对甜叶菊产量的影响Table 6 Effect of spraying DTA-6 on Stevia yield
3 讨论
POD 酶是植物重要的保护性酶[20-22],许多植物可以通过此类酶防御系统来清除遭受胁迫而产生的活性氧,从而使植物维持正常的生长发育。过氧化物酶广泛存在于植物体中,是一种活性较高的酶。在植物生长发育过程中过氧化物酶活性不断发生变化。一般表现为老化组织中活性较高,幼嫩组织中活性较弱,所以过氧化物酶可作为组织老化的一种生理指标[23-24]。多酚氧化酶(PPO)是呼吸链末端氧化酶之一,它参与多酚类物质的氧化,在植物植株的防御保护体系中起重要作用[25-26]。多酚氧化酶也是生物质体的自源代谢酶类,能够长期维持生物体的生自体次生代谢的平衡[27-28]。甜叶菊整株含有糖苷,以其叶片甜度最高,其安全性早已得到FAO 和WHO 等国际组织的认可,因而甜叶菊醇糖苷已被广泛应用于食品、药品、肥料以及饲料等行业[29-30]。有研究发现[31-32],在植物的幼嫩组织和器官中转化酶的活性较高,转化酶活性会随着组织和器官的成熟而降低。研究指出,叶面喷施植物生长调节剂DTA-6 可以使甜叶菊叶片中的POD 酶和PPO 酶活性呈现先升高后降低的趋势,并且D60 处理达到极显著水平,这一结果与前人研究表现相同,但是关于调节剂DTA-6 具体对PPO 酶与POD 酶活性的调控过程可能还有许多其他因素在起作用,如基因调控、信号转导以及植物内源激素系统的调控等诸多方面,其有关机理尚待深入研究。Saibi 等[33]使小麦中DHN-5 在拟南芥中超表达,结果表明,DHN-5 通过调控拟南芥中抗氧化酶的活性,增加了过氧化物酶活性,这与试验的结果表现有差异,推断调节剂对甜叶菊的作用可能是多基因共同调控的结果,今后还需进一步挖掘相关基因,从而更好地从分子水平揭示化学调节剂促进甜叶菊品质及产量建成的调控机理。
4 结论
试验通过叶喷处理,初步筛选出了对甜叶菊产量提高、品质改善有较好效果的植物生长调节剂S3307 浓度为50 mg·L-1,该处理在叶片成熟期降低了甜叶菊叶片中POD 酶和PPO 酶活性,提高了甜叶菊中ReA/ST,增加甜叶菊产量,有利于甜叶菊植株更好地生长发育。证明了化学调控技术在对提高甜叶菊品质及其产量方面具有发展的潜力。

