小儿胸膜肺母细胞瘤的诊断与治疗分析
李小兵 张儒舫 沈 立 龚 瑾 谢业伟
胸膜肺母细胞瘤(pleuropulmonaryblastoma,PPB)以胚胎间质为特征,没有上皮组织结构,是一种极为罕见的恶性肿瘤。 1988 年Manivel 等[1]观察到此类肿瘤不仅可发生于肺,也可发生于纵隔及胸膜,因此建议将此类肿瘤单独分类,并称其为PPB。本文旨在回顾性分析上海市儿童医院自2013 年10月至2017 年6 月收治的6 例PPB 患儿的临床特征,以提高临床医生对PPB 的认识。
材料与方法
6 例中男3 例,女3 例;年龄范围1 岁2 个月至10 岁。 早期临床表现为:咳嗽、发热2 例;咳嗽、胸痛1 例;咳嗽、气促1 例;胸闷、气促1 例;右肩疼痛、腹痛1 例。 术前均行胸部X 线和CT 检查。 影像学表现为:胸部巨大占位4 例;胸部巨大占位伴肺不张、大量胸腔积液1 例;合并右肺中上叶膨胀不全、部分实变1 例。
手术方法:采用静吸复合全身麻醉,90°健侧卧位切开患侧(其中3 例巨大肿瘤患儿采用90°健侧卧位后指脉氧饱和度低于80%,改采用30°~45°侧卧位,同时高频通气,维持指脉氧饱和度高于95%,顺利开胸后再调整为90°健侧卧位)。 3 例患儿术中发现肿瘤与胸壁及肺组织粘连严重,无法完整剥离,术中出血较多,予肿瘤大部分切除的同时行部分肺叶切除及肺叶修补术。 2 例患儿肿瘤有包膜,颜色苍白,呈鱼肉状,质地脆,血运丰富,发自于肺叶并与邻近肺叶、胸腔壁、膈肌粘连生长。 仔细剥离肿瘤与肺组织粘连处,肉眼完整切除肿瘤,其中1例同时行肺叶修补术。 1 例术前诊断为CCAM,胸腔镜下探查见肺组织与胸壁及右肺中叶、下叶粘连严重,腔镜下完整游离困难,延长腔镜切口,在胸腔镜辅助下完整切除病变的右肺上叶。 1 例肿瘤复发患儿接受第二次手术时,术中出现手术创面大量渗血,循环功能不稳定,遂中断手术转回重症监护室。

图1 典型病例一照片 A:术前胸部CT 检查结果示右侧胸腔占位,气管向健侧移位,心脏受压; B:术后第3 天床旁胸部X 线片检查结果,可见肿瘤切除术后右肺舒张满意,胸腔引流管在位(箭头);C:术后1 周胸部CT 检查结果可见右肺舒张满意,气管居中; D:术后1 个月床旁胸部X 线片检查结果,可见右侧大量胸腔积液并出现右侧胸腔占位,气管向健侧移位;E:术中手术照片,典型特征为巨大肿瘤与胸壁粘连;F:切除的部分肿瘤组织,实性,无完整包膜; G:术后病理切片;电镜下观察肿瘤组织由纤毛上皮腺管及恶性间叶成分构成(HE 染色,×40); H:术后病理切片免疫组化染色提示细胞角蛋白阳性; I:术后病理切片免疫组化染色提示结蛋白阳性Fig.1 Preoperative and postoperative image of Case No.1

图2 典型病例二照片 A:术前胸部CT 检查结果,可见右中上肺野透亮度增高及多发大小不等囊样透亮影,心脏受压向左侧移位; B:术后当天床旁胸部X 线片检查结果,可见肿瘤切除术后右肺舒张基本满意,气管插管末端位于第2 胸椎,胸腔引流管在位; C:术后3 天床旁胸部X 线片检查结果,可见肿瘤切除术后右肺中叶局限性不张,胸腔引流管在位; D:术后3 天床旁胸部X 线片检查结果,可见肿瘤切除术后右肺舒张较好; E:术后1 年胸部CT 检查结果,典型特征为双肺舒张满意,未见肿瘤复发; F:术中胸腔镜下照片,典型特征为病变肺叶颜色较正常肺组织灰暗; G:术后病理切片电镜下观察肿瘤组织由纤毛上皮腺管及恶性间叶成分构成(HE 染色,×40); H:术后病理切片免疫组化染色提示细胞角蛋白阳性; I:术后病理切片免疫组化染色提示结蛋白阳性Fig.2 Preoperative and postoperative image of Case No.2
结 果
6 例中4 例术前伴严重呼吸困难,手术后症状短暂缓解,其中1 例家长拒绝化疗,术后1 个月肿瘤复发,再次出现明显呼吸困难表现,接受二次手术后死亡(图1)。 3 例术后仍有呼吸困难症状,家属放弃化疗,最终死亡;1 例术前呼吸困难不明显患儿术后症状得到进一步改善,接受阿霉素、长春地辛、环磷酰胺、顺铂化疗效果较理想,已随访34 个月,一般状况较好,定期复查胸部CT未见肿瘤复发、转移,生长发育正常,活动情况与正常儿童无显著差异;1 例Ⅰ型PPB 患儿未接受化疗,已随访18 个月,定期随访胸部CT 未见复发、转移,生长发育正常(图2)。 术后早期并发症:胸腔积液3 例,出血2例,对症处理后均顺利康复。 病理结果:1 例I 型PPB 肿瘤为囊性,表现为较薄的含气囊肿,内部可见细分隔;其余5 例Ⅲ型PPB 均为实性。 误诊情况:3例首诊为肺炎;1 例首诊为胸腔积液;1 例首诊为CCAM,术前CT 提示为CCAM,术后经病理证实为Ⅰ型PPB。
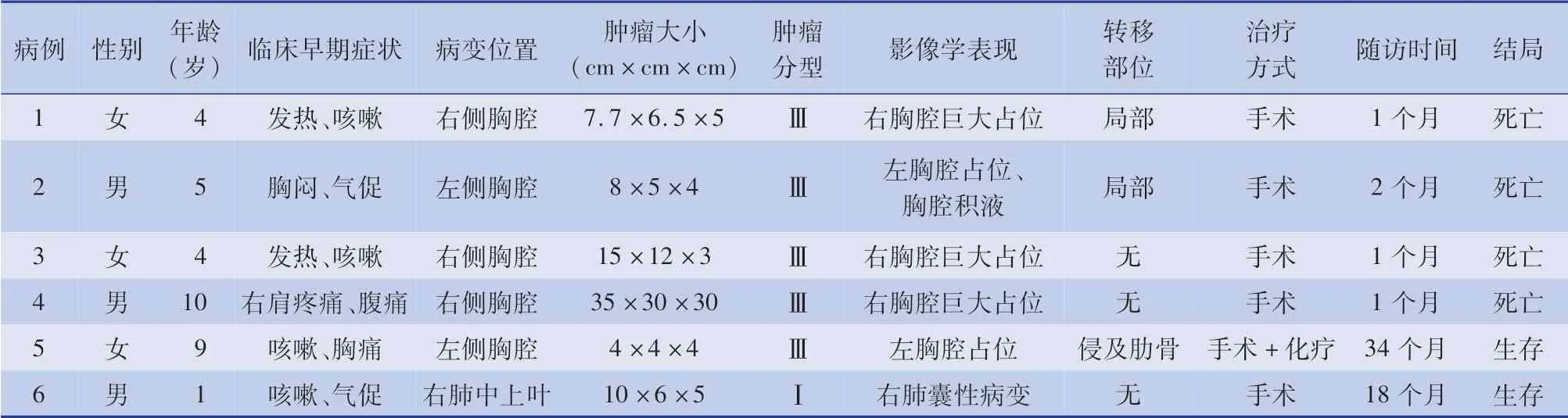
表1 胸膜肺母细胞瘤患儿的临床特征与术后转归Table 1 Clinical characteristics and postoperative outcomes of children with pleuropulmonary blastoma
讨 论
PPB 是一种极为罕见的、具有高度侵袭性的恶性肿瘤,好发于6 岁以下儿童,偶尔也可发生于成人[2,3]。 发病率通常无性别差异,占全部肺母细胞瘤的19%~30%,约占儿童肺部病变的2. 3%[4]。最近研究表明,DICER1(定位在14 号染色体q 臂)的基因突变可导致家族性PPB 的爆发,这是一种较为罕见的PPB[5,6]。 若患儿存在囊性肾瘤、卵巢性皮质基质肿瘤、膀胱或子宫颈胚横纹肌肉瘤时,应当引起临床医生的注意,因为此种情况下DICER1基因可能已经突变,这会在一定程度上增加患PPB的风险,故应积极进行基因突变检测[7]。 PPB 通常位于肺边缘,但也可能位于肺外(包括胸膜壁层、纵膈腔、胸部大血管区域淋巴结和横膈膜),可发生在脑部、骨骼、肝脏、胰腺、肾及肾上腺等部位的转移[8]。 近年有文献报道1 例16 月龄患儿被侵及心脏,并成功接受手术治疗的报道[9]。
一、PPB 患儿的临床表现与诊断
小儿PPB 常表现为发热、咳嗽、胸痛等非特异性症状。 PPB 大部分起源于肺外,若伴有呼吸困难,多考虑为肿瘤体积过大造成的患侧肺不张。 Ⅱ、Ⅲ型PPB 病灶常可累及纵隔,导致大血管和心脏出现移位;累及邻近肺组织及胸膜导致胸腔积液。 大多数患儿于6 岁以内发病,平均发病年龄3.2 岁,约25%患儿有家族倾向。 本组患儿男女比例为1 ∶1,临床表现为咳嗽、发热、胸痛等,1 例伴肺不张、胸腔积液表现。 胸部CT 检查是常见的诊断方法,磁共振主要用于脑部和骨骼扫描诊断有无远处转移。胸部CT 检查对于Ⅱ型和Ⅲ型PPB 具有鉴别诊断的作用,但对于Ⅰ型PPB 与CCAM 鉴别较为困难。 Ⅱ型和Ⅲ型PPB 的胸部CT 表现为肺部巨大占位病变,病变可以是囊性、实性或囊实性。 小儿PPB 无特异临床表现,少数患儿甚至无症状,临床上容易误诊,以误诊为肺炎最为常见,确诊依靠病理诊断。本组6 例患儿中5 例发生误诊,其中3 例首诊为肺炎,1 例首诊为胸腔积液,1 例首诊为CCAM。
二、PPB 临床病理分型与鉴别诊断
临床上,根据大体标本和镜下特点将PPB 分为3 型。 Ⅰ型PPB 为囊肿型,纯囊性病变;Ⅲ型PPB为实体型,无上皮内衬空间;Ⅱ型PPB 是Ⅰ型和Ⅲ型的混合型,由固体和囊性区域组成。 囊性成分被覆以良性上皮(可能是纤毛上皮)。 镜下不但可见横纹肌肉瘤成分,还可见纤维肉瘤、恶性软骨结节等。 大多数肿瘤细胞波形蛋白(vimentin)阳性表达。 被覆囊腔的呼吸道上皮胞和陷入肿瘤实质区内的含气腔隙只阳性表达细胞角蛋白(cytokeratin,CK)。 横纹肌母细胞和肉瘤阳性表达肌特异性肌纤维蛋 白(muscle specific actin, MSA) 和 结 蛋 白(desmin)。 PPB 在病理形态上应与肺母细胞瘤、胚胎性横纹肌肉瘤、炎性肌纤维母细胞瘤、原始神经外胚层肿瘤等相鉴别。 ①肺母细胞瘤,大多见于成年人,以咳嗽和痰中带血为主要症状。 常可见细胞核上或细胞核下细胞质内空泡,细胞中糖原丰富,多排列呈管腔样,散在分布于幼稚间叶细胞中,间叶成分较多,细胞为圆形或短梭形,可有黏液样变,部分间质可以向骨骼肌、软骨及骨分化。 ②胚胎性横纹肌肉瘤,多发生在婴幼儿期,以头颈、腹膜后、泌尿生殖系统部位常见,躯干、胸腔少见。 主要为原始未分化间叶成分和早期幼稚发育阶段的横纹肌肌母细胞而无其他肉瘤成分。 ③炎性肌纤维母细胞瘤,发病不受年龄和性别限制,可发生于任何脏器,绝大部分临床过程表现良性,病程惰性、迁延;少数可呈侵袭性生长,易复发,甚至远处转移;个别患儿可自发消退。 由梭形的肌纤维母细胞构成,伴有浆细胞、淋巴细胞、嗜酸性细胞浸润。 ④原始神经外胚层肿瘤,好发于儿童及青少年,发病部位以骨和软骨组织多见。 由小圆形及短梭形的原始细胞构成,弥漫分布,可见Homer-Wright 假菊形团。 PPB 的临床侵袭性与病理类型相关,Ⅰ型总的生存率为80%~85%,Ⅱ型和Ⅲ型生存率为45%~50%[10]。 Ⅱ型、Ⅲ型容易发生复发和远处转移。 本组6 例患儿中5 例为Ⅲ型,1 例为Ⅰ型。 4 例在半年内死亡,2 例随访中,目前未发生复发和远处转移。
三、PPB 的治疗方法
治疗方案取决于肿瘤类型和临床症状,目前国际上治疗PPB 的常用方案包括手术、化疗与放疗[11]。 放疗治疗PPB 的效果尚不明确,有作者认为其仅限于治疗高危患儿,以尽可能减少长期心脏损伤的可能[12]。 目前大多数学者认为Ⅰ型PPB 不需要化疗;Ⅱ型、Ⅲ型和不能完整切除的PPB 患儿均需要术后联合化疗,有早期复发和远处转移的患儿预后极差。 张大伟等[13]报告治疗PPB 完整切除肿瘤是治疗的关键,对于不能完整切除者和Ⅱ、Ⅲ型PPB 要联合放、化疗。 高欣凤等[14]研究认为治疗PPB 应制定个体化治疗措施,早期完整手术切除,必要时辅助化疗。 而Zahir 等[15]主张先采用化疗以减少肿瘤的大小,再给予手术切除,术后再行化疗的方法。 PPB 常规需开胸手术,马丽霜[16]等报告胸腔镜手术治疗CCAM 是安全可行的。 Ⅰ型PPB 与CCAM 术前CT 相似,近年也有采用胸腔镜下肺叶切除术治疗Ⅰ型PPB 的报告。 本组6 例患儿中1例在胸腔镜辅助下完成。 本组病例术前伴有严重呼吸困难的PPB 患儿,手术只能暂时改善症状;未出现严重呼吸困难患儿,术后化疗效果较好。 1 例Ⅰ型PPB 患儿误诊为CCAM,手术后确诊,预后较好。 PPB 患儿家长报告与正常儿童家长报告对比:疼痛和恶心呕吐得分与正常儿童无显著性差异(P>0.05),其余项目得分正常儿童均有显著性差异(P<0.05),显示PPB 患儿生活质量处于较低水平。
总之,小儿PPB 临床表现无特异性,Ⅰ型PPB易误诊为CCAM,术后预后佳,Ⅱ、Ⅲ型PPB 患儿预后不佳。 早期发现、早期手术、后续正规化疗是治疗的主要方法。 由于本组临床病例较少,有效治疗方案尚有待于进一步研究证实。

