扶芳藤总三萜对衰老小鼠血清及组织T-AOC、CAT、GSH-PX表达的影响及意义
温奇龙,银喆,罗育,蔡丹昭
1.广西医科大学基础医学院,广西 南宁 530021;
2.广西医科大学广西高校生物分子医学研究重点实验室,广西 南宁 530021
扶芳藤为卫矛科卫矛属常绿藤本灌木,具有行气活血、止血化瘀、治腰肌劳损、关节酸痛、月经不调及创伤出血等功效[1]。黄酮类、三萜、儿茶素类、多糖为扶芳藤主要成分[2-4],查阅相关文献,发现关于扶芳藤总三萜的相关研究比较少。研究发现,机体许多重要的生物大分子—核酸、蛋白质和脂质等易被具有强氧化反应能力的自由基氧化损伤,导致机体损伤,且不可逆转[5]。在细胞衰老过程中,机体内抗氧化能力随机体活性氧自由基的升高而减弱,线粒体、脂肪酸受外界环境刺激可产生过氧化氢、超氧阴离子等各种过氧化因子,触发过氧化反应,诱导细胞内物质发生过氧化,引起细胞凋亡,加速衰老进程[6]。2017年9月至2018年4月,本研究观察了扶芳藤总三萜对D-半乳糖诱导衰老小鼠血清及各组织中总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)等抗氧化指标的影响,为探讨其抗氧化作用提供依据。
1 材料与方法
1.1 材料 (1)动物:健康清洁级雄性昆明小鼠75只,体质量20~23 g,周龄6~7周,由广西医科大学实验动物中心提供(许可证号SCXK-桂2014-0002)。(2)主要试剂:扶芳藤总三萜由本实验室取茎叶制备,纯度≥64.5%,所用扶芳藤原料购自广西中医药公司,经广西中医药大学韦松基教授定为卫矛科卫矛属植物扶芳藤。过氧化氢酶(CAT)检测试剂盒、谷胱甘肽过氧化物酶(GSH-PX)检测试剂盒、总抗氧化(T-AOC)检测试剂盒均购自南京建成生物科技有限公司,D-半乳糖(0.2 mg/mL,纯度>99%)购于北京索莱宝科技有限公司,黄芪多糖(纯度≥50%)购于西安锦鸿生物科技有限公司,其他试剂均为市售分析纯。(3)主要仪器:美国BioTek公司EPOCH2型紫外可见分光光度计,德国Hettich公司Mikro220R型离心机。
1.2 建模及分组处理 选择雄性昆明小鼠75只,室温(26±1)℃、昼夜各12 h、常规饲料适应性喂养1周。将小鼠按单纯随机抽样法分为对照组、模型组、扶芳藤总三萜高、低剂量组及黄芪多糖组,每组15 只。除对照组外其余4 组均建立衰老模型,即按照小鼠重量于颈背部皮下注射D-半乳糖溶液0.25 mL/10 g,对照组注射等量生理盐水,连续14 d。配制扶芳藤总三萜高、低剂量溶液及黄芪多糖溶液,浓度分别为2.1 mg/mL、1.7 mg/mL、8.0 mg/mL。建模第15 天,扶芳藤总三萜高、低剂量组及黄芪多糖组按体质量分别给予扶芳藤总三萜高、低剂量溶液及黄芪多糖溶液0.25 mL/10 g灌胃,模型组和对照组均给予等量纯水灌胃,连续35 d。
1.3 血清T-AOC、GSH-Px水平检测 采用灌胃给药第49天,经75%乙醇消毒后,摘取眼球。收集眼球血1 mL于离心管中,室温条件放置20 min,3 500 r/min离心10 min,取上清液,置-20 ℃保存备用。 T-AOC、GSH-Px 活性均采用酶法检测,并严格按照试剂盒操作步骤说明书进行操作。
1.4 心脏、肝脏、骨骼肌组织中T-AOC、CAT、GSH-Px 表达检测 各组摘取眼球后采用颈椎脱臼法处死小鼠,迅速取心脏、肝脏、腓肠肌处骨骼肌组织,用预冷的生理盐水冲洗2 次,滤纸拭干。将组织剪碎后,加入预冷的生理盐水,冰上制成10%组织匀浆。2 500 r/min离心10 min,取上清液,置于-20 ℃保存待用。 T-AOC、CAT、GSH-Px 活性采用酶法检测,并严格按照试剂盒操作步骤说明书进行操作。蛋白质含量采用考马斯亮兰法测定,以紫外可见分光光度计于595 nm波长处测定吸光度,空白对照为蒸馏水,以吸光度为纵坐标,蛋白质浓度为横坐标绘制标准曲线,求得线性回归方程y=2.039 7x-0.000 8,R2=0.996 2。
1.5 统计学方法 应用SPSS23.0 统计软件分析数据,计量资料呈正态分布,以均数±标准差(x-±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组血清中T-AOC、GSH-Px 水平比较 由表1可知,与对照组比较,低剂量组及黄芪多糖组血清中的T-AOC水平均升高,差异有统计学意义(P<0.05);与模型组比较,低剂量组及黄芪多糖组血清中的T-AOC水平均升高,差异有统计学意义(P<0.05);与高剂量组比较,黄芪多糖组血清中的T-AOC 水平升高,差异有统计学意义(P<0.05)。与对照组比较,模型组血清中的GSH-Px 水平降低,差异有统计学意义(P<0.05),黄芪多糖组血清中的GSH-Px水平升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组血清中的GSH-Px 水平均升高,差异有统计学意义(P<0.05);与高剂量组比较,黄芪多糖组血清中的GSH-Px 水平升高,差异有统计学意义(P<0.05)。高、低剂量组血清中T-AOC、GSH-Px水平整体低于黄芪多糖组,其中低剂量组血清中T-AOC、GSH-Px水平整体高于扶芳藤总三萜高剂量组。
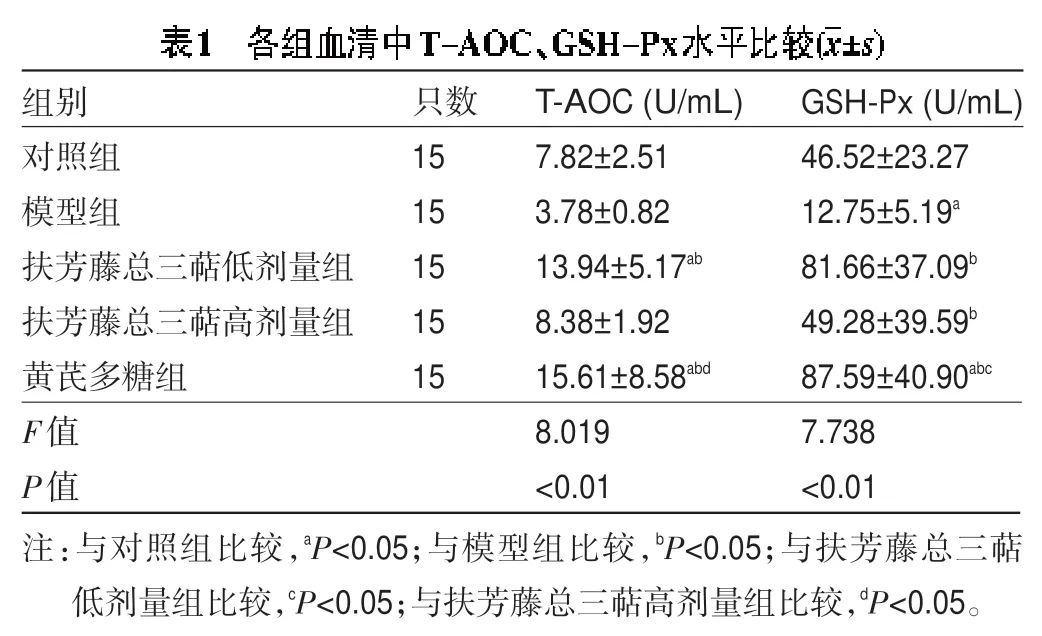
images/BZ_13_207_686_1207_719.png组别对照组模型组扶芳藤总三萜低剂量组扶芳藤总三萜高剂量组黄芪多糖组F值P值只数15 15 15 15 15 T-AOC(U/mL)7.82±2.51 3.78±0.82 13.94±5.17ab 8.38±1.92 15.61±8.58abd 8.019<0.01 GSH-Px(U/mL)46.52±23.27 12.75±5.19a 81.66±37.09b 49.28±39.59b 87.59±40.90abc 7.738<0.01注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与扶芳藤总三萜低剂量组比较,cP<0.05;与扶芳藤总三萜高剂量组比较,dP<0.05。
2.2 各组心脏组织中T-AOC、CAT、GSH-Px 水平比较 由表2 可知,与对照组比较,模型组心脏组织中T-AOC 水平降低,差异有统计学意义(P<0.05),高、低剂量组心脏组织中T-AOC 水平均升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组心脏组织中T-AOC 水平均升高,差异有统计学意义(P<0.05);与高剂量组比较,黄芪多糖组心脏组织中T-AOC 水平降低,差异有统计学意义(P<0.05)。与对照组比较,模型组心脏组织中CAT 水平降低,差异有统计学意义(P<0.05),高剂量组及黄芪多糖组心脏组织中CAT 水平均升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组心脏组织中CAT 水平均升高,差异有统计学意义(P<0.05);与低剂量组比较,黄芪多糖组及高剂量组心脏组织中CAT 水平均升高,差异有统计学意义(P<0.05)。与对照组比较,模型组心脏组织中GSH-Px 水平降低,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组心脏组织中GSH-Px 水平均升高,差异有统计学意义(P<0.05)。高剂量组心脏组织中T-AOC、CAT、GSH-Px 整体水平高于黄芪多糖组及低剂量组。
表2 各组心脏组织中T-AOC、CAT、GSH-Px水平比较)
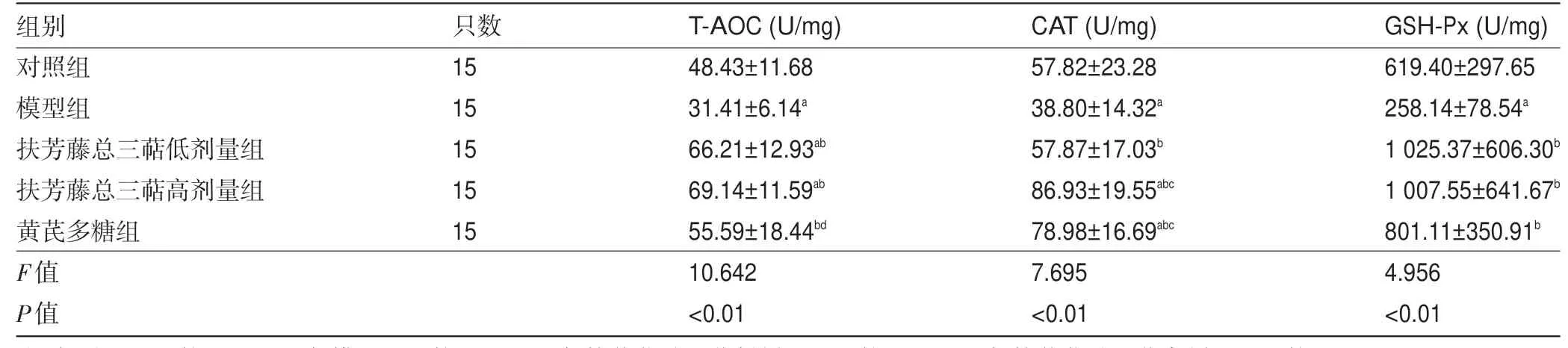
表2 各组心脏组织中T-AOC、CAT、GSH-Px水平比较)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与扶芳藤总三萜低剂量组比较,cP<0.05;与扶芳藤总三萜高剂量组比较,dP<0.05。
组别对照组模型组扶芳藤总三萜低剂量组扶芳藤总三萜高剂量组黄芪多糖组F值P值只数15 15 15 15 15 T-AOC(U/mg)48.43±11.68 31.41±6.14a 66.21±12.93ab 69.14±11.59ab 55.59±18.44bd 10.642<0.01 CAT(U/mg)57.82±23.28 38.80±14.32a 57.87±17.03b 86.93±19.55abc 78.98±16.69abc 7.695<0.01 GSH-Px(U/mg)619.40±297.65 258.14±78.54a 1 025.37±606.30b 1 007.55±641.67b 801.11±350.91b 4.956<0.01
2.3 各组肝脏组织中T-AOC、CAT、GSH-Px水平比较 由表3可知,与对照组比较,模型组肝脏组织中T-AOC水平降低,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组肝脏组织中T-AOC 水平均升高,差异有统计学意义(P<0.05)。与对照组比较,模型组肝脏组织中CAT 水平降低,差异有统计学意义(P<0.05);高剂量组肝脏组织中CAT 水平升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组肝脏组织中CAT水平均升高,差异有统计学意义(P<0.05);与高剂量组比较,黄芪多糖组肝脏组织中CAT水平降低,差异有统计学意义(P<0.05)。与对照组比较,模型组肝脏组织中GSH-Px水平降低,差异有统计学意义(P<0.05),高剂量组肝脏组织中GSH-Px 水平升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组肝脏组织中GSH-Px 水平均升高,差异有统计学意义(P<0.05);与低剂量组比较,高剂量组肝脏组织中GSH-Px 水平升高,差异有统计学意义(P<0.05);与高剂量组比较,黄芪多糖组肝脏组织中GSH-Px 水平降低,差异有统计学意义(P<0.05)。高剂量组肝脏组织中T-AOC、CAT、GSH-Px 水平整体高于黄芪多糖组及低剂量组。
表3 各组肝脏组织中T-AOC、CAT、GSH-Px水平比较
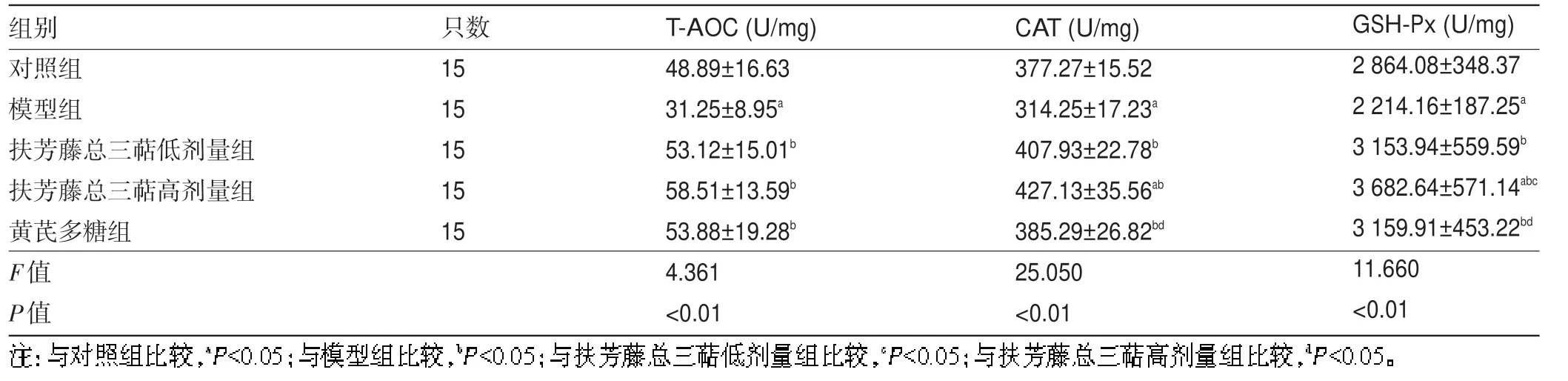
表3 各组肝脏组织中T-AOC、CAT、GSH-Px水平比较
组别对照组模型组扶芳藤总三萜低剂量组扶芳藤总三萜高剂量组黄芪多糖组F值P值只数15 15 15 15 15 T-AOC(U/mg)48.89±16.63 31.25±8.95a 53.12±15.01b 58.51±13.59b 53.88±19.28b 4.361<0.01 CAT(U/mg)377.27±15.52 314.25±17.23a 407.93±22.78b 427.13±35.56ab 385.29±26.82bd 25.050<0.01 GSH-Px(U/mg)2 864.08±348.37 2 214.16±187.25a 3 153.94±559.59b 3 682.64±571.14abc 3 159.91±453.22bd 11.660<0.01images/BZ_13_207_3244_2086_3278.png
2.4 各组骨骼肌组织中T-AOC、CAT、GSH-Px水平比较 由表4可知,与对照组比较,模型组骨骼肌组织中T-AOC 水平降低,差异有统计学意义(P<0.05),高、低剂量组及黄芪多糖组骨骼肌组织中T-AOC水平均升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组骨骼肌组织中T-AOC水平均升高,差异有统计学意义(P<0.05)。与对照组比较,模型组骨骼肌组织中CAT水平降低,差异有统计学意义(P<0.05),高剂量组骨骼肌组织中CAT水平升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组骨骼肌组织中CAT水平均升高,差异有统计学意义(P<0.05)。与对照组比较,模型组骨骼肌组织中GSH-Px 水平降低,差异有统计学意义(P<0.05),黄芪多糖组及高剂量组骨骼肌组织中GSH-Px水平均升高,差异有统计学意义(P<0.05);与模型组比较,高、低剂量组及黄芪多糖组骨骼肌组织中GSH-Px水平均升高,差异有统计学意义(P<0.05)。高剂量组骨骼肌组织中T-AOC、CAT水平高于黄芪多糖组及低剂量组,高、低剂量组骨骼肌组织中GSH-Px水平均低于黄芪多糖组。
表4 各组骨骼肌组织中T-AOC、CAT、GSH-Px水平比较(
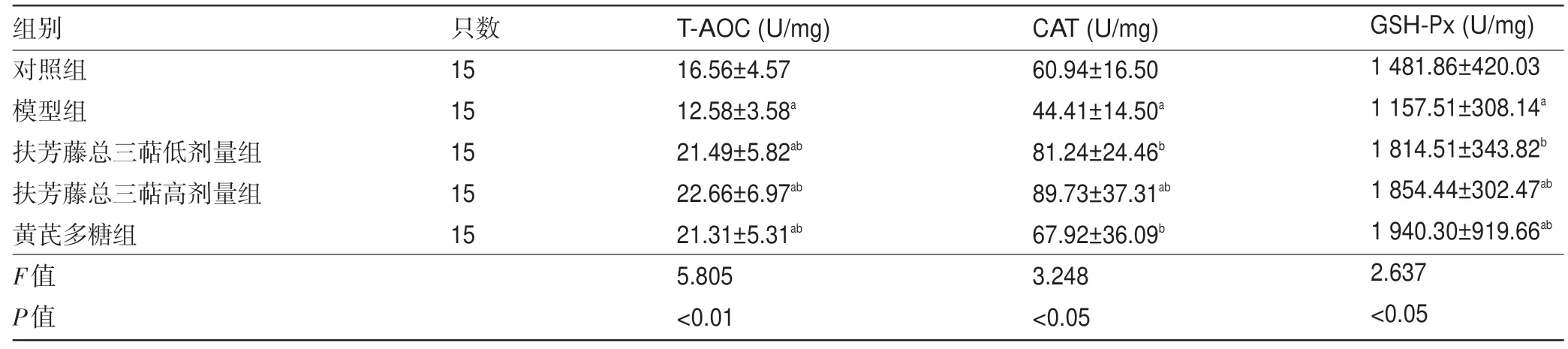
表4 各组骨骼肌组织中T-AOC、CAT、GSH-Px水平比较(
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与扶芳藤总三萜低剂量组比较,cP<0.05;与扶芳藤总三萜高剂量组比较,dP<0.05。
组别对照组模型组扶芳藤总三萜低剂量组扶芳藤总三萜高剂量组黄芪多糖组F值P值只数15 15 15 15 15 T-AOC(U/mg)16.56±4.57 12.58±3.58a 21.49±5.82ab 22.66±6.97ab 21.31±5.31ab 5.805<0.01 CAT(U/mg)60.94±16.50 44.41±14.50a 81.24±24.46b 89.73±37.31ab 67.92±36.09b 3.248<0.05 GSH-Px(U/mg)1 481.86±420.03 1 157.51±308.14a 1 814.51±343.82b 1 854.44±302.47ab 1 940.30±919.66ab 2.637<0.05
3 讨论
三萜类化合物是一类具有抗肿瘤、抗病毒、镇静、抗菌、抗炎等多种功效的重要天然抗氧化活性物质[7-9]。研究发现,大量自由基可损伤DNA 和生物膜,破坏免疫系统功能,与肾结石、白血病、肿瘤等疾病的发生发展有着密切关系[10-12]。学者发现,黄芪多糖剂量增加可使脾脂褐素颗粒的凝聚力与分布减少,且黄芪多糖不仅可抑制与衰老相关的β-半乳糖甘酶(SAβ-gal)表达,还可降低SAβ-gal的活性[13-15]。因此,本研究选择黄芪多糖作为抗衰老药物的对照。
研究表明,生物在其生理过程中产生的氧化自由基与疾病的产生及生物病变有着最直接的关系[16]。机体对自由基的清除能力可通过抗氧化指标T-AOC、CAT 及GSH-Px 体现。研究发现,细胞外自由基的清除反应及机体体内抗氧化剂之间的相互协作可通过T-AOC 的强弱反映,且机体的健康、衰老及疾病等也可通过T-AOC的强弱反映,因此T-AOC是衡量生物机体内抗氧化能力的最优指标之一[17-18],陈鹭颖等[19]研究发现糖尿病、原发性及肾性高血压患者检测血浆中T-AOC 水平均低于健康组。CAT 是一种存在于红细胞及某些组织细胞的微粒体中的酶,其成分铁卟啉可使超氧化物歧化酶催化超氧阴离子发生歧化反应,继而使过氧化氢分解成水和氧分子,使机体免受自由基损伤[20],李彬先等[21]研究发现胰腺炎患者血清中CAT升高程度与患者的病情呈平行关系。在机体的抗脂质过氧化过程中,GSH-Px 可阻止机体内自由基引起的膜脂质过氧化,清除丙二醛(MDA)及多种过氧化产物,并分解过氧化氢,GSH-Px是重要的过氧化物分解酶[22]。白桂芹等[23]研究发现,肝细胞被乙型、丙型肝炎病毒感染后,硒蛋白GSH-Px表达改变,并与硒结合蛋白相互作用,使脂质过氧化作用被干扰,引起病毒性肝炎。
通过皮下注射D-半乳糖,小鼠细胞代谢紊乱[24],不仅导致肝、脑、脾脏和胸腺等器官衰退[25-26],还引发血液、心肌和骨骼肌等组织的病理改变[27-28],这一过程与机体的自然衰老过程相似,因此可通过检测衰老模型小鼠血清、心脏、肝脏及骨骼肌等组织抗氧化指标的变化进行抗衰老研究。本研究结果显示,与对照组T-AOC、CAT、GSH-Px 水平比较,除小鼠血清模型组T-AOC水平降低,差异无统计学意义(P>0.05)外,小鼠血清模型组GSH-Px水平及小鼠心脏、肝脏、骨骼肌组织模型组T-AOC、CAT、GSH-Px 水平均降低,差异有统计学意义(P<0.05),说明建模成功。该模型结果稳定,具有价格低廉、简单易行和成模时间短等优点,是衰老研究中常用的一种动物模型[29]。本研究中血清CAT 数值误差偏大,因操作中时间误差及室内温度变化引起,后经讨论决定舍弃。本研究结果发现,扶芳藤总三萜可升高衰老小鼠机体的T-AOC、CAT、GSH-Px 水平,其中扶芳藤总三萜低剂量组血清中T-AOC、GSH-Px 水平高于扶芳藤总三萜高剂量组,而扶芳藤总三萜高剂量组心脏、肝脏、骨骼肌组织中T-AOC、CAT、GSH-Px 水平整体又高于扶芳藤总三萜低剂量组,经讨论分析出现该现象与扶芳藤总三萜纯度较低、其他成分影响及扶芳藤总三萜在血清和不同组织中的量效关系不同有关。
综上所述,扶芳藤总三萜可提高衰老小鼠模型的T-AOC、CAT、GSH-Px水平,从而增强小鼠机体的抗氧化能力。本研究可为扶芳藤资源的进一步开发和利用提供参考。