一株侵染豌豆蚜的昆虫病原真菌的分离及鉴定
张挺峰, 王 睿, 刘长仲,*
(1. 甘肃农业大学植物保护学院, 甘肃省农作物病虫害生物防治工程实验室, 兰州 730070;2. 河西学院农业与生物技术学院, 甘肃张掖 734000)
豌豆蚜Acyrthosiphonpisum隶属于半翅目(Hemiptera)蚜总科蚜科(Aphididae),在世界各地广泛分布,是许多豆科作物及牧草的主要害虫之一(贺春贵, 2004)。在美国,豌豆蚜的危害可导致苜蓿生产者每年损失大约6 000万美元(Harmonetal., 2009)。在我国西北苜蓿种植区,豌豆蚜每年可造成苜蓿生产10%~30%的经济损失(特木尔布和等, 2005)。除直接取食为害外,豌豆蚜还能传播苜蓿花叶病毒、豌豆耳突花叶病毒等30余种病毒,从而造成严重的间接危害(He and Zhang, 2006)。长期以来,蚜虫防治主要依靠大面积使用化学农药,然而,单一使用化学农药,致使大量天敌被杀伤,破坏了天敌和蚜虫的消长关系;蚜虫抗药性产生,且随着用药次数和用药量的增加而交替上升;随之而来的大量化学农药使用所造成的环境污染和农药残留等问题也日益突出(Scottetal., 1998; Bielza, 2008; Gaoetal., 2012)。
昆虫病原真菌以其广泛的存在和丰富的多样性为病虫害综合防治提供了一种可持续的解决方案。利用病原微生物制成的生物农药由于其生态友好性和持久性,无残留、无公害、无毒或低毒、不易产生抗性等优点,在昆虫生命周期的各个阶段都是首选的杀虫剂。用昆虫病原真菌防治害虫,不同的菌种和菌株对同一寄主昆虫的感染毒力常常不同,一般来说,来自原寄主的病原真菌比来自其他寄主的病原真菌对防治对象有更高的毒力或专一的作用于靶标有害生物。因此,收集田间自然感染的虫尸,分离和筛选高致病性的昆虫病原真菌是豌豆蚜生物防治的基础。本研究于2016年6月在甘肃省兰州市甘肃农业大学苜蓿实验基地,采集获得自然染病的豌豆蚜虫尸,分离和纯化出一株具有高致病力的病原真菌,自命名TF-2。通过对TF-2菌株形态观察和分子鉴定以及毒力测定的研究,旨在为利用昆虫病原真菌进行豌豆蚜的生物防治提供菌种资源和应用依据。
1 材料与方法
1.1 菌株分离
2016年6月,将采自甘肃农业大学苜蓿试验基地(兰州安宁区)的豌豆蚜虫尸先用75%酒精消毒3 s,再用灭菌蒸馏水洗涤3次,放入1.5 mL离心管中,加入0.5 mL灭菌蒸馏水,用组织匀浆器将虫体匀浆并稀释10倍,取20 μL用涂布棒均匀涂布在PDA固体培养基上,置于恒温培养箱中(SPX-250-GB,上海跃进医疗器械有限公司),在25±1℃、75%±5% RH、光周期16L∶8D条件下培养5 d,将培养后的菌株进行2次划线分离,自命名TF-2,保存于4℃冰箱备用。
1.2 供试蚜虫
试验所用红色型豌豆蚜采自甘肃农业大学苜蓿试验基地,挑选无翅胎生雌蚜,单头饲养在盆栽蚕豆Viciafabae‘Lincan 2’ (临蚕2号,购于甘肃省农业科学院)植株上进行单克隆系培养,作为供试虫源。饲养条件:温度25±1℃、50%±10% RH的条件下饲养备用。
1.3 回接试验和生物学测定
采用浸渍法(Yu, 2016)和改进的离体叶片培养法(Feng and Johnson, 1991)进行回接试验和生物学测定。将分离菌株TF-2培养10 d后,用2 mL 0.01% Tween-80无菌水冲洗菌落获得分生孢子,在显微镜下配制成不同浓度(1×103, 1×104, 1×105, 1×106和1×107孢子/mL)孢子悬浮液。用毛笔挑选个体大小基本一致的红色型无翅成蚜,浸入孢子悬浮液(1×107孢子/mL)中3~5 s后挑出,自然晾干,选择活动自如、无残缺个体,接入新鲜洁净蚕豆叶片上,用浸湿的棉团包裹叶柄,置于底铺滤纸的培养皿(直径为9 cm)内,在滤纸上滴无菌水保湿,每叶接虫5头,每一浓度处理30头,重复3次,对照组(CK)用0.01% Tween-80无菌水处理。接种蚜虫放入恒温培养箱中(25±1℃, 75%±5% RH, 光周期16L∶8D)饲养,每隔12 h观察1次,观察蚜虫体染菌情况,记录处理成虫死亡数量,及时清除若蚜。叶柄棉花团适时补充水分,每隔3 d更换1次叶片。
1.4 病原真菌形态学观察及鉴定
将保存于4℃冰箱中的菌株TF-2接种于PDA培养基上,25℃活化5 d,再用挑菌针在菌落边缘挑取菌丝,转接到新的PDA培养基上,并在接种中心外倾斜45°角插入3个无菌盖玻片(18 mm×18 mm),在恒温培养箱中(25±1℃, 75%±5%RH, 光周期16L∶8D)培养。利用光学显微镜自第2天开始观察记录菌落形态、颜色和菌落生长情况,分生孢子、分生孢子梗、晶体等的形成情况,测量并拍照。根据菌株形态特征,参考《昆虫真菌学》(李增智和蒲蛰龙, 1996)检索表进行初步鉴定。
1.5 病原真菌的分子生物学鉴定
1.5.1菌株DNA的提取:将活化的菌株接种于PDA培养基上,恒温培养箱(25±1℃, 75%±5% RH, 光周期16L∶8D)培养20 d,用灭菌的刀片将菌丝从培养基上刮下,收集在灭菌滤纸上,待菌丝干燥2 h后,称取100 mg,置于灭菌研钵中,加入液氮,研磨成粉末,-20℃保存备用。采用CTAB法(Guoetal., 2000)提取菌株总DNA(提取试剂盒购自美国Omega Bio-Tek公司)。
1.5.2rDNA-ITS序列的扩增和测定:选择使用真菌rDNA-ITS通用引物(Whiteetal., 1990):ITS1-F(5′-CTTGGTCATTTAGAGGAAGT-3′)和ITS4-R(5′-CCTCCGCTTATTGATATGC-3′),对ITS序列进行PCR扩增和测序。PCR反应体系(50 μL): 5 μL 10×Dream Taq Green Buffer (Thermo Fisher Scientific), DNA模板2 μL, dNTPs (2.5 mmol/L each) 4 μL, ITS1-F (10 μmol/L) 2 μL, ITS4-R (10 μmol/L) 2 μL, 0.5 μL Taq酶,补充去离子水至50 μL。反应条件: 94℃预变性4 min; 94℃变性1 min, 55℃退火30 s, 72℃延伸90 s, 35个循环; 72℃延伸10 min。PCR产物经1%凝胶电泳检测后,送交南京金瑞斯生物科技有限公司测序。
1.5.3分子系统发育分析:将测得的rDNA-ITS序列在NCBI数据库中进行BLAST比对并申请GenBank登录号。下载相关菌株的ITS序列,使用MEGA6.0软件运用Clustal X方法进行系统发育分析,以邻接法(neighbor-joining method)构建分子系统发育树,用Bootstrap对系统树进行检验,1 000次重复(Cabbone and Kohn, 1993; Moralesetal., 1995; Eapenetal., 2005)。
1.6 数据处理

2 结果
2.1 TF-2菌株回接后豌豆蚜成虫的罹病症状及其毒力
将分离菌株孢子悬浮液(1×107孢子/mL),对红色型豌豆蚜成虫进行回接杀虫试验。接菌培养2 d 后,浸染蚜虫行动迟缓,体色发暗,在虫体的足关节处及腹管等处生出白色菌丝(图1: C),4 d后虫体僵硬且全身布满菌丝(图1: E, F),其症状与自然染病僵蚜(图1: A)一致。回接试验证明分离菌株是一株寄生于豌豆蚜的病原真菌。不同浓度TF-2分生孢子浸染豌豆蚜成虫毒力测定结果表明:随分生孢子浓度增大,致死率升高,最高浓度处理(1×107孢子/mL) 6 d 后校正死亡率达到100%(表1),可见分离得到的TF-2菌株对豌豆蚜成虫具有较强的致病力。
2.2 菌株鉴定
2.2.1菌株的培养性状及形态特征:将菌株TF-2在 PDA 培养基上25℃恒温培养10 d后,菌落直径24~30 mm。菌落正面白色绒毡状(图2: A),菌落背面奶油色泛黄(图2: B)。分生孢子梗较长呈瓶状,常见从平卧菌丝上单生或侧轮生2~3个,大小为(19~42) μm×(1.1~2.5) μm,基部较粗至尖端逐渐变细(图2: C, D)。分生孢子长椭圆形(图2: E),大小为(4.2~11.8)μm×(1.6~2.6) μm,还能产生卵圆形或椭圆形小分生孢子。菌丝体可产生大量呈八面体晶体(图2: F)。最适生长温度为25±1℃,当温度超过34℃菌株停止生长。根据以上形态观察结果,参考李增智和蒲蛰龙(1996)以及Zare和Games(2003)的研究,初步判断该菌株为蜡蚧菌属真菌。

图1 菌株TF-2侵染豌豆蚜症状
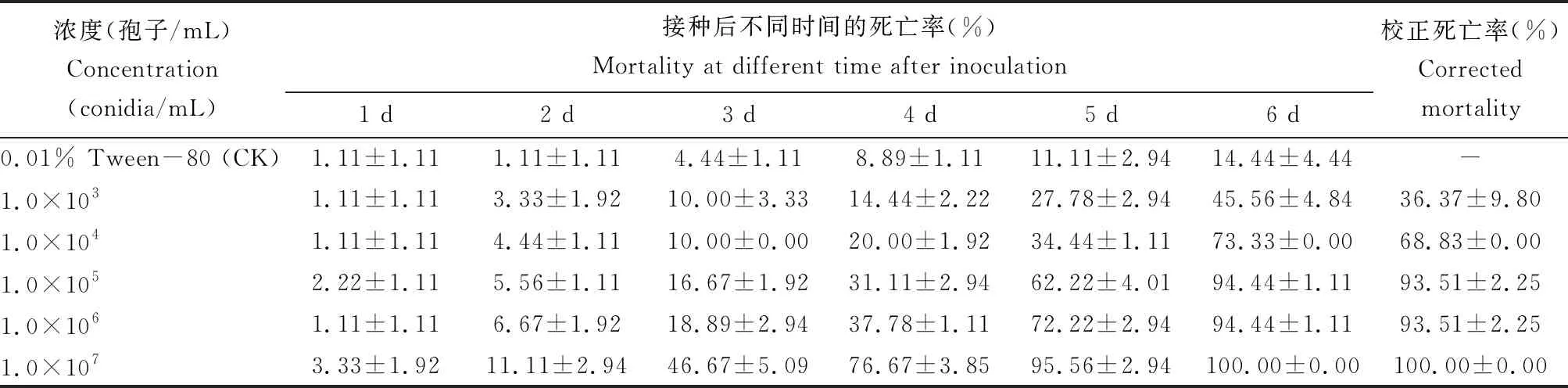
表1 处理后不同时间TF-2菌株对豌豆蚜成虫的致病力
校正死亡率(%)=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)。Corrected mortality (%)=(Mortality in the treatment group-Mortality in the control group)/(1-Mortality in the control group).

图2 菌株TF-2形态特征及培养性状
2.2.2分子鉴定:为进一步确定该真菌类型,以ITS1-F和ITS4-R为引物进行PCR扩增,得到菌株TF-2的ITS序列送南京金瑞斯生物科技有限公司测序,得到630 bp DNA序列(GenBank登录号: MG834532)。通过Blast与GenBank中已有的核苷酸序列进行比对,结果表明,菌株TF-2的rDNA-ITS序列与长孢蜡蚧菌Lecanicilliumlongisporum(GenBank登录号: KX426564)相应序列一致性高达99%。选择GenBank中蜡蚧菌属Lecanicilliun已公布的具代表性的9个菌株的DNA序列,采用Clustal X将已知序列和测得的序列进行多重序列比对,比对完成后用MEGA6.0软件中的邻接法构建系统发育树,以确定该菌株TF-2与同属其他种的亲缘关系(图3)。Bootstrap值大于70%相当于统计学概率的95%,一般75%以上认为是可信的(叶丽芹等, 2011)。结合形态特征与rDNA-ITS同源性比对结果,确定分离得到的菌株TF-2为长孢蜡蚧菌L.longisporum。

图3 基于rDNA-ITS序列的菌株TF-2和蜡蚧菌属菌种系统发育树
3 讨论
昆虫病原真菌是自然界中昆虫种群数量得以控制的主要因素之一,是园艺、林业和农业中真菌杀虫剂的重要组成部分(Inglisetal., 2000)。本研究从自然染菌的豌豆蚜虫尸上分离得到一株病原真菌,经毒力测定、形态学和分子鉴定,确定该真菌为长孢蜡蚧菌L.longisporum。室内毒力测定显示长孢蜡蚧菌TF-2对豌豆蚜成虫具有很强的致病力,是一种具有开发潜力的病原真菌。ITS序列由于其易扩增、信息量丰富、研究广泛等诸多优势,已经成为真菌鉴定的通用核心条形码(Schochetal., 2012)。利用ITS序列对长孢蜡蚧菌以及蜡蚧菌属的研究已有报道(张召荣等, 2015; Berlanga-Padillaetal., 2016; Wangetal., 2017)。
长孢蜡蚧菌L.longisporum是一种重要的虫生真菌,以前被广泛地称为蜡蚧轮枝菌Verticilliumlecanii。蜡蚧轮枝菌是一个复合种,其寄主广泛,可寄生蚜虫、介壳虫、螨虫、真菌等不同类型。国内外在蜡蚧轮枝菌菌株筛选、发酵生产和制剂加工上均取得显著进展,已登记的生物农药Vealrtec®,对温室蚜虫和粉虱防治具有很好的效果(Goetteletal., 2008)。Gams和Zare于2001年通过ITS序列分析将蜡蚧菌从轮枝菌属中分出,建立蜡蚧菌属Lecanillium(Gams and Zare, 2001),随后,又逐渐将蜡蚧菌中的部分株系归为蜡蚧菌属的其他种。蜡蚧菌属现有21个种,其中与昆虫有关的主要有蜡蚧菌L.lecanii, 渐狭蜡蚧菌L.attenuatum, 长孢蜡蚧菌L.longisporum,L.muscarium和L.nodulosum5个种(Goetteletal., 2008)。
微生物农药可以大幅降低化学杀虫剂用量及其在农产品中的残留,是无公害农产品首选药剂。但微生物农药发展速度缓慢,目前用于蚜虫防治的不多,主要原因在于真菌孢子萌发需要特定的条件,如温度和湿度。有研究表明蜡蚧轮枝菌V.lecanii在100%RH条件下至少需要36 h才能侵染蚜虫(Alavoetal., 2002)。利用长孢蜡蚧菌防治桔粉蚧壳虫Planococcuscitri, 棉蚜Aphisgossypii, 甘蓝蚜Brevicorynebrassicae, 麦无网长管蚜Metopolophiumdirhodum和根结线虫Meloidogyneincognita等已有相关报道(Kimetal., 2010; 兰木佐, 2010; Safooraetal., 2014; Baiswaretal., 2016; Sepidehetal., 2017)。以上研究结果均为在室内可控条件下取得的,但在实际生产环境中杀虫效果仍不确定。因此,应深入研究了解寄主与病原菌之间的关系、病原菌的侵染机制及其田间的流行学等特点,才能使微生物农药得到更大的发展。我国北方地区蔬菜温室具有真菌发生的适宜温度和湿度,为昆虫病原真菌的发生创造了良好的环境条件,微生物农药的应用前景值得关注。
虽然长孢蜡蚧菌TF-2对豌豆蚜具有较好侵染效果。但由于病原真菌受到温度、湿度、光照、生物等外界环境因素的影响,其在温室和田间应用效果还有待于进一步研究明确,后续我们将针对长孢蜡蚧菌防治豌豆蚜的应用策略与剂型等开展相关研究。本研究得到的长孢蜡蚧菌TF-2分离自甘肃农业大学苜蓿实验基地自然染病的豌豆蚜虫尸,属首次在甘肃发现,为今后在蔬菜温室或大田作物中害虫生物防治提供了菌种资源。

