香蕉植株根区土壤的真菌多样性分析
廖咏梅 黄元腾吉 邹承武 黄琦 王忠文


摘 要:尖孢鐮孢菌古巴专化型(Fusarium oxysporum f. sp. cubense)是香蕉枯萎病的病原菌,该菌是一种土壤习居菌,了解香蕉根区土壤中真菌多样性及镰孢菌属(Fusarium)真菌所占比例,对如何减少土壤中的病原菌、预防香蕉枯萎病的发生有重要的指导意义。该文通过采集不同宿根年限的香蕉健康植株和枯萎病植株的根区土壤,利用高通量测序技术测定土壤样品中的真菌种群。结果表明:(1)同一宿根年限的香蕉植株中,健康植株根区土壤中所获的reads及OTUs数量均高于枯萎病植株,说明健康植株根区土壤的真菌多样性丰富于枯萎病植株。(2)除了一年生香蕉枯萎病植株以担子菌门(Basidiomycota)为主外,其他土壤样品中均以子囊菌门(Ascomycota)为主,其中的丛赤壳科最高相对丰度来自三年生健康植株的根区土壤(26.02%),其次是五年生的枯萎病植株根区土壤(15.56%)。(3)在丛赤壳科中,镰孢菌属在三年生健康植株土壤中的相对丰度最高(2.54%),在其他样品中的相对丰度在0.1%~0.65%之间;在镰孢菌属中,腐皮镰孢菌(Fusarium solani)的相对丰度(0~1.59%之间)高于尖孢镰孢菌(F. oxysporum),尖孢镰孢菌仅占很小的比例(相对丰度0~0.08%之间)。可见,在不同香蕉植株的根区土壤中,健康植株的根区土壤真菌多样性高于枯萎病植株,无论是健康植株还是枯萎病植株的根区土壤中,作为香蕉枯萎病病原菌的镰孢菌属或尖孢镰孢菌的群体均不占主导地位。
关键词:香蕉,枯萎病,根区土壤,真菌种群,镰孢菌
中图分类号:Q938文献标识码:A
Abstract:Fusarium oxysporum f. sp. cubense is the pathogen of banana fusarium wilt which is a soil habitual fungus. Understanding the diversity of fungi and the proportion of Fusarium in the soil of banana root zone has important guiding significance for reducing the pathogens in the soil and preventing the occurrence of banana fusarium wilt. The root zone soil samples from banana healthy and fusarium wilt plants with different perennial years were collected and the fungal populations in the soil samples were determined by high throughput sequencing technique. The results were as follows:(1) Among banana plants with the same perennial root age,the number of reads and OTUs in the samples from healthy plants was higher than that from fusarium wilt plants,indicating that the diversity of fungi in the root zone soil of healthy plants was richer than that from fusarium wilt plants. (2) Except for phylum Basidiomycota was dominant in annual banana fusarium wilt plant, Ascomycota was the dominant phylum in other soil samples. The highest relative abundance of family Nectriaceae was in the root zone soil of triennial healthy plant (26.02%),followed by that of five-year-old fusarium wilt plant (15.56%). (3) Among genus family Nectriaceae,the highest relative abundance of Fusarium was 2.54% in the sample from triennial healthy plant,and that from other samples ranged from 0.1% to 0.65%. Among genus Fusarium,the relative abundance of Fusarium solani (0-1.59%) was higher than that of F. oxysporum,whose relative abundance only ranged from 0 to 0.08%. It was concluded that the diversity of fungi in the root zone soil of banana healthy plants was higher than that of fusarium wilt plants. The population of Fusarium or F. oxysporum,which were the pathogen of banana fusarium wilt,was not the dominant genus or species in root zone soil from both healthy and fusarium wilt plants.
Key words:banana,fusarium wilt,root zone soil,fungal population,Fusarium
香蕉枯萎病是对香蕉产业构成严重威胁的一种毁灭性病害。香蕉枯萎病由尖孢镰孢菌古巴专化型(Fusarium oxysporum f. sp. cubense)4号生理小种引起,该菌是一种土壤习居菌,在缺乏寄主时能在土壤中存活3~5 a,甚至8~10 a(赖传雅和袁高庆,2008)。据报道,自2007年11月广西首次确认香蕉枯萎病发生以来,该病在广西的发生呈“面缓点快”的趋势,即整体疫情发生、扩散较缓(吴志红等,2012)。赵明等(2015)于2013年—2014年调查广西5个香蕉示范区的蕉园,调查地块80个,调查面积占种植总面积在5%以上,调查香蕉总株数为625万株,结果发现2013年香蕉枯萎病平均发病株率为0.28%,2014年的平均发病株率为2.49%。覃柳燕等(2016)于2014年—2015年调查广西7个香蕉主产区,涉及蕉园30个,结果发现,2014年的平均发病率为2.48%,2015年的平均发病率为5.78%。
随着香蕉种植年限的增加,土壤中病原菌的不断积累,香蕉枯萎病是否在某一年份爆发,探讨香蕉根区土壤中真菌种群多样性及香蕉枯萎病菌占根区土壤真菌的比例,对了解土壤中香蕉枯萎病菌的数量积累、预防香蕉枯萎病的爆发有重要的指导意义。据报道,香蕉的栽培管理方式可改变土壤的微生物菌群结构,土壤微生物因素的变化则影响香蕉枯萎病的发生。丁文娟等(2014)研究发现,在香蕉营养生长期施用生物有机肥有利于改善土壤微生物结构,提高土壤酶活性,延缓和降低香蕉枯萎病的发生;钟书堂等(2015)以连续12 a种植香蕉的枯萎病高发病蕉园为试验点,研究发现连续施用生物有机肥能够优化连作蕉园土壤可培养微生物群落结构,防控香蕉枯萎病的发生;柳影等(2015)报道,香蕉套种韭菜及配施生物有机肥均对香蕉枯萎病有显著的防病效果。这些研究结果发现,不同的栽培管理方法对香蕉地土壤微生物的种群结构均有影响,然而,已报道的文献均通过人工分离方法来探索土壤微生物的种群结构,但土壤中有许多真菌种类是不能人工培养的,因此,获得的土壤微生物信息是不全面的。
高通量测序技术能较全面地诠释土壤中的微生物群体。王蓓蓓(2015)用高通量测序技术测定了施用有机肥对土壤微生物的影响,发现与普通有机肥相比,施用生物有机肥能显著提高土壤真菌的Alpha多样性,同时降低香蕉枯萎病的发病率。然而,通过高通量测序技术测定不同宿根年限的香蕉健康植株和枯萎病植株的根区土壤真菌未见报道。本研究通过高通量测序技术,测定不同宿根年限香蕉健康植株和枯萎病植株根区土壤真菌的种群结构,探索香蕉根区土壤中的真菌种群变化及香蕉枯萎病菌所占比例,为通过改变栽培管理技术达到控制香蕉枯萎病的发生提供理论依据。
1 材料与方法
1.1 标本的采集
2018年2月8日到南宁市西乡塘区坛洛镇采集3类地块的香蕉根区土壤。地块一为一年生香蕉地,健康植株根区土壤样品标记为XJ1-0,枯萎病植株根区土壤样品标记为XJ1-1,该地块的香蕉为种植后6个月,植株尚未开花,植株周围几乎无绿色杂草,但是有枯死的杂草茎叶,香蕉行间用塑料膜覆盖防杂草及保湿土壤;地块二为三年生香蕉地,健康植株根区土壤样品标记为XJ2-0,枯萎病植株根区土壤样品标记为XJ2-1,该地块香蕉植株生长茂密,吸芽植株多,地面几乎没有杂草,但是有较多的香蕉枯叶落叶覆盖;地块三为五年生香蕉地,健康植株根区土壤样品标记为XJ3-0,枯萎病植株根区土壤样品标记为XJ3-1,地面杂草多,主要以三叶鬼针草(Bidens pilosa)为主。自不同香蕉植株的东西南北四个方向,刮去1 cm表土,挖开约15 cm的剖面,每个剖面自上而下采集根区土壤样品约500 g,4个方向的根区土壤混合均匀后分成4份,取其中一份带回实验室,保存于4 ℃冰箱中。
1.2 土壤樣品的高通量测序与分析
从带回实验室的香蕉根区土壤样品中,每个样品称取约0.5 g土壤,用BioFast土壤基因组DNA 提取试剂盒按照其说明书提取土壤微生物基因组DNA,经质检合格后,送生工生物工程(上海)股份有限公司,针对土壤DNA中真菌的核糖体内转录间隔区(Internal Transcribed Spacer,ITS)的ITS2区域(ITS3:5′ GCA TCG ATG AAG AAC GCA GC 3′;ITS4:5′ TCC TCC GCT TAT TGA TAT GC 3′)进行PCR,根据PCR产物浓度进行等浓度混样,充分混匀后用2%的琼脂糖胶在1×TAE溶液中电泳PCR产物,割胶回收目标条带,用Thermo Scientific公司的GeneJET胶回收试剂盒纯化PCR产物。使用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库,构建好的文库经过Qubit定量和文库检测,合格后,使用HiSeq2500进行上机测序。
测序得到的原始数据(raw data),存在一定比例的干扰数据(dirty data)。为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据(clean data);然后基于有效数据进行OTUs(Operational Taxonomic Units,操作分类单位)聚类和物种分类分析,结合OTUs和物种注释,得到每个样品的OTUs和分类谱系的基本分析结果;最后对OTUs进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。
2 结果与分析
2.1 香蕉根区土壤总DNA的ITS2区域高通量测序数据的统计
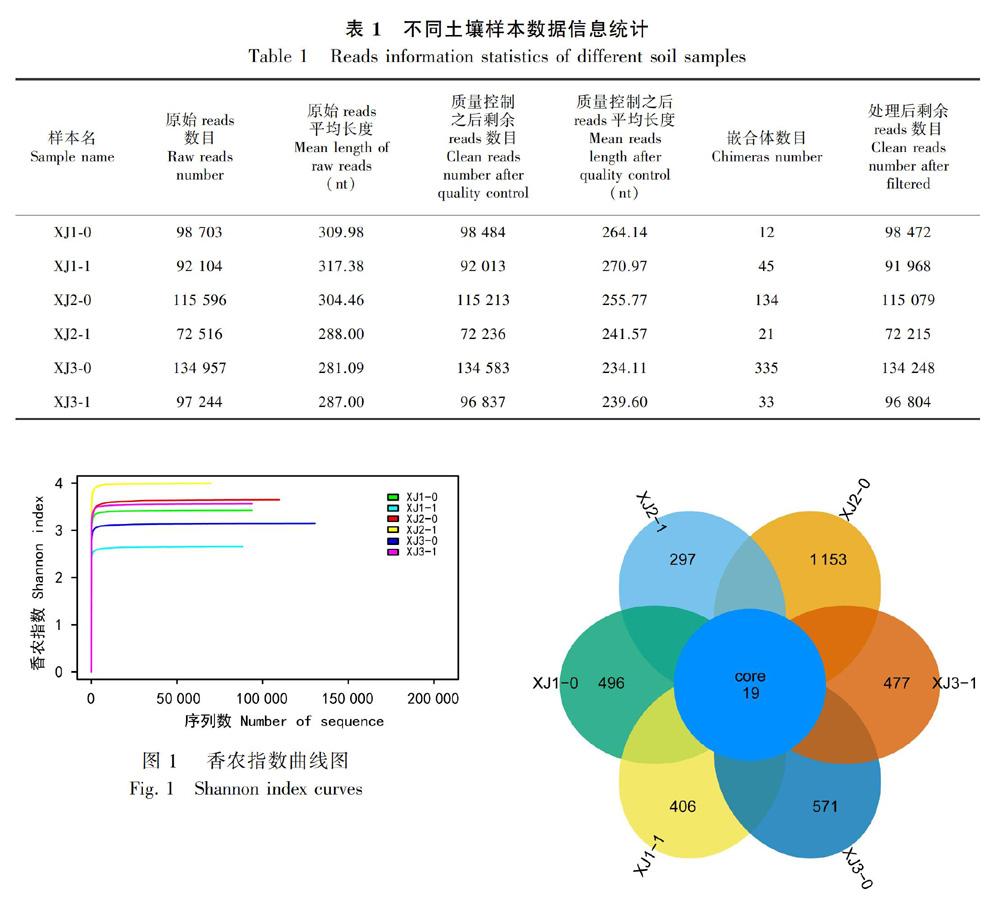
对各香蕉植株根区土壤样品的总DNA进行ITS2区域测序,将各样本的原始数据分别进行拼接、过滤,获得的数据信息见表1。从所获的原始序列(reads)数量和处理后剩余reads数量看出,在同一宿根年限的土壤样品中,健康植株所获reads数量均多于枯萎病植株,说明健康植株根区土壤的真菌种群丰度更高;在香蕉健康植株的根区土壤中,随着香蕉宿根年限的增加,所获reads数量依次增加,其原因可能是随着香蕉宿根年限的增加,土壤被干扰程度依次降低,而使真菌的多样性依次增加;但香蕉枯萎病植株根区土壤的reads数量则没有规律性,可能原因是不同的因素导致香蕉植株生长衰弱,诱发枯萎病的发生。根据所获序列数量绘制香农指数曲线(图1),从图1可以看出,所有样本均随着测序深度的增加趋向平坦,说明测序数据量足够,能够反映出样品中的物种组成特征。
2.2 OTU分析
使用uparse软件对样品的有效序列进行聚类,相似性≥97%的tag聚为同一OTUs,共获得3 419个OTUs,使用代表性序列与每个样品进行比较,将所有样品进行均一化处理之后绘制成韦恩图(Venn Graph),分析不同样品之间共有和特有的OTUs,结果如图2,发现所有样品共有的OTUs为19个。其中,一年生香蕉健康植株根区土壤样品(XJ1-0)的特有的OTUs 496个,而枯萎病植株根区土壤样品(XJ1-1)特有的OTUs为406个,两者相差1.22倍;三年生香蕉健康植株根区土壤样品(XJ2-0)的OTUs为1 153个,而枯萎病植株根区土壤样品(XJ2-1)特有的OTUs为297个,两者相差3.88倍;五年生香蕉健康植株根区土壤样品(XJ3-0)的OTUs为571个,而枯萎病植株根区土壤样品(XJ3-1)特有的OTUs为477个,两者相差1.19倍。可见,所有样品中,在同一宿根年限的香蕉植株中,健康植株根区土壤样品的OTUs数量均大于枯萎病植株的根区土壤样品,进一步说明与枯萎病植株相比,健康植株根区土壤的真菌种群更丰富;一年生(种植后六个月)和五年生土壤表一个圈代表一个样品,重叠部分的数字代表样本之间共有的OTUs个数,没有重叠部分的数字代表样本的特有OTUs个数。
A circle in the graph represents a sample,the number in overlap of two circles is the shared OTUs number among samples,the number outside the overlap is the specific OTUs of samples,respectively.
面植被丰富、均匀一致)的地块,自香蕉健康植株根区土壤与枯萎病植株根区土壤所获得OTUs数量相差1.2倍左右,但自三年生(土壤表面无植被)的根区土壤则相差3.88倍,说明刚种植半年和五年的根区土壤真菌相对差异不大,但种植三年时正是丰产期及香蕉枯萎病高发期的香蕉健株和病株根区土壤真菌差异大。
2.3 真菌门水平的分析
从表2可以看出,在不同的土壤样品中,除了一定比例的未明确分类外,共注释出5个真菌门,包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)和囊球菌门(Glomeromycota),但主要以子囊菌门、担子菌门和接合菌门为主。
在香蕉的健康植株根区土壤中,一年生和三年生健康植株根区土壤均以子囊菌门为主,相对丰度分别为69.92%和61.92%,其次是担子菌门,相对丰度分别为17.11%和27.85%;五年生香蕉健康植株根区土壤以子囊菌门和接合菌门为主,子囊菌门相对丰度为43.40%,接合菌门的相对丰度为44.08%。
在枯萎病植株的根区土壤中,一年生枯萎病植株根区土壤以担子菌门为主,相对丰度为70.37%,其次是子囊菌门,相对丰度为19.89%;三年生枯萎病植株根区土壤以子囊菌门和接合菌门为主,相对丰度相近,分别为42.81%和31.50%;五年生枯萎病植株和健康植株均以子囊菌门和接合菌门为主,其中枯萎病植株土壤样品中,子囊菌门相对丰度为52.12%,接合菌门相对丰度为33.97%。可见,宿根年限不同,真菌的主要门有所不同。除了一年生枯萎病植株根区土壤担子菌门占绝大多数外,其他土壤样品中子囊菌门均占重要地位。一年生和三年生健康植株子囊菌门为主,其次是担子菌门;一年生枯萎病植株位居第二位的门为子囊菌门;三年生枯萎病植株、五年生健康植株和枯萎病植株的根区土壤均以子囊菌门和接合菌门为主。
2.4 真菌科水平的分析
从表3可以看出,相对丰度大于10%的真菌确定科有4个,包括小囊菌科(Microascaceae)、丛赤壳科(Nectriaceae)、被孢霉科(Mortierellaceae)和球盖菇科(Strophariaceae),其中小囊菌科和丛赤壳科隶属子囊菌门;被孢霉科隶属接合菌门;球盖菇科隶属担子菌门。
一年生健康植株根区土壤样品(XJ1-0)的优势科是小囊菌科和球盖菇科,相对丰度分别为42.11%和13.96%;一年生枯萎病植株根区土壤样品(XJ1-1)中,担子菌门未明确分类地位(unclassified Basidiomycota)占絕对优势,相对丰度达到70.05%,由于没有注释到具体的科、属、种,未知XJ1-1样品中的担子菌门具体由哪些种类构成。在三年生的健康植株根区土壤样品(XJ2-0)中,丛赤壳科为主要真菌科,相对丰度为26.02%,而枯萎病植株根区土壤样品(XJ2-1)中则以被孢霉科为主,相对丰度为23.18%。在五年生的健康植株根区土壤样品(XJ3-0)中,相对丰度大于10%的只有接合菌门未明确分类地位(unclassified Incertae sedis Zygomycota),相对丰度为38.42%,而枯萎病植株的根区土壤样品(XJ3-1)中,相对丰度大于10%的确定科有被孢霉科为25.34%和丛赤壳科为15.56%。可见,不同香蕉植株的根区土壤样品中,真菌优势科不同。
引起香蕉枯萎病的尖孢镰孢菌(Fusarium oxysporum)隶属于丛赤壳科,在已注释出的丛赤壳科中,相对丰度最高的是三年生健康植株的根区土壤(26.02%),其次是五年生的枯萎病植株根区土壤(15.56%)。可见,枯萎病植株的根区土壤中,丛赤壳科的相对丰度并不一定高于健康植株的根区土壤。
2.5 不同土壤样品中镰孢菌属(Fusarium)的注释
引起香蕉枯萎病的尖孢镰孢菌(Fusarium oxysporum)隶属于丛赤壳科的镰孢菌属,表4中列出了注释出的镰孢菌属及其相关种类的相对丰度。
从表4可以看出,在所有根区土壤样品中,相对丰度最高的镰孢菌属是来自三年生健康植株的根区土壤,相对丰度为2.54%,在一年生和五年生的根区土壤中,枯萎病植株的镰孢菌属相对丰度高于健康植株。在镰孢菌属的种类结构上,共注释出6种镰孢菌,其中相对丰度最高的是腐皮镰孢菌 (Fusarium solani),在三年生健康植株的根区土壤中,相对丰度为1.59%。腐皮镰孢菌可引起多种植物的根腐病(李捷等,2017),也是重要的植物病害生防菌(钱晓雍等,2007)。在枯萎病植株的根区土壤中,腐皮镰孢菌的相对丰度并非都高于健康植株。尖孢镰孢菌在所有样品中均出现很低的相对丰度,在0~0.08%之间,其中相对丰度最高的是三年生健康植株的根区土壤,为0.08%。可见,无论是香蕉健康植株的根区土壤还是枯萎病植株的根区土壤,镰孢菌属的群体均不占主导地位。在镰孢菌属中,所有样品的腐皮镰孢菌的相对丰度均高于尖孢镰孢菌,尖孢镰孢菌仅占很小的比例,说明引起香蕉枯萎病的尖孢镰孢菌并不是土壤中的重要真菌种类。在枯萎病植株的根区土壤中,并没有因为枯萎病的发生而出现大量的尖孢镰孢菌。
3 讨论与结论
自然界中子囊菌门是已知真菌中最大的门,已知种类超过64 000种,营养方式有腐生、寄生和共生,寄生植物可引起植物病害。担子菌门的大多数种类均为腐生,能分解枯枝落叶中的纤维素和木质素,少数引起植物根腐。接合菌门多数腐生,有些与植物共生形成菌根,少数可以寄生植物引起病害(谢联辉等,2006)。
该文采集的香蕉不同宿根年限的根区土壤样品中,相对丰度高的有3个门,分别为子囊菌门、担子菌门和接合菌门。常强强等(2017)采用IUumina MiSeq高通量测序技术,分析不同地区青檀根际土壤肥力和真菌多样性的相关性,发现子囊菌门、担子菌门和接合菌门为3个优势门,与该文中的研究结果一致。该文中一年生香蕉枯萎病植株根区土壤中担子菌门占绝大多数,可能原因是香蕉的根区土壤中有大量正在被担子菌分解的未腐熟有机质,造成土壤温度升高而伤根,易于被香蕉枯萎病菌侵染而表现枯萎病症状。在三年生香蕉枯萎病植株、五年生香蕉健康植株和枯萎病植株的根区土壤样品中,均以子囊菌门和接合菌门为主。接合菌门在三年生的枯萎病植株及五年生的健康植株和枯萎病植株的根区土壤中均占较高比例,其土壤生态学功能有待进一步研究。
在科的水平上,相对丰度大于10%的真菌确定科有4个,包括小囊菌科、丛赤壳科、被孢霉科和球盖菇科。常强强等(2017)发现不同地区青檀根际土壤中,有4个优势真菌科,包括被孢霉科、发菌科(Trichocomaceae)、丛赤壳科和Archaeorhizomycetaceae。丛赤壳科和被孢霉科作为优势科与该文的研究结果一致。
小囊菌科隶属小囊菌目(Microascales)粪壳菌纲(Sordariomycetes)子囊菌门;小囊菌科在一年生香蕉健康植株土壤样品(XJ1-0)中的相对丰度为42.11%,其中小囊菌属(Microascus)相对丰度为42.07%,Microascus brevicaulis 为42.02%,可见,在小囊菌科中,主要的种类是Microascus brevicaulis。Microascus brevicaulis是短柄帚霉(Scopulariopsis bre-vicaulis)的有性世代,在土壤中腐生,是一种常见的生物降解菌。López-González et al.(2015)研究基于木质纤维素堆肥中的微生物种群多样性,结果发现,Microascus brevicaulis是相对丰度最高的真菌种类之一,在堆肥的所有时期均可检测到。球盖菇科属于伞菌目(Agaricales)伞菌纲(Agaricomycetes)担子菌门真菌,该科的所有种类均为腐生菌,在各种腐烂的有机质上生长。田间调查发现,一年生香蕉植株周围几乎无绿色杂草,但是有枯死的杂草茎叶,其土壤样品(XJ1-0)中Microascus brevicaulis和球盖菇科(Strophariaceae)相对丰度高,该地块种植香蕉已经有6个月,小囊菌科和球盖菇科的存在,促进了香蕉根区土壤中枯死的杂草茎叶等含纤维素的有机质的降解,土壤肥力增加,植株吸收的营养全面,因而植株健康。
丛赤壳科隶属于肉座菌目(Hypocreales)粪壳菌纲子囊菌门。丛赤壳科在自然界以寄生或腐生的营养方式生存,一般生长在走向衰退或即将失去生命活力的动植物上或者其他真菌上,它们对维持自然界生态系统的平衡起一定作用。丛赤壳科中的尖孢镰孢菌(Fusarium oxysporum)引起嚴重的包括香蕉枯萎病在内的植物枯萎病,在世界范围内可以侵染700余种维管束植物,造成重大经济损失(庄文颖,2010)。在三年生健康植株根区土壤中,丛赤壳科的相对丰度(26.02%)显著高于枯萎病植株的相对丰度(3.54%);而在五年生的香蕉枯萎病植株根区土壤中,丛赤壳科的相对丰度(15.56%)显著高于香蕉健康植株的相对丰度(7.49%),其原因有待进一步研究。
被孢霉科隶属于被孢霉目(Mortierellales)未明确分类纲(Incertae sedis Zygomycota)接合菌门。被孢霉科主要是土壤的腐生菌,也可兼性寄生。被孢霉能分解糖类和简单多糖(王芳等,2014),是土壤有机质和养分含量丰富的标志类群(孟令男等,2014)。Metcalf et al.(2016)报道,人类尸体腐烂的后期,被孢霉科的腐生真菌占优势,其功能是分解多种有机化合物。在三年生和五年生香蕉枯萎病植株土壤样品(XJ2-1和XJ3-1)中被孢霉科相对丰度高,分别为23.18%和25.34%,可能原因是香蕉枯萎病植株的根系腐烂到后期而出现该科真菌。薛超(2015)报道,香蕉健康植株土壤中被孢霉属(Mortierella)的相对丰度为2.19%,香蕉枯萎病植株土壤中被孢霉属的相对丰度为0.55%,认为香蕉健康植株土壤中以被孢霉属为主,其研究结果和该研究有差异,是否为土壤类型和采样时期不一致而引起,值得进一步研究。
由于香蕉枯萎病是由镰孢菌属中的尖孢镰孢菌引起的,该文分析了镰孢菌属真菌出现的相对丰度,结果发现在一年生和五年生香蕉植株的根区土壤样品中,枯萎病植株根区土壤的镰孢菌属相对丰度(分别为0.49%和0.46%)高于健康植株根区土壤(分别为0.1%和0.13%),分别相差4.9倍和3.5倍,而在三年生香蕉植株的根区土壤样品中,健康植株根区土壤的镰孢菌属相对丰度(2.54%)高于枯萎病植株根区土壤(0.65%),相差3.9倍。薛超(2015)报道,镰孢菌属是香蕉枯萎病植株根际土壤中的主要类群,在枯萎病植株土壤样品中相对丰度为1.9%,健康植株土壤样品中相对丰度为0.4%,两者相差4.75倍。其研究结果和该文的研究结果有出入,其原因可能为土壤样品不同,镰孢菌属所占比例也不同。
该文的测序结果表明,在镰孢菌属真菌中,腐皮镰孢菌占优势,平均相对丰度为0.41%,而可以引起香蕉枯萎病的尖孢镰孢菌的平均相对丰度仅为0.025%,相差16.40倍。三年生香蕉健康植株根区土壤中,尖孢镰孢菌的相对丰度最高,为0.08%,其次是五年生香蕉枯萎病植株和健康植株土壤,相对丰度分别为0.04%和0.02%。Véronique et al.(2015)通过提取土壤中的总DNA,然后用镰孢菌属的特异引物进行PCR,每个样品取250个克隆进行测序,分析不同土壤中的镰孢菌属的种类多样性,结果发现,在3种土壤类型样品的750个克隆中,均以尖孢镰孢菌的复合种占绝对优势,平均占79.7%,其次是腐皮镰孢菌的复合种平均占8.7%,位居第三的是Fusarium commune,占4.3%。在耕地土壤样品中,尖孢镰孢菌占70.4%,腐皮镰孢菌占12.0%,Fusarium commune占8.0%;在草甸土壤样品中,尖孢镰孢菌占85.6%,腐皮镰孢菌占10.4%,Fusarium commune占1.2%;在森林土壤样品中,尖孢镰孢菌占83.2%,腐皮镰孢菌占3.6%,Fusarium commune占3.6%。可见,未受干扰的草甸土和森林土的尖孢镰孢菌所占比例更高。该文中,五年生香蕉根区土壤相对受干扰比较少,尖孢镰孢菌的相对比例较高,和Véronique et al.(2015)报道的结果一致,该文中的三年生健康植株根区土壤样品中尖孢镰孢菌的相对比例也较高,和土壤健康少受干扰,根系少受伤害也有一定的关系。
镰孢菌属除了作为植物的重要病原菌,还是植物根系的重要内生菌,具有多种生物活性。张清华(2014)从油菜根部分离出35个内生真菌菌株,其中14个菌株属于镰孢菌属,占40%;5个菌株属于尖孢镰孢菌,占14.29%;1个菌株是腐皮镰孢菌,占2.86%;根部内生真菌中的尖孢镰孢菌CanR-46菌株能产生挥发性物质(volatile organic compounds,VOCs),这种混合物能够抑制多种植物病原真菌的生长。包京姗(2015)从 6年生人参根中分离出20 株内生真菌,利用形态学和分子生物学方法进行鉴定,发现内生真菌中镰孢菌属为优势属,占 50%;其中,一个尖孢镰孢菌菌株具有合成纳米银的能力。纳米银对肿瘤细胞有明显抑制生长作用。Kyekyeku et al. (2017)报道,从加纳的药用植物高贵绿柄桑(Chlorophora regia)根部分离到内生真菌腐皮镰孢菌JK10菌株,其粗提取液和分离到的7-去甲基镰刀菌素C衍生物,对环境细菌大肠杆菌(Escherichia coli)和土壤细菌不动杆菌(Acinetobacter sp.)BD4.菌株有抗菌活性,但对医学细菌金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus subtilis)没有抗菌活性,预示着根内生真菌可能赋予一定生态位中寄主植物的化学防御功能。
尖孢镰孢菌是香蕉根系中的重要内生菌,自香蕉枯萎病植株中分离得到的尖孢镰孢菌接种苗期香蕉,不但不能致病,与未接种尖孢镰孢菌的处理相比,接种处理的香蕉苗生长更旺(该文作者的未发表资料)。内生尖孢镰孢菌是否为香蕉枯萎病的致病菌,在什么条件下可以致病,是值得进一步研究的课题。结合前人的研究结果和该文的研究结果,值得进一步思考的问题:为什么未耕作的土壤尖孢镰孢菌所占比例更高(Véronique et al.,2015 );为什么在香蕉健康植株和枯萎病植株的根区土壤中,尖孢镰孢菌出现的频率均很低,相对丰度在0.01%~0.08%之间,低于腐皮镰孢菌的相对丰度(0.08%~1.59%)(该文的研究结果);多種植物的根系内生真菌的优势种均为尖孢镰孢菌,在不同的植物根系中赋予植物不同的药理功能,作为内生真菌的尖孢镰孢菌对香蕉有什么生理功能。这些均是值得进一步研究的问题。
参考文献:
BAO JS,2015. Indentification of endophyte and activity analysis of silver nanoparticles from Panax ginseng [D]. Changchun:Jilin Agricultural University:26-45. [包京姗,2015. 人参内生菌分离鉴定及合成纳米银活性分析[D]. 长春:吉林农业大学:26-45.]
CHANG QQ,FAN JJ,LIU HJ,et al.,2017. Fertility and fungal diversity of rhizosphere soil of Pteroceltis tatarinowii in different regions and their correlation analysis[J]. J Plant Resour Environ,26(3):27-34. [常强强,范佳佳,刘慧君,等,2017. 不同地区青檀根际土壤肥力和真菌多样性及其相关性分析[J]. 植物资源与环境学报,26(3):27-34.]
DING WJ,CAO Q,ZHAO LF,et al.,2014. Effects of biological fertilizer applications on banana wilt disease and soil microorganisms[J]. J Agro-Environ Sci,33(8):1575-1582. [丁文娟,曹群,赵兰凤,等,2014. 生物有机肥施用期对香蕉枯萎病及土壤微生物的影响[J]. 农业环境科学学报,33(8):1575-1582.]
KYEKYEKU JO,KUSARI S,ADOSRAKU RK,et al.,2017. Antibacterial secondary metabolites from an endophytic fungus,Fusarium solani JK10[J]. Fitoterapia,119:108-114.
LAI CY,YUAN GQ,2008. Agricultural plant pathology [M]. Second Edition of Southern China Version. Beijing:Science Press:135-138. [赖传雅,袁高庆,2008. 农业植物病理学[M]. 华南本第二版. 北京:科学出版社:135-138.]
LI J,FENG LD,WANG YK,et al.,2017. Identification and biological characteristics of dominant pathogens of Lycium bararum root rot in Gansu Province[J]. Arid Zone Res,34(5):1093-1100 [李捷,冯丽丹,王有科,等,2017. 甘肃枸杞镰孢菌根腐病病原鉴定及优势病原菌生物学特性[J]. 干旱区研究,34(5):1093-1100.]
LIU Y,DING WJ,CAO Q,et al.,2015. Effects of Allium tuberosum interplanting and bio-organic fertilizer application on banana wilt disease and soil microorganisms[J]. J Agro-Environ Sci,34(2):303-309. [柳影,丁文娟,曹群,等,2015. 套種韭菜配施生物有机肥对香蕉枯萎病及土壤微生物的影响[J]. 农业环境科学学报,34(2):303-309.]
LPEZ-GONZLEZ JA,VARGAS-GARCA MDC,LPEZ MJ,et al.,2015. Biodiversity and succession of mycobiota associated to agricultural lignocellulosic waste-based composting[J]. Bioresour Technol,187:305-313.
MENG LN,XU XH,LI HT,et al.,2014. Effects of sewage sludge compost on chlorimuron-ethyl residue and fungal community structure in soil[J]. J Agro-Environ Sci,33(3):495-501. [孟令男,许修宏,李洪涛,等, 2014. 污泥堆肥对氯嘧磺隆残留及土壤中真菌群落结构的影响[J]. 农业环境科学学报,33(3):495-501.]
METCALF JL,CARTER DO,KNIGHT R,2016. Microbiology of death[J]. Curr Biol,26:561-563.
QIAN XY,SHEN GX,HUANG LH,et al.,2007. Biocontrol effect of three non-pathogenic Fusarium oxysporum strains on tomato fusarium wilt[J]. Acta Agric Shanghai,23(4):60-62. [钱晓雍,沈根祥,黄丽华,等,2007. 3株非致病性镰刀菌Fusarium oxysporum菌株对番茄枯萎病的生物防治效果[J]. 上海农业学报,23(4):60-62.]
QIN LY,LI CS,WEI SL,et al.,2016. Investigation on the occurrence characteristics of physiological race No. 4 of banana fusarium wilt in Guangxi[J]. Fruit Trees S Chin,45(3):93-97. [覃柳燕,李朝生,韦绍龙,等,2016. 广西香蕉枯萎病4号生理小种发生特点调查[J]. 中国南方果树,45(3):93-97.]
VRONIQUE EH,NADINE G,ARNAUD M,et al.,2015. Fusarium diversity in soil using a specific molecular approach and a cultural approach[J]. J Microbiol Methods,111:64-71.
WANG BB,2015. Combined control on fusarium wilt of banana by rotation together with application of bio-organic fertilizer and its action mechanism[D]. Nanjing:Nanjing Agricultural University:45-60. [王蓓蓓,2015. 轮作及生物有机肥防控香蕉土传枯萎病的土壤微生物机制研究[D]. 南京:南京农业大学:45-60.]
WANG F,BAU T,2014. Research advances in the diversity of soil fungi[J]. J Fungal Res,12(3):178-186. [王芳,图力古尔,2014. 土壤真菌多样性研究进展[J]. 菌物研究,12(3):178-186.]
WU ZH,WANG KX,LU WH,et al.,2012. Occurrence trend of banana fusarium wilt in Guangxi and its control thoughts[J]. Chin Plant Protect,32(7):54-55. [吴志红,王凯学,卢维海,等,2012. 香蕉枯萎病在广西的发生趋势及其防控思路[J]. 中国植保导刊,32(7):54-55.]
XIE LH,2006. General plant pathology[M]. Beijing:Science Press:53-77. [谢联辉,2006. 普通植物病理学[M]. 北京:科学出版社:53-77.]
XUE C,2015. Manipulation of microbial community in banana rhizospherer to suppress fusarium wilt of banana[D]. Nanjing:Nanjing Agricultural University:41-53. [薛超,2015. 香蕉根际土壤微生物区系特征與土传枯萎病防控研究[D]. 南京:南京农业大学:41-53.]
ZHANG QH,2014. Evalution of the diversity and biocontrol potential of the endophytic fungi in oilseed rape[D]. Wuhan:Huazhong Agricultural University:38-48. [张清华,2014. 油菜内生真菌的多样性及生防潜力评估[D]. 武汉:华中农业大学:38-48.]
ZHAO M,HE HW,ZOU Y,et al.,2015. Investigation on banana fusarium wilt in Guangxi and study on control effect of interplanting Allium tuberosum[J]. Fruit Trees S Chin,44(5):55-58 [赵明,何海旺,邹瑜,等,2015. 广西香蕉枯萎病为害调查及套种韭菜防控效果研究[J]. 中国南方果树,44(5):55-58. ]
ZHONG ST,SHEN ZZ,SUN YF,et al.,2015. Effects of continuous application of bio-organic fertilizer on banana production and cultural microflora of bulk soil in orchard with serious disease incidence [J]. Chin J Appl Ecol,26(2):481-489. [钟书堂,沈宗专,孙逸飞,等,2015. 生物有机肥对连作蕉园香蕉生产和土壤可培养微生物区系的影响[J]. 应用生态学报,26(2):481-489.]
ZHUANG WY,2010. Taxonomy and related studies on the nectrioid fungi from China[J]. Chin Bull Life Sci,22(11):821-848. [庄文颖,2010. 我国丛赤壳类真菌分类研究[J]. 生命科学,22(11):1083-1085.]
(责任编辑 何永艳)

