中晚期原发性肝癌患者TACE术后早期复发危险因素
邓 林,孙文杰,高知玲,杨冠华,任 涛,陈 勇
(1.宁夏医科大学临床医学院,宁夏 银川 750004;2.宁夏医科大学总医院放射科,3.放射介入科,宁夏 银川 750004)
肝细胞癌(hepatocellular carcinoma, HCC)是全球第4大癌症死亡原因,患者多并发肝炎或肝硬化。全球范围内每年新增约84万例HCC患者,其中约78万例死亡[1],我国每年约38.3万人死于HCC,确诊HCC时70%以上患者已失去外科手术机会[2]。TACE是治疗不能手术切除的HCC的主要方法之一,但术后肿瘤复发率高。本研究探讨中晚期原发性HCC患者TACE术后早期复发的相关危险因素。
1 资料与方法
1.1 一般资料 回顾性分析2016年3月—2018年6月宁夏医科大学总医院收治的42例中晚期原发性HCC患者,男31例,女11例,年龄31~73岁,平均(54.9±10.3)岁;肿瘤最大径2.20~13.76 cm,平均(4.16±2.53)cm;每例存在1~8个瘤灶,平均(2.24±1.61)个;肝功能Child-Pugh分级A级29例,B级13例;巴塞罗那肝癌临床分期(Barcelona clinic liver cancer, BCLC)B期32例,C期10例;肿瘤分化程度:高分化14例,中分化13例,低分化15例。纳入标准:①经穿刺病理检查确诊为HCC[3];②接受TACE治疗;③TACE术前未经手术、放射治疗、化学治疗及靶向治疗。排除标准:①合并其他系统原发恶性肿瘤;②HCC破裂出血;③有远处转移;④随访资料不完整。
术前完善常规查体、实验室检查(血常规、生化常规、凝血四项、肿瘤标志物)及MR多期增强扫描+弥散加权成像(DWI)检查。由2名具有5年以上工作经验的影像科医师阅读MRI,意见不同时经协商达成一致;采用GE AW 4.3工作站自动处理DWI图像,于病灶直径最大层面实性部分测量ADC值,测量3次,取平均值。
1.2 仪器与方法 采用Siemens Biplannar Artiz DSA机。以Seldinger技术穿刺右侧股动脉,在DSA引导下插管至腹腔干,注射对比剂进行造影;明确肿瘤供血动脉后,以5F导管及SP微导管超选供血动脉,而后以吡柔比星20~40 mg与5~10 ml超液化碘油乳剂在透视下缓慢栓塞,必要时以明胶海绵颗粒辅助栓塞;栓塞终点为造影显示对比剂滞留在2、3级分支动脉,肿瘤染色消失[4]。
1.3 随访观察 TACE术后随访6个月,复查CT和/或MRI,参照改良实体肿瘤疗效标准(modified response evaluation criteria in solid tumors, mRECIST)[5]判定肿瘤有无复发。
1.4 统计学分析 采用SPSS 22.0统计分析软件。计量资料均符合正态分布,以±s表示,组间比较采用两独立样本t检验;计数资料比较采用χ2检验或Fisher确切概率法。以多因素Logistic回归方程分析早期复发危险因素。P<0.05为差异有统计学意义。
2 结果
术后6个月中,23例HCC早期复发(复发组,图1),19例未复发(未复发组)。复发组白蛋白>35 g/L者占比低于未复发组(P<0.05),甲胎蛋白(alpha-fetoprotein, AFP)>400 ng/ml者占比及谷氨酰基转移酶(alanine transaminases, ALT)水平均高于未复发组(P均<0.05)。未复发组肿瘤分化程度较高(P<0.05)。2组患者年龄、性别、并发疾病、肝功能Child-Pugh分级、BCLC分期、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、γ-谷氨酰基转移酶(γ-glutamyltransferase, GGT)、总胆红素、血小板及凝血酶原时间(prothrombin time, PT)差异均无统计学意义(P均>0.05),见表1。
复发组患者瘤灶相对多发,且肿瘤最大径较大,肿瘤ADC值和包膜完整比例低于未复发组(P均<0.05);2组肿瘤T1WI及T2WI信号强度、强化方式、有无门脉癌栓差异均无统计学意义(P均>0.05),见表2。多因素Logistic回归分析结果显示,AFP>400 ng/ml者占比、肿瘤分化程度、瘤灶数量及肿瘤ADC值是TACE术后HCC早期复发的独立危险因素(P均<0.05),见表3。
3 讨论
TACE已成为延长不能手术切除或不宜局部消融的HCC患者生存期的重要方法。既往文献[6]报道,TACE术后HCC患者1年生存率为70.3%,2年为51.8%,3年为40.4%,5年为32.4%,肿瘤坏死率低、复发率高可能是影响患者预后的关键[7]。明确TACE术后HCC复发的相关危险因素,并早期干预,有利于改善预后。

表1 复发者与未复发者一般资料及临床资料比较
既往文献[4,8]报道, TACE术后HCC早期复发的危险因素包括肿瘤位置、直径、数量,肿瘤标志物AFP、病毒标志物及患者年龄和肝功能。本研究对42例中晚期原发性HCC患者于TACE术后随访6个月,结果显示23例早期复发、19例未复发,2组间白蛋白>35 g/L者占比、AFP>400 ng/ml者占比、ALT水平、瘤灶数量、肿瘤最大径、肿瘤分化程度、肿瘤ADC值及包膜完整比例差异均有统计学意义;多因素分析结果显示,AFP>400 ng/ml者占比、瘤灶数量、肿瘤ADC值及分化程度与术后早期复发相关,与文献[4,8]报道不完全相同,原因可能为样本量不同及研究对象本身存在差异。

图1 患者男,66岁,原发性HCC A.TACE术前肝脏MRI,动脉期均匀强化,病灶直径3.30 cm; B.DWI示病灶呈高信号; C.TACE术中造影示肿瘤染色; D.栓塞后肿瘤染色消失; E、F.术后4.5个月,动脉期MRI(E)及DWI(F)示肿瘤复发
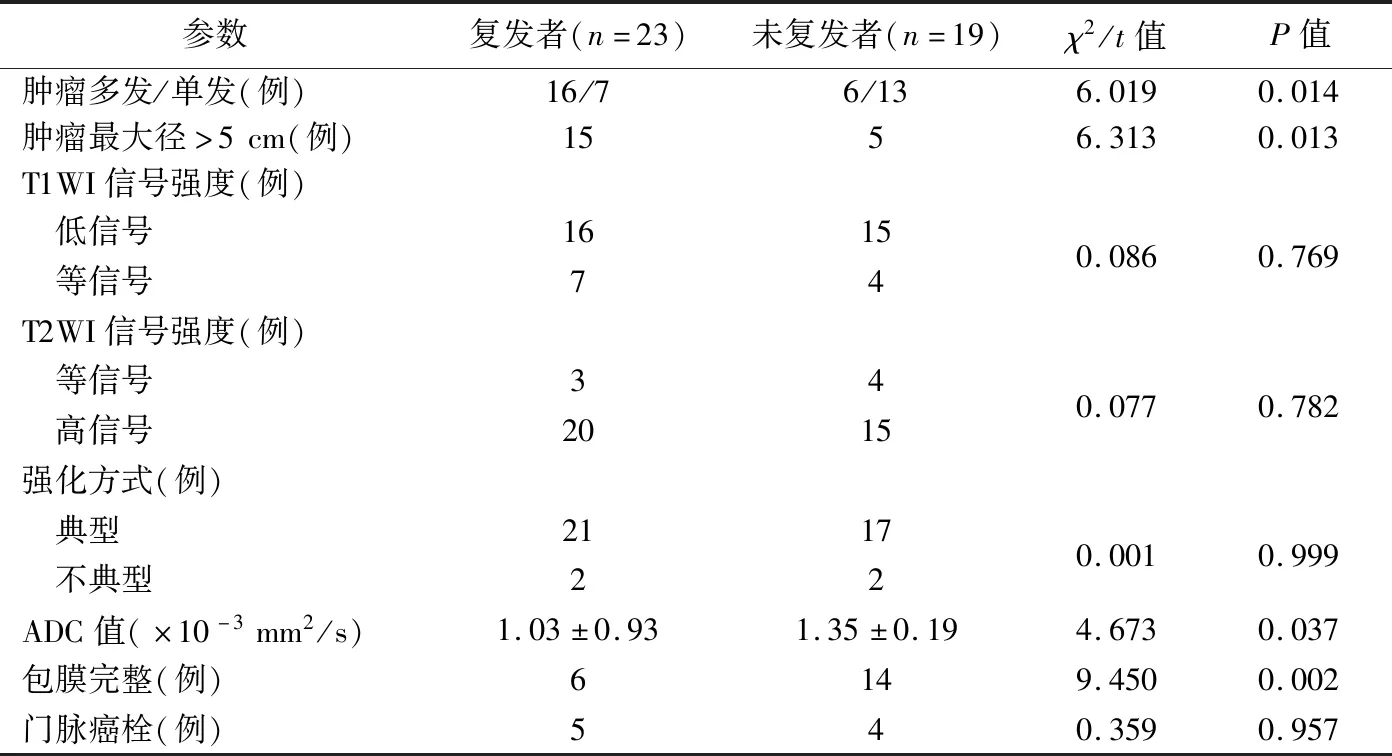
表2 复发与未复发者HCC瘤灶MRI特征比较

表3 TACE术后HCC早期复发的多因素Logistic回归分析
HCC患者血清AFP水平升高被认为是肿瘤分化程度较低的标志[9]。本研究中HCC患者术前AFP>400 ng/ml是TACE术后早期复发的预测因素。AFP在免疫系统中对抑制和促进肿瘤细胞生长均具有重要作用,可通过改变CD4+T、CD8+T淋巴细胞亚群比例,诱导淋巴细胞死亡,从而抑制机体免疫功能。免疫系统功能低下促进肿瘤复发和转移[10]。CD4+T淋巴细胞能发现、识别并消灭癌前细胞。若CD4+T淋巴细胞减少则抑制CD8+T淋巴细胞激活,使抗肿瘤细胞因子分泌不足,降低抗癌作用[11]。
本研究中复发患者血清ALT水平高于未复发者。DOUHARA等[12]报道,ALT水平是TACE术后HCC早期复发的独立危险因素。血清ALT水平反映肝功能状况,ALT水平越高提示肝功能越差。本研究42例HCC患者中,33例伴肝硬化,肝功能差,肝硬化结节易从不典型增生发展为癌变,出现新发病灶而复发。此外,本研究复发者白蛋白>35 g/L者占比低于未复发者,与王文军等[13]研究相符。白蛋白反映机体的营养状态、肝脏合成功能及肝细胞损伤情况,其水平较低提示伴有不可逆性肝损害,TACE术后易出现肝内复发[14]。
多发HCC是由多个独立的肿瘤(多中心HCC)或原发性HCC发生肝内转移发展而来。多发HCC是进展期HCC的表现,预后多不佳[15]。大肿瘤多由低分化的癌细胞组成,恶性程度高。本研究复发组肿瘤最大径大于未复发组。低分化的大肿瘤易发生微血管侵犯和转移[15],同时,肿瘤增大会加速破坏包膜,使包膜不完整,导致微血管侵犯及肝内转移。最大径>5 cm的肿瘤体积大,增长速度快,对周围间质的压力增加,致肿瘤毛细血管被压闭[16],使TACE治疗时碘油不能完全沉积在肿瘤内而导致术后复发[17]。
HCC的包膜通常由纤维结缔组织和扩张的肝血窦混合而成。包膜是进展期HCC伴膨胀性生长的病理特征。进展期HCC恶性程度高,侵袭血管和转移能力强[18]。相对于包膜不完整者,包膜完整HCC发生微血管侵犯的风险低,完整的包膜可以阻止肿瘤细胞的浸润及转移,不易形成侧支循环,而包膜不完整则提示肿瘤易通过包膜进入周围组织,预后不良[16]。
本研究复发者瘤灶ADC值低于未复发者,提示ADC值是HCC早期复发的独立危险因素,与WU等[19]报道相符。研究[20]表明,通过肿瘤ADC值可以观察TACE疗效。ADC值反映水分子扩散程度,肿瘤ADC值与细胞密度呈负相关:细胞密度增加时,细胞外间隙减小,限制水分子扩散,ADC值相应减小;而细胞密度也是肿瘤细胞分化和恶性程度的重要指标,故ADC值可能在某种程度上反映肿瘤恶性程度。ZHU等[21]报道,ADC值与病变组织病理分化和微血管侵犯相关。本研究中低分化HCC的ADC值低于高分化HCC,提示ADC值低的HCC分化程度低,恶性程度高,TACE术后复发的可能性大。
本研究的局限性:为单中心回顾性研究,样本量较小;排除了术后6个月内失访者和死于其他疾病者,可能导致选择偏倚。
综上所述,术前AFP、肿瘤分化程度、ADC值及瘤灶数量是TACE术后HCC早期复发的独立危险因素;ALT、白蛋白水平及肿瘤包膜是否完整对TACE术后HCC复发也有一定预测价值。

