基于化学衍生-质谱技术的生物与临床样本中核酸修饰分析
游雪娇,袁必锋,冯钰锜
(武汉大学 化学与分子科学学院,生物医学分析化学教育部重点实验室,湖北 武汉 430072)
核酸(DNA和RNA)中除了包括经典碱基,即腺嘌呤(Adenine,A)、鸟嘌呤(Guanine,G)、胞嘧啶(Cytosine,C)、胸腺嘧啶(Thymine,T)和尿嘧啶(Uracil,U)外,还包含许多化学修饰[1-3]。这些化学修饰不改变核酸的序列,但会改变其结构和生化特性,最终调节基因的时空表达[1-2,4]。
DNA胞嘧啶甲基化(5-Methyl-2′-deoxycytidine,5-mdC)是基因组DNA中研究最为广泛的一种表观遗传修饰,研究证明5-mdC涉及调控基因表达、细胞分化、个体发育等多种重要生理功能[5]。近年来,在基因组DNA中发现了越来越多的修饰[6]。最近的研究表明,TET(Ten eleven translocation)蛋白能够转化5-mdC生成5-Hydroxymethyl-2′-deoxycytidine(5-hmdC)、5-Formyl-2′-deoxycytidine(5-fdC),最后转化为5-Carboxyl-2′-deoxycytidine(5-cadC)[7-8]。除DNA胞嘧啶甲基化外,还在真核细胞中发现了DNA腺嘌呤甲基化(N6-Methyl-2′-deoxyadenine,6mA)[9-10]。与5-mdC类似,DNA中的这些新修饰在多种生理过程的调节中起着关键作用[11]。
RNA是将DNA遗传信息与蛋白质联系起来的中间分子。鉴于DNA修饰的重要调节作用,最近对RNA可逆修饰的发现开启了真核生物转录后基因调控的新时代[12]。细胞RNA中目前发现了超过150种结构不同的修饰类型[13-14],其中大多数修饰是动态、可逆的,可调节RNA的结构和功能,从而影响基因的时空表达[15]。
DNA和RNA修饰在体内的丰度通常极低[16-17]。如哺乳动物mRNA中N3-Methylcytidine的含量可以低至每百万个核苷仅含几个修饰[18]。因此,高灵敏和特异的检测方法对于剖析这些修饰的功能至关重要。新技术的发展在很大程度上促进和改变了表观遗传修饰领域。质谱(Mass spectrometry,MS)因具有高的灵敏度和选择性,已成为最突出的核酸修饰分析技术之一[19-28]。然而,直接质谱分析对低丰度核酸修饰的鉴定和分析仍存在一些不足。
化学衍生能够改变分析物的化学和物理性质,与质谱分析相结合可以改善分析对象的色谱分离和提高电喷雾电离(Electrospray ionization,ESI)-MS分析过程中的电离效率,最终提高分析物的检测性能[29-33]。在过去的几年中,本课题组以及其他研究者开发了多种基于化学衍生-质谱分析的方法对DNA和RNA修饰进行高灵敏和选择性分析。本文总结了通过化学衍生-质谱分析方法破译核酸修饰的最新进展,讨论了这些分析方法的优缺点,并提供利用这些技术解决生物和临床样本中核酸修饰分析的典型例子。
1 基于化学衍生-质谱技术的核酸修饰分析
在过去的几年中,化学衍生与质谱分析相结合的策略在很大程度上改善了DNA和RNA修饰的检测,并促进了这些修饰的功能研究。本文基于分析衍生产物的质谱平台,对化学衍生-质谱技术分析核酸修饰的方法进行如下分类:化学衍生结合液相色谱-质谱联用(Liquid chromatography-mass spectrometry,LC-MS)、化学衍生结合基质辅助激光解吸电离质谱(Matrix assisted laser desorption/ionization-mass spectrometry,MALDI-MS)和化学衍生结合气相色谱-质谱联用(Gas chromatography-mass spectrometry,GC-MS)(图1)。本文讨论并总结了不同方法的优点和局限性。
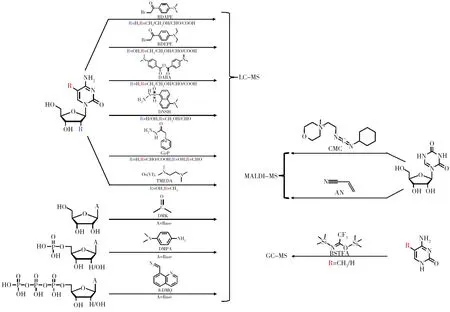
图1 化学衍生化-质谱分析核酸修饰的原理图
1.1 化学衍生-LC-MS
1.1.1 DNA修饰除A,C,T,G和5-mdC之外,5-hmd因其重要的生理功能,被视为哺乳动物基因组的第6个碱基[34]。哺乳动物细胞基因组DNA中的5-hmdC含量低,LC-MS对5-hmdC的定量分析常受到高丰度正常核苷的离子抑制。为解决该问题,本课题组建立了一种新方法:使用T4β-葡萄糖基转移酶选择性地将葡糖基标记到5-hmdC的羟甲基中,形成更亲水的产物,即β-Glucosyl-5-hydroxymethyl-2′-deoxycytidine(5-gmdC)[35]。在进行LC-MS分析前,通过NH2-二氧化硅的亲水相互作用选择性地富集5-gmdC,从而消除正常核苷的离子抑制,显著提高了对5-hmdC的检测灵敏度和准确度。利用已建立的方法,在3种培养的哺乳动物细胞和7种酵母菌株的基因组DNA中鉴定了5-hmdC修饰。
为了对植物DNA中可能存在的低含量5-fdC和5-cadC进行灵敏和定量分析,本课题组采用吉拉德试剂(吉拉德D、吉拉德T和吉拉德P)对5-fdC和5-cadC进行衍生化。吉拉德试剂含有易电离的叔胺或季铵,且能同时与5-fdC的醛基和5-cadC的羧基在温和条件下反应(图2)[36]。通过建立的高灵敏度检测方法,在拟南芥和水稻基因组DNA中鉴定发现了5-fdC和5-cadC。此外,还发现干旱和盐的环境胁迫可改变水稻基因组中5-fdC和5-cadC的含量,表明5-fdC和5-cadC在对环境胁迫的响应中起重要作用。但由于5-fdC和5-cadC的衍生化是依次进行的,这使得分析过程相对较为复杂。基于相似的原理,Hong等[37]通过含有季铵基团的吉拉德T试剂衍生来测定DNA中的5-Formyl-2′-deoxyuridine(5-fdU)。衍生化与LC-MS分析结合使5-fdU的检出限(Limits of detection,LOD)达到3~4 fmol,这比直接质谱分析5-fdU的灵敏度提高了约20倍。

图2 吉拉德试剂衍生化结合LC-MS分析方法测定植物基因组DNA中5-fdC和5-cadC的示意图[36]
5-mdC及其氧化产物(5-hmdC、5-fdC和5-cadC)在DNA中的丰度差别很大,对这些胞嘧啶修饰进行同时定量检测具有挑战性。鉴于此,本课题组建立了2-Bromo-1-(4-dimethylaminophenyl)-ethanone(BDAPE)衍生结合LC-MS的分析方法,用于同时高灵敏测定4种胞嘧啶修饰(5-mdC、5-hmdC、5-fdC和5-cadC)[38]。衍生试剂BDAPE易与胞嘧啶的N3和N4位置反应,形成稳定的五元环结构,可实现这4种胞嘧啶修饰的同时衍生化。BDAPE含有一个疏水性的苯基和一个易带电的叔铵基,衍生化后能显著改善这些胞嘧啶修饰的液相色谱分离,并能显著提高它们的质谱检测灵敏度。经BDAPE衍生化后,这些胞嘧啶修饰的检测灵敏度提高了35~123倍。利用此方法,成功定量了结直肠患者癌症组织和癌旁组织中的5-mdC、5-hmdC、5-fdC和5-cadC。结果显示,与癌旁组织相比,人的结直肠癌组织中5-hmdC、5-fdC和5-cadC的含量显著降低,表明这些修饰在癌症形成中具有潜在作用,这些修饰的减少可能是结直肠癌患者的一个普遍特征,暗示胞嘧啶修饰可作为早期诊断和预后的潜在生物标志物。由于盐能够造成胞嘧啶修饰的BDAPE衍生化效率降低,因此需通过固相萃取(Solid phase extraction,SPE)纯化酶解消化的核苷从而去除盐对衍生化反应的影响。
除BDAPE衍生化外,Guo等[39]最近使用4-(二甲基氨基)苯甲酸酐同时衍生DNA中4个胞嘧啶修饰(5-mdC、5-hmdC、5-fdC和5-cadC)的氨基,LODs为1.2~2.5 fmol。通过建立的方法,发现人乳腺癌组织中5-fdC和5-cadC的含量比相邻的正常组织高。8-Nitroguanine(8-nitroG)是由过氧亚硝酸盐在炎症过程中产生的主要核酸损伤,是一种可评估炎症相关癌变的潜在生物标志物。最近,Hu等[40]开发了一种6-Methoxy-2-naphthyl glyoxal hydrate(MTNG)衍生化结合在线SPE/LC-MS的策略分析8-nitroG。8-nitroG经MTNG衍生化后,通过在线SPELC-MS分析,检测灵敏度提高约10倍。该方法用于定量测定8-nitroG的灵敏度高、可靠性好,可用于实验室和临床研究,以了解炎症相关DNA损伤与癌变之间的关系。此外,由于MTNG可与8-nitroG以及其他鸟嘌呤化合物反应,因此需加入过量的MTNG并在质谱分析之前通过SPE除去过量的MTNG。
最近,Yu等[41]提出一类基于肼的衍生化试剂用于高灵敏分析胞嘧啶修饰。这类衍生化试剂含有一个反应基团肼基,以及一个疏水三嗪基和两个易带电荷的叔胺基用于调节衍生产物的疏水性。筛选出的基于肼的试剂能同时与5-fdC和5-cadC快速反应,使5-fdC和5-cadC的检测灵敏度分别提高了125倍和100倍。使用该方法,5-fdC和5-cadC的LODs可低至10 amol和25 amol,实现了两者的高灵敏定量检测,该方法用600 ng基因组DNA便可同时检测不同组织中的5-fdC和5-cadC,为珍贵样品中5-fdC和5-cadC的分析提供了有效方法。
此外,Zhou等[42]使用氰基磷叶立德试剂(YC-CN)建立了一种有效的5-fdC衍生化方法,该方法利用YC-CN与5-fdC上醛基的Wittig反应,提出了一种基于光辅助三重多米诺反应策略,不仅能对5-fdC快速检测,还能实现5-fdC和5-fdU的区分。通过该策略,能准确定量由γ辐射形成的5-fdC,表明该方法具有显著的选择性和敏感性。YC-CN的高反应活性和高效的光催化策略使其成为5-fdC的快速衍生化方法。这种Wittig启动的共价标记策略为5-fdC的定性和定量检测提供了一种新策略。此外,该研究也为从反应机理的角度区分5-fdC和5-fdU提供了新的思路。
1.1.2 RNA修饰除了氧化DNA中5-mdC生成5-hmdC,TET蛋白还可以催化RNA中的5-Methylcytidine(5-mrC)形成5-Hydroxymethylcytidine(5-hmrC)[43]。为探索RNA中5-hmrC的进一步氧化产物5-Formylcytidine(5-frC),本课题组开发了氧化衍生化与质谱相结合的策略(Oxidation-derivatization combined with MS,ODMS)[44]。该策略使用MnO2将5-hmrC氧化成5-frC,产生的5-frC进一步用丹磺酰肼衍生化。5-frC中的醛基可以很容易与丹磺酰肼中的酰肼反应,产生具有易带电的叔铵腙衍生物,从而能够在LC-MS分析中提高5-frC的电离效率(图3)。通过ODMS策略发现哺乳动物细胞RNA中存在5-frC。定量结果显示RNA中5-frC的含量在HeLa细胞中为(9.0±1.2)/106rG,在HEK293T细胞中为(8.5±1.4)/106rG。此外,本课题组建立了2-Bromo-1-(4-diethylaminophenyl)-ethanone(BDEPE)衍生化与LC-MS相结合的分析方法,用于高灵敏和同时测定RNA中5-mrC的氧化产物[45]。结果表明,经BDEPE衍生化后,RNA中5-mrC、5-hmrC、5-frC和5-Carboxylcytidine(5-carC)的检测灵敏度提高了70~313倍。使用该方法发现了哺乳动物RNA中存在5-carC。此外,还发现与癌旁组织相比,人结直肠癌组织和肝细胞癌组织中5-hmrC的含量显著降低,表明RNA中5-hmrC在调控肿瘤的发生和形成中可能发挥一定作用。另外,使用建立的高灵敏分析方法探索了环境重金属污染物(砷、镉、铬和锑)对核酸修饰的影响,发现小鼠胚胎干细胞DNA中的5-hmdC、5-fdC、5-cadC和RNA中5-hmrC、5-frC、5-carC的含量在重金属处理后显著降低,暗示重金属可造成表观遗传修饰紊乱的新毒性机制[46]。
除化学衍生/LC-MS分析外,本课题组最近建立了一种吉拉德P试剂衍生化与管内固相微萃取以及LC-MS相结合的分析策略,用于高灵敏测定醛基化DNA和RNA修饰(图4)[47]。携带负电的羧基填料可富集带正电荷的衍生物,从而消除高丰度正常核苷的干扰,提高醛基化DNA和RNA修饰分析的检测性能。使用该方法同时检测了6种醛基化核苷,包括来自培养的哺乳动物细胞和多种哺乳动物组织DNA中的5-fdC和5-fdU,以及RNA中的5-frC、5-Formyluridine(5-frU)、2'-O-methyl-5-formylcytidine(5-frCm)和2'-O-Methyl-5-formyluridine(5-frUm)。该方法使醛基化核苷的检测灵敏度提高了307~884倍。这是首次在培养的哺乳动物细胞和组织中发现5-frU、5-frCm和5-frUm。此外,还观察到人甲状腺癌组织RNA中的5-frC和5-frU以及DNA中的5-fdU的表达比癌旁组织高。结果显示异常的DNA和RNA醛基化修饰可能参与肿瘤的形成和发展,同时暗示了DNA和RNA的醛基化修饰也可作为癌症诊断的指标。但该方法需制备携带负电的填料,分析较为繁琐,可能限制其在不同实验室中的应用。
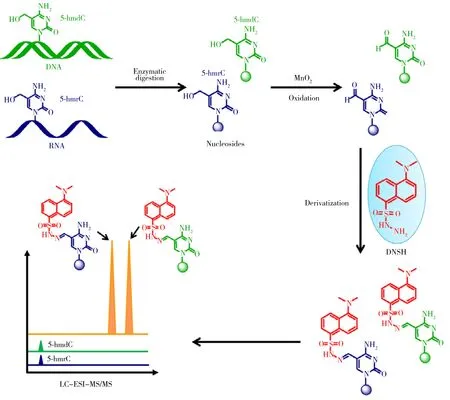
图3 氧化衍生化结合LC-MS分析方法测定DNA中5-hmdC、5-fdC和RNA中5-hmrC、5-frC的示意图[44]

图4 吉拉德P试剂衍生化结合管内固相微萃取和LC-MS/MS分析方法测定DNA和RNA醛基化修饰示意图[47]
与ESI-MS一样,电感耦合等离子体质谱(Inductively coupled plasma-mass spectrometry,ICP-MS)也是核酸修饰研究中的有益工具。Wrobel等[48]提出了一种基于LC-ICP-MS灵敏检测RNA中5-mrC的策略。该策略依赖于通过在顺式二羟基核糖基团、锇酸钾(Ⅵ)二水合物(K2OsO2(OH)4)和四甲基乙二胺之间形成三元复合物在核糖上衍生锇(Os)。该方法能实现对5-mrC的灵敏分析,其LOD可达21 pmol/L。
1.1.3 游离核苷/核苷酸修饰检测生物体中的内源性修饰核苷可作为一种非侵入性的疾病诊断方法。为了实现生物体中修饰核苷的全面分析,本课题组建立了金属氧化物分散SPE,随后进行稳定同位素标记和双中性丢失扫描质谱分析方法[49]。CeO2常被用于复杂生物样品中核糖缀合物的选择性捕获[50-51]。富集的核苷可用丙酮和丙酮-D6进行衍生化,丙酮和丙酮-D6的衍生化产物在相同条件下被电离,但在质谱上单独记录,这可以显著提高检测特异性并促进对修饰核苷的鉴定。使用该方法在人尿液中鉴定出49种核糖缀合物,其中7种核糖缀合物的含量在健康组和淋巴瘤患者之间表现出明显差异[49],为尿液中修饰核苷的有效分析奠定了良好的基础,同时为尿液中修饰核苷作为癌症指标的应用提供了准确结果。此外,Li等[52]使用类似的策略鉴定了尿液样本中的52种修饰核苷。由于该分析策略取决于携带顺式二羟基的核糖核苷的富集,因此不能富集和检测2'-O-甲基化核苷。
除甲基转移酶介导的DNA和RNA甲基化外,甲基化的核苷酸可能在复制和转录过程中潜在地掺入DNA和RNA中。为了探索内源修饰核苷酸的存在,本课题组建立了N,N-二甲基对苯二胺(N,N-Dimethsyl-p-phenylenediamine,DMPA)衍生化与LC-MS结合的方法,可同时高灵敏测定5-Methyl-2'-deoxycytidine monophosphate(5-Me-dCMP)和5-Methylcytidine monophosphat(5-Me-CMP)等10种核苷酸(图5)[53]。经过DMPA衍生化后,核苷酸的检测灵敏度增加了88~372倍。采用该方法发现内源性的5-Me-dCMP和5-Me-CMP广泛存在于培养的哺乳动物细胞、人组织和尿样中。此外,还发现肾癌组织和淋巴瘤患者尿液中5-Me-dCMP和5-Me-CMP的含量与正常人相比明显降低,暗示修饰核苷酸对癌症基因异常调控具有潜在的作用。最近,本课题组进一步建立了8-(重氮甲基)喹啉衍生化结合LC-MS的分析方法,用于测定哺乳动物细胞和组织中内源性修饰的核苷三磷酸(Nucleoside triphosphates,NTP)(图6)[54]。结果显示,合成的8-(重氮甲基)喹啉可在温和条件下与NTP的磷酸基团有效反应,所建立的方法能实现NTP的灵敏检测,检测灵敏度提高了56~137倍。通过该方法,在哺乳动物细胞和组织中鉴定了12种内源性修饰的NTP。此外,与癌旁组织相比,这些修饰的NTP在人肝细胞癌组织中的含量明显降低。这些研究揭示了真核生物中广泛存在修饰的NTP,为DNA和RNA的修饰提供了新来源。由于重氮基易降解,8-(重氮甲基)喹啉的稳定性较差,因此在进行衍生化反应时需要注意。

图5 DMPA标记单磷酸核苷酸示意图[53]
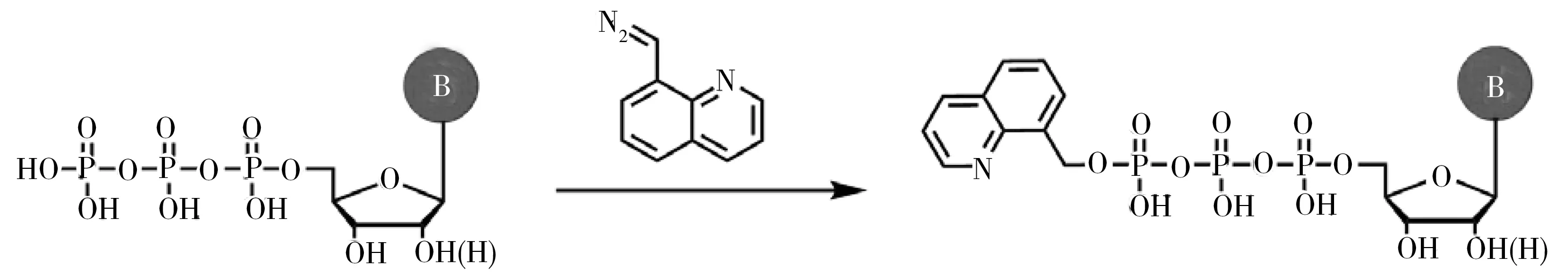
图6 8-(重氮甲基)喹啉标记三磷酸核苷酸示意图[54]
1.2 化学衍生-MALDI-MS
Pseudouridine(Ψ)是U的一种异构化修饰,也是RNA中的一种质量沉默修饰,难以通过常规的质谱检测进行识别。为了解决该问题,Patteson等[55]开发了一种1-环己基-3-(2-吗啉乙基)碳二亚胺(1-Cyclohexyl-3-(2-morpholinoethyl) carbodiimide,CMC)衍生化方法,结合MALDI-MS分析,用于测定RNA中的Ψ。在CMC衍生化之后,每个Ψ有252 Da的质量增加,可通过MALDI-MS进行分析鉴定。为确定Ψ的序列位置,可将CMC衍生化前后的产物RNase T1消化后进行MALDI-MS分析。然而,由于CMC也能够标记其它尿苷,这对分析含有许多尿苷残基的RNA是不利的。该课题组通过优化反应时间、温度、pH值和CMC与样品的比例来改善CMC衍生化条件[56]。在优化的衍生化条件下,可降低由于不完全衍生化造成的假阳性。此外,这种方法还可为含有Ψ的特定小RNA提供信息[57]。
研究表明,Ψ中的N1位置处可被特异性氰乙基化[58]。与CMC衍生化相比,Ψ可以完全氰乙基化,而正常尿苷仅被标记约5%。这种方法能实现Ψ的一步衍生化,并且避免了对RNA骨架的破坏。Mengel-Jorgensen等[59]使用该衍生化策略并结合MALDI-MS分析了tRNA中的Ψ。Ψ的氰乙基化会产生53 Da的质量增加,因此很容易通过MALDI-MS检测。通过该策略,研究者成功地鉴定了来自大肠杆菌的tRNATyrII中的一个Ψ位点。MALDI-MS与氰乙基化的组合成为基于质谱检测Ψ的有效方法[59]。
1.3 化学衍生-GC-MS
气相色谱-质谱被广泛用于痕量化合物的测定。然而,DNA和RNA修饰不是挥发性的,不能通过GC-MS直接分析。因此,化学衍生化通常用于在GC-MS分析前将碱基/核苷转化为挥发性衍生物。
Singer等[60]开发了一种检测小牛胸腺、鲑鱼精子和几种小鼠组织的基因组DNA中5-Methylcytosine(5-mC)的方法。使用88%甲酸在180 ℃下将DNA水解成碱基,然后用双(三甲基甲硅烷基)三氟乙酰胺(N,O-bis-(Trimethylsilyl)-trifluoroacetamide,BSTFA)衍生化碱基,得到的C和5-mC的衍生物可以很容易地被分离,且不会干扰其他正常碱基,该方法能检测到DNA中低至1.6 pmol的5-mC。之后,Romerio等[61]引入了[2-13C]5-mC和[2-13C]C两个同位素标记的内标,提供了基因组DNA中5-mC更准确的定量。该方法成功应用于外周血单核细胞DNA中5-mC的检测。
本课题组采用GC-MS开发了一种用于研究酵母基因组DNA中5-mC[62]的高灵敏度分析方法,用88%甲酸水溶液在140 ℃下将提取的DNA水解成嘌呤和嘧啶,然后使用BSTFA和三甲基氯硅烷在乙腈中进行衍生化,5-mC的LOD达到0.8 pg(6.4 fmol)。并通过该方法,在19种酵母菌株中鉴定了5-mC,含量为0.014%~0.364%,表明酵母基因组中广泛存在DNA胞嘧啶甲基化修饰。
2 结论与展望
最近的研究进展证明DNA和RNA修饰是动态、可逆的,这些修饰增加了核酸的多样性,更重要的是,增加了生理过程中新的调节因子。对DNA和RNA修饰的功能研究为深入理解疾病的分子机制提供了有价值的信息,新技术和新方法的快速发展也极大地推动了核酸修饰的研究。
设计和使用适当的衍生化试剂以实现快速、高效和特异性衍生目标修饰对于将来探索核酸修饰的功能是非常重要的。但是基于化学衍生-质谱分析的方法也存在一定局限性,如副产物的形成和过量衍生化试剂引起的新问题。因此,仍需开发新的衍生化试剂和衍生化反应,以便通过质谱进行高灵敏和选择性地检测核酸修饰。通过分析DNA和RNA修饰的化学结构可为设计合适的衍生化试剂提供有用的指导。新衍生化试剂和衍生化反应的发展可能会有助于发现新的DNA和RNA修饰,这也将为核酸修饰与疾病相关研究提供新线索。除了破译核酸修饰外,化学衍生与质谱分析技术相结合还可以扩展到如蛋白质组学研究、代谢组学研究和质谱成像等各种研究领域。

