HIGS-SsCCS 转基因拟南芥的菌核病抗性鉴定
柴亚茹,丁一娟,周思钰,杨文静,闫宝琴,远俊虎,钱伟
(西南大学农学与生物科技学院,重庆 400715)
0 引言
【研究意义】核盘菌(Sclerotinia sclerotiorum)为隶属于子囊菌门、核盘菌属的一种植物病原真菌,其寄主广泛,可以侵染包括油菜、马铃薯、棉花、番茄、大豆等多种重要的农作物在内的400 多种植物[1-3],造成巨大的作物产量损失。目前对菌核病的防治主要依靠化学杀菌剂,但该方法成本高、影响环境,且易产生耐药菌株导致防治效果不理想,因此创建高抗材料是菌核病防治的关键。近年来,寄主诱导的基因沉默技术(host-induced gene silencing,HIGS)在研究病原菌基因功能及增强寄主抗病性中起着越来越重要的作用[4]。因此,利用 HIGS 技术在拟南芥(Arabidopsis thaliana)中沉默核盘菌铜锌超氧化物歧化酶铜伴侣基因(copper chaperone for copper/zinc superoxide dismutase,SsCCS),获得抗性稳定持久的材料,可为油菜等作物的抗菌核病育种提供新方法,并为安全防控菌核病提供重要靶标基因。【前人研究进展】目前创制菌核病抗病材料的方法主要包括以下几种:一种方法是通过杂交、回交等传统选育方式培育抗病品种,另一种方法是通过在植物体内过表达抗病相关基因,从而增强植株的抗病性,以及通过细胞工程及诱变育种的方式进行抗病品种的培育[5]。但抗病遗传资源缺乏,以及核盘菌致病机理复杂,相关的抗病位点开发以及抗病分子机制的研究受到限制,导致菌核病抗病育种进程缓慢。近年来在真菌、细菌、病毒、植物、线虫、人中都发现基因沉默(RNAi)现象[6-8],RNAi 是由双链RNA(dsRNA)介导的、由特定酶参与的特异性基因沉默,它在转录水平、转录后水平和翻译水平上阻断基因的表达。前人研究发现利用携带特定基因片段的不同病毒载体侵染本氏烟,可以导致特定靶基因的沉默,进而发展了病毒介导的基因沉默(virus-induced gene silencing,VIGS)技术[4]。寄主诱导的基因沉默(host-induced gene silencing,HIGS)技术是VIGS 的进一步发展[9],HIGS 通常以病原菌生长发育、致病过程中的关键基因作为靶标基因,通过将靶标基因的反义发夹结构或RNAi 结构转染到寄主植物,产生靶标基因的dsRNA,并经植物细胞本身的Dicer 核酸酶加工形成19—25 nt 的siRNA。在病原菌侵染植物时,siRNA 通过囊泡从植物体运输到病原菌,干扰病原菌靶基因的表达,从而减弱其致病能力,间接增强寄主植物的抗病性[10]。NOWARA 等[11]发现在大麦中表达大麦白粉病菌(Blumeria graminis)葡聚糖转移酶效应子的RNA 干扰分子会提高其抗性水平,据此首次提出了HIGS 的概念。此后,该技术被广泛应用在各种作物与多种真菌互作研究中,如小麦叶锈病菌(Puccinia triticina)[12]、禾谷镰孢(Fusarium graminearum)[13]以及黄萎病菌[14]。最近,有研究人员利用HIGS 技术在烟草中表达核盘菌Sschs的RNAi 结构,发现转基因T1代烟草的菌核病抗性显著增强[15]。但是利用HIGS 技术是否能获得稳定持久可遗传的菌核病抗性还有待研究,且该技术在十字花科植物抗菌核病的研究还未见报道。研究表明,当病原菌入侵宿主时,寄主植物最早启动的免疫防御依赖于活性氧(ROS)迸发[16]。过量的ROS 不仅会对植物细胞,也会对病原菌造成细胞膜DNA 及蛋白质等的损害[17-18]。超氧化物歧化酶(SOD)是清除活性氧爆发的第一步,将歧化为H2O2和氧气,进而生物体将H2O2分解为无毒的水[19]。SOD 按其结合的金属离子,可分为Fe-SOD、Mn-SOD、CuZn-SOD 以及Ni-SOD 4 种[20-21],其中CuZn-SOD 主要存在于细胞质以及线粒体内外膜之间作为氧化物清除剂[22]。相关研究表明,核盘菌中编码CuZn-SOD 的基因突变后,核盘菌抗氧化能力减弱,致病力显著下降[19,23]。铜锌超氧化物歧化酶铜伴侣是目前鉴定的分子量最大的一类铜伴侣蛋白质,可通过N 端结构域传递铜离子至CuZn-SOD 的铜离子结合位点,从而激活CuZn-SOD的酶活性[24-25]。LI 等[26]研究发现在稻瘟病菌(Magnaporthe oryzae)侵染条件下,水稻铜锌超氧化物歧化酶铜伴侣CCSD缺失突变体导致CuZn-SOD酶活性显著降低,水稻抗病性减弱。因此,铜锌超氧化物歧化酶铜伴侣基因对于生物体CuZn-SOD 的酶活性激活及ROS 的清除能力至关重要。【本研究切入点】尽管现有菌核病抗病育种取得了一定进展,但严重依赖抗病材料及抗病基因的挖掘,进展缓慢,因而亟需发展新的抗病育种技术。本研究选择核盘菌铜锌超氧化物歧化酶铜伴侣基因SsCCS作为靶基因,构建该基因的HIGS 载体并转化拟南芥,通过菌核病抗性鉴定,验证HIGS 技术应用于寄主菌核病抗性改良的可能性。【拟解决的关键问题】利用HIGS技术在拟南芥中表达特异靶向核盘菌SsCCS的dsRNA,创建持久高抗菌核病的转基因株系,为今后将HIGS 技术应用到油菜等十字花科植物的菌核病抗性育种中打下基础,并为安全防治菌核病提供靶基因。
1 材料与方法
试验于2017 年10 月至2019 年3 月在西南大学农学与生物科技学院完成。
1.1 供试材料
本试验所用拟南芥哥伦比亚生态野生型Col-0,核盘菌菌株1980 均由重庆市油菜工程技术研究中心提供。基因沉默表达载体pCIT 由西南大学植物保护学院余洋老师惠赠,拟南芥红光表达载体pBin35SRed3 由华中农业大学张椿雨教授惠赠[27],用于基因克隆的T 载体p GEM®-T Easy Vector 购于Promega 公司(美国)。大肠杆菌菌株DH5α,农杆菌菌株GV3101 购于北京全式金生物技术有限公司(TransGen Biotech)。
核盘菌菌株1980 保存于马铃薯培养基(PDA)中。
1.2 生物信息学分析
从核盘菌基因组数据库(http://www.broadinstitute org/ annotation/genome/Scleraotinia sclerotiorum/Uenomeslndex html)提取SsCCS的编码序列及氨基酸序列,通过ProtParam(https://web.expasy.org/protparam/)预测SsCCS 蛋白的分子量及等电点(PI),将其氨基酸序列在NCBI 上进行同源比对(Blast),利用 MEGA6.0构建SsCCS的系统发育树。
1.3 HIGS 沉默表达载体的构建
利用BioEdit 软件将SsCCS与核盘菌以及拟南芥基因组序列进行比对,选择SsCCS的特异片段作为RNA 干扰片段,利用Primer Premier 5 设计特异引物,并引入相应的酶切位点(表1)。以核盘菌野生菌株1980 的cDNA 为模板,以SsCCS-SF/SsCCS-SR 及SsCCS-AF/SsCCS-AR 分别进行扩增,并将胶回收的目的片段连接到pGEMT-Easy 载体,转化至大肠杆菌DH5α,挑选阳性单克隆送Invitrogen 公司测序。提取测序正确T 克隆质粒T-SsCCS-S 及T-SsCCS-A,首先采用限制性内切酶EcoRI/EcoRV 双酶切T-SsCCS-S,将该正向片段连入pCIT,获得中间载体p-ccs-1。随后采用PstI/BamHI 双酶切T-SsCCS-A,将该片段反向连入p-ccs-1,获得SsCCS的干扰载体p-ccs。随后,用EcoRI 和XhoI 分别双酶切p-ccs 及植物转化载体pBin35SRed3 的质粒,将p-ccs 载体中的主体结构“正向序列-内含子-反向序列”连接到pBin35SRed3 的CaMV35S 启动子与Nos 终止子之间,获得沉默SsCCS的HIGS 载体R-ccs。将重组质粒R-ccs 转化至农杆菌GV3101,挑选阳性单克隆的菌液加入50%的甘油1﹕1 等体积混合于2 mL 离心管中,保存于-80℃。

表1 SsCCS 载体构建所用引物序列Table 1 Sequence information of primers used for vector construction of SsCCS
1.4 拟南芥的遗传转化及鉴定
将拟南芥哥伦比亚生态型(Col-0)直播于营养土中,在22℃,16 h 光照、22℃,8 h 黑暗培养箱中生长40 d 左右,去掉已经结荚的和开放的花朵后,采用农杆菌介导的浸花序法[28]将重组质粒转化拟南芥。收获侵染后的T0代拟南芥种子,选择发红色荧光种子进行播种,获得T1代转基因拟南芥。选取转基因拟南芥幼叶于研钵中,用液氮进行研磨,用CTAB 法提取DNA,利用引物RVF/RVR(表1)对T1代转基因株系进行PCR 鉴定,筛选阳性植株。
1.5 菌核病抗性鉴定
在PDA 平板上活化核盘菌野生型菌株1980,用直径2 mm 的打孔器取生长2 d 的边缘菌丝用于接种。将2 mm 的菌丝块接种于拟南芥叶片上,带菌面紧贴叶片。接种后,将接种叶片置于可控温控湿环境内,温度设置为22℃,相对湿度保持在85%左右。接种24 h 后统计病斑的长径和短径,利用公式S=π×a×b/4计算病斑面积(其中a 代表病斑长轴长度,b 代表病斑短轴长度)[29],并利用SAS 软件进行统计学分析。试验重复3 次,每次3—5 片叶片。
1.6 H2O2检测
联苯胺(3,3'-diaminobenz-idine-HCl,DAB)染色检测法参照GUAN 等的方法[30]。将接种6、12、24 h后的拟南芥叶片立即置于1 mg·mL-1的DAB 溶液(pH 3.8)中,染色6 h 后于沸腾的95%乙醇中脱色10 min,冷却后,于无水乙醇中室温保存并拍照。
1.7 qRT-PCR
取T3代纯合转基因拟南芥接种核盘菌后6 h 的叶片及病斑组织,采用TRIzol®法提取总RNA,采用Bio RAD 的i ScriptTMcDNA Synthesis Kit 试剂盒将RNA样品反转录成cDNA。采用Bio RAD 的 i TaqTMUniversal SYBR®Green Supermix 试剂盒,利用引物RT-SsccsF/RT-SsccsR(表1),在CFX96TMReal-Time PCR仪上进行荧光定量扩增,检测SsCCS的表达情况。反应程序:95℃预变性30 s,95℃变性5 s,60℃退火20 s,72℃延伸20 s,40 个循环,每个样本重复3 次,采用2-ΔΔCT法计算目的基因表达量[31]。
2 结果
2.1 SsCCS 的生物信息学分析
核盘菌中编码SsCCS的基因编号为SS1G_00102,该基因全长为1 010 bp,编码序列长759 bp,共编码253 个氨基酸,该蛋白分子质量为27 176.96 Da,等电点(PI)为5.04。利用MEGA6.0 软件构建系统发育树(图1),结果显示与SsCCS同源关系近的基因均为编码超氧化物歧化酶铜伴侣基因,其中与灰霉病菌(Botrytis cinerea)BcCCS(EDN25358)基因亲缘关系最近,氨基酸同源性达到87%,与拟南芥AtCCS(AT1G12520.1)亲缘关系较远。
2.2 HIGS 沉默表达载体的构建
克隆SsCCS的314 bp 特异片段,构建HIGS 沉默表达载体,载体构建示意图如图2-A 所示。以野生菌株1980 的cDNA 为模板,分别用特异引物SsCCS-SF/ SsCCS-SR、SsCCS-AF/SsCCS-AR 扩增SsCCS的特异干扰片段CCSs 及CCSa,片段大小为314 bp(图2-B)。将SsCCS的正向和反向特异干扰片段分别连入pCIT载体的内含子两端,采用引物PIF/PIR 对p-ccs 的重组菌液进行检测,结果显示共获得8 个片段大小约1 200 bp 的阳性克隆(图2-C),表明SsCCS干扰载体p-ccs构建成功。提取该质粒,将“CCSs -intron- CCSa”片段插入植物表达载体pBin35SRed3 的EcoRI 和XhoI 两个酶切位点之间,获得HIGS 载体R-ccs。随后,采用EcoRI/XhoI 进行双酶切检测R-ccs,酶切片段大小约为1 200 bp(图2-D),表明植物HIGS 沉默表达载体R-ccs 构建成功。将R-ccs 质粒转化农杆菌,采用引物组合RVF/SsCCS-SR 进行检测(图2-E),结果显示12 个重组菌液均在314 bp 左右有特异性条带,表明成功转化农杆菌,可用于植物的遗传转化。
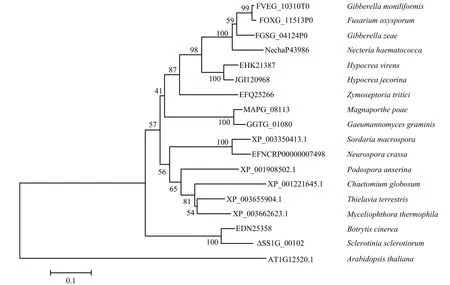
图1 SsCCS 系统进化树分析Fig. 1 The phylogenetic tree of SsCCS
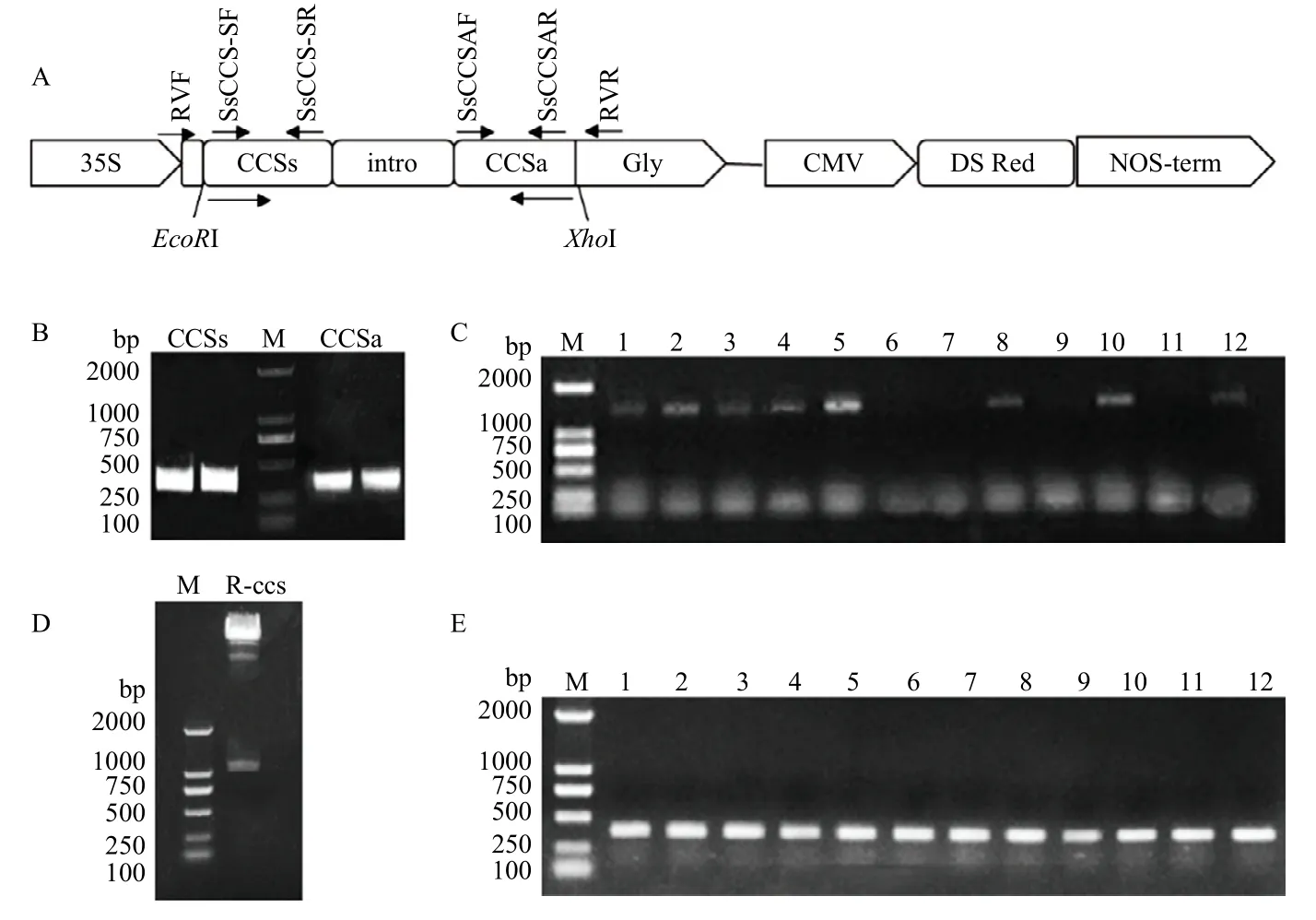
图2 SsCCS HIGS 载体的构建Fig. 2 Construction of HIGS vector of SsCCS
2.3 转基因拟南芥的筛选及抗病性鉴定
利用浸花序法转化拟南芥,收获T0代拟南芥的种子。筛选其中具有红色荧光的种子,共获得17 株T1代转基因植株。提取叶片DNA,利用引物RVF/RVR进行PCR 检测,结果发现17 株T1代转基因植株均在1 200 bp 左右有特异性条带(图3),表明17 株均为阳性苗。
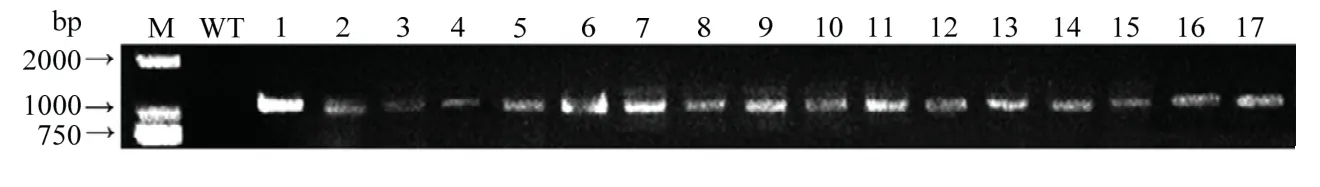
图3 T1代转基因拟南芥的PCR 鉴定Fig. 3 PCR identification of transformed A. thaliana lines of T1 generation
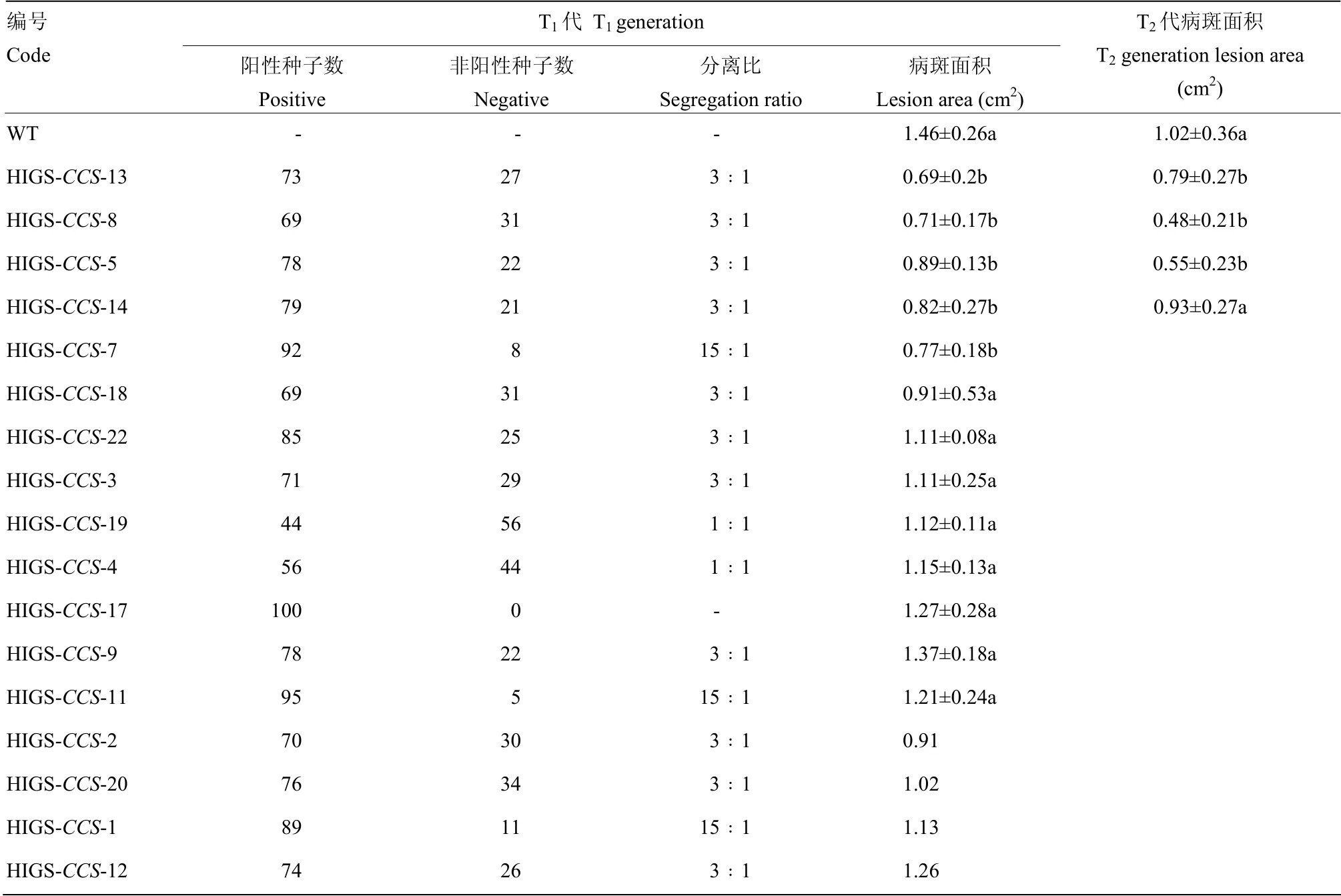
表2 转基因拟南芥分离比及接种核盘菌后病斑统计Table 2 Segregation and lesion analyses of transgenic and wild type A. thaliana lines after inoculated with S. sclerotiorum
接种核盘菌24 h 后,发现T1代转基因拟南芥单株的病斑面积均小于野生型,其中有4 个T1代转基因拟南芥株系的病斑平均面积分别为0.69、0.71、0.89、0.82 cm2,而野生型拟南芥的病斑面积为1.46 cm2(表2)。随后,收获T1代的转基因种子,并对所有种子进行筛选,从符合红色﹕暗色分离比例为3﹕1 的单株 自交种中,随机挑选并种植了4 个T2代株系。对T2代进行菌核病抗性评价发现,3 个T2代转基因拟南芥株系的菌核病抗性显著强于野生型,其病斑平均面积分别为0.79、0.48、0.55 cm2,野生型病斑面积为1.02 cm2(表2)。从T2代株系中,对抗性表现稳定全部发红光的株系继续培养至稳定纯合的T3代,菌核病抗性鉴定显示,接种24 h 后,3 个转基因T3株系上的病斑明显小于野生型,3 个株系的病斑平均面积为0.26、0.38、0.27 cm2,野生型病斑面积为0.69 cm2,转基因株系相对于野生型拟南芥病斑面积减小约46%—61%(图4)。该结果表明,在拟南芥中表达SsCCS的dsRNA 能显著增强拟南芥的菌核病抗性。
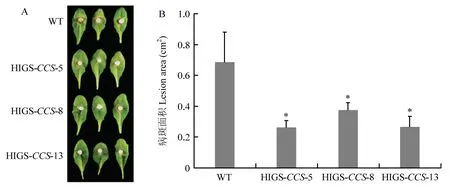
图4 T3代转基因拟南芥株系抗病性鉴定Fig. 4 Resistance identification of T3 generation transgenic A. thaliana lines

图5 拟南芥野生型及转基因株系的DAB 染色Fig. 5 DAB staining assay of wild type and transgenic A. thaliana lines
2.4 H2O2的积累情况
利用DAB 染色检测了HIGS-CCS转基因拟南芥在接种核盘菌过程中H2O2的积累情况,以此来反应在侵染过程中植株的ROS 发生水平。结果显示,在接种后6、12、24 h,转基因株系的染色区域明显小于野生型,在6 h 时已表现出明显差异(图5)。该结果表明, 核盘菌在侵染转基因拟南芥过程中的致病力显著小于侵染野生型,侧面反映HIGS-CCS转基因拟南芥的抗性增强。
2.5 SsCCS 表达量分析
提取转基因株系及野生型接种核盘菌6 h 后的叶片及病斑组织的RNA,通过qRT-PCR 分析核盘菌在侵染转基因拟南芥过程中相对于侵染野生型核盘菌SsCCS的表达情况,结果发现核盘菌在侵染转基因拟南芥过程中,SsCCS的表达量相对于侵染野生型拟南芥下降了98%(图6)。该结果表明,在核盘菌侵染过程中,HIGS-CCS转基因拟南芥成功干扰了核盘菌SsCCS的表达。
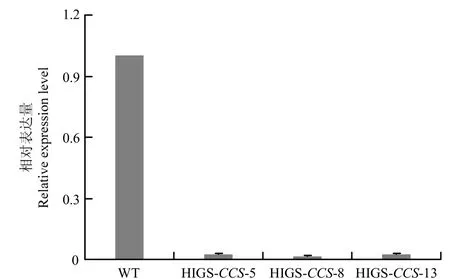
图6 核盘菌菌株1980 接种野生型及转基因拟南芥株系6 h后SsCCS 的相对表达量Fig. 6 Relative expression level of SsCCS at 6 h after the wild type and transgenic A. thaliana lines inoculated with S. sclerotiorum strain 1980
3 讨论
近年来,越来越多的研究证明HIGS 技术是一种控制病原菌的有效方法,已在多种作物中获得了HIGS转基因材料,增强了病原菌抗性,比如小麦-条锈菌[32]、棉花-黄萎病菌[33]、番茄-灰霉病菌[34]等。小RNAs 从植物细胞进入真菌细胞的转移途径尚不十分明确,目前大多数的HIGS 研究都集中在专性营养型寄生真菌中,真菌与寄主互作过程中伴随小RNA 的交换[35]。核盘菌长久以来被认为是一种典型腐生性真菌,通过杀死寄主植物细胞,从死亡组织中获得营养[36]。但最近的研究发现核盘菌与植物的互作非常复杂,在其侵染早期存在一段短暂的活体营养时期[37],这为利用HIGS 技术防治核盘菌带来了可能。ANDRADE 等尝试在烟草中沉默核盘菌Sschs,发现T1代转基因烟草的菌核病抗性显著增强[15],但是由于HIGS 受到宿主植物与病原菌的限制,不同病原菌的致病基因或寄主植物的选择可能对于沉默效果有较大的影响[38-39]。本研究中,将含有核盘菌SsCCS的RNAi 结构转入拟南芥中,获得了HIGS-CCS转基因拟南芥,抗性鉴定发现转基因的T1、T2及T3代的菌核病抗性相对野生型都显著增强,证明获得了持久稳定抗菌核病的拟南芥。
CuZn-SOD 在生物体的ROS 平衡调控中起着重要的作用,核盘菌中敲除CuZn-SOD 后,致病力显著下降[23],而CCS对于CuZn-SOD 功能的正常行使起到关键作用[40]。有研究显示在灰霉病菌中沉默BcCCS,灰霉菌的致病力减弱[41]。本研究通过构建系统发育树发现,SsCCS与灰霉病菌BcCCS亲缘关系最近,因此推测SsCCS在核盘菌与宿主植物互作过程中起到关键作用,干扰该基因的表达可能会增强寄主的抗病能力。而HIGS-CCS转基因拟南芥中的SsCCS表达受到显著抑制,核盘菌在侵染转基因拟南芥过程中的致病力显著下降,证实了SsCCS是核盘菌致病力的关键基因。
拟南芥是分子生物学研究的模式植物,与油菜、萝卜、卷心菜等农作物同属于十字花科,具有较近的亲缘关系[42]。在拟南芥中进行SsCCS的HIGS,成功获得了菌核病抗性显著增强的转基因植株,研究结果为HIGS 在油菜等十字花科植物的菌核病抗病育种中的应用提供了支撑,同时有助于利用HIGS 技术快速挖掘核盘菌致病相关基因,促进核盘菌致病机理的研究。
4 结论
利用HIGS 方法可有效干扰核盘菌SsCCS的表达,并能够显著提高转基因拟南芥的菌核病抗性,研究结果为安全防控菌核病提供了一个重要的靶标基因。

