薇甘菊叶片水提液对土壤钾素活化及酶活性的影响
欧巧菁, 杨 悦, 梁伟杰, 孙 锋, 彭长连
(广东省植物发育生物工程重点实验室∥华南师范大学生命科学学院, 广州 510631)
入侵植物可通过根系或者凋落物分泌新的化感物质于入侵地中,这些化感物质具有抑制本地植物生长的作用,或作为入侵植物-土壤微生物群落相互作用的媒介来掠夺土壤养分资源[1-2]. 近年来,对于葱芥(Alliariapetiolata)、火炬树(Rhustyphina)和银荆(Acaciadealbata)等入侵植物的研究也表明,入侵植物分泌的化感物质能活化土壤氮、磷养分,增加入侵力[3-5].

本课题组通过野外调查发现:本地植物火炭母(Polygonumchinense)为薇甘菊的伴生植物. 火炭母是多年生的廖科廖属的草本植物,具有根状茎,直立或匍匐生长;广泛分布于福建、广东和广西等地区[17]. 因此本研究以薇甘菊的伴生植物火炭母为对照植物,探究薇甘菊叶片水提液对薇甘菊与火炭母根际土壤的解钾菌、土壤速效钾、土壤酶活性和植物钾质量分数的影响,为揭示薇甘菊入侵的地下生物学机制提供实验基础.
1 材料与方法
1.1 植物幼苗培育
将薇甘菊与火炭母的种子于1% NaClO中消毒10 min,用超纯水清洗3次,将种子置于育苗盆中,28±2 ℃培育2个月. 取高15 cm且长势一致的薇甘菊和火炭母幼苗分别种植于无孔花盆中(直径12 cm,高13 cm),盆中放入600 g已过2 mm筛并混匀的鲜土,每盆分别种植一株薇甘菊或火炭母幼苗,所有植株均在温室中培养;种植时间为2018年4月24日.
1.2 薇甘菊叶片水提液制备和添加
将野外采集、自然风干的薇甘菊叶片粉碎,并过2 mm筛处理. 取过筛后的薇甘菊叶片粉末24 g,加入1 600 mL超纯水,搅拌均匀后于25 ℃下浸提 2 d;浸提结束后,将悬浊液过滤2次,过滤液即为薇甘菊叶片水提液(质量浓度为15.00 g/L);加入超纯水依次稀释得到0、3.75、7.50 g/L的薇甘菊叶片水提液,置于4 ℃下保存[7]. 每天早上8:00—9:00分别添加50 mL不同质量浓度的薇甘菊叶片水提液于薇甘菊与火炭母单种的盆中,每个质量浓度4个重复.
1.3 植物与根际土壤的收集及制备
培养1个月后,分别收集薇甘菊与火炭母的地上部分(叶与茎)和地下部分(根系). 同时,在收集薇甘菊与火炭母的根系时,分别用抖落法采集薇甘菊与火炭母的根际土壤[18]. 2种植物的根际土壤中一部分自然风干,风干后的土壤过2 mm筛,测定土壤pH和速效钾的质量分数;另一部分的根际土壤过 2 mm筛,置于4 ℃保存,测定含水量、土壤解钾菌及土壤酶活性.
1.4 植物与土壤的钾质量分数的测定
薇甘菊与火炭母植株的地上部分和地下部分于75 ℃烘干至恒质量,称量植物干质量. 烘干的薇甘菊与火炭母植物样品用H2SO4-H2O2法消煮,分别测定2种植物地上部分、地下部分及总生物量的钾质量分数[19]. 称取5.0 g已过2 mm筛的薇甘菊与火炭母风干根际土壤,采用乙酸铵浸提法测定土壤速效钾质量分数[19].
1.5 土壤pH与酶活性的测定
分别称取20 g薇甘菊与火炭母根际土壤(过2 mm筛的鲜土),105 ℃烘干至恒质量,称量土壤干质量,计算薇甘菊与火炭母根际土壤含水量. 称取15 g薇甘菊与火炭母风干的根际土壤(2 mm),按15∶1(m/V)加入超纯水,150 r/min摇动30 min,静置后测定上清液的pH,即为土壤pH. 采用酪蛋白酸钠分析方法测定蛋白酶活性;采用对-硝基酚磷酸钠分析方法测定酸性磷酸酶活性;采用3,5-二硝基水杨酸分析方法测定纤维素酶活性;采用三苯基四唑氯化物分析方法测定脱氢酶活性;采用对-硝基酚-β-D-葡糖苷分析方法测定β-葡糖苷酶活性[20].
1.6 根际土壤解钾菌数量的测定
分别称取薇甘菊与火炭母根际土壤(过2 mm筛的鲜土)5 g,置于装有45 mL灭菌水的150 mL锥形瓶中. 将上述锥形瓶于150 r/min摇动30 min;加入超纯水,将土壤悬浊液梯度稀释至10-3. 取10-3土壤稀释液100 μL涂布于解钾菌培养基,将平板于28±2 ℃黑暗倒置培养. 培养7 d后,平板上有透明圈的菌落即为解钾菌,记录解钾菌数量.
解钾菌培养基配制[15]:葡萄糖5 g,Ca3(PO4)22.0 g,MgSO4·7H2O 0.05 g,FeCl3·6H2O 0.1 g,CaCO32.0 g,钾长石粉3.0 g,琼脂18 g,pH 7.0~7.5.
1.7 数据统计分析
采用SPSS l8.0软件进行统计分析. 本研究包含2个自变量(植物物种与薇甘菊叶片水提液质量浓度),采用双因素方差分析(Two-Way ANOVA)比较植物物种(薇甘菊与火炭母)、薇甘菊叶片水提液及两者的相互作用对各测量变量的影响. 采用Origin 8.5软件对数据作图.
2 结果与讨论
2.1 薇甘菊叶片水提液对土壤pH的影响
薇甘菊叶片水提液显著影响土壤pH (P<0.01),随着薇甘菊叶片水提液质量浓度的增加,薇甘菊与火炭母根际土壤的pH显著地下降(P<0.01),并在薇甘菊水提液质量浓度为15.00 g/L时,pH下降到最低(表1). 土壤pH降低的原因可能是由于薇甘菊叶片水提液中存在较多的可溶性酚酸类物质. 同时,低的土壤pH有利于促进土壤速效钾和速效磷的释放[21].
2.2 薇甘菊叶片水提液对土壤解钾菌数量及速效钾质量分数的影响
薇甘菊叶片水提液对土壤解钾菌数量的影响不显著(P>0.05),但土壤解钾菌的物种差异明显(P<0.01),薇甘菊根际土壤解钾菌数量显著高于火炭母(图1A). 薇甘菊叶片水提液显著影响薇甘菊与火炭母根际土壤的速效钾质量分数(图1B,P<0.01). 随着薇甘菊叶片水提液质量浓度的增加,薇甘菊与火炭母速效钾质量分数均显著增加;并且在高质量浓度(15.00 g/L)的薇甘菊叶片水提液处理下,薇甘菊与火炭母根际土壤速效钾的质量分数分别是对照处理(0 g/L薇甘菊叶片水提液)的2.53、2.03倍. 本研究只检测了具有解钾能力的细菌,但参与土壤解钾过程的微生物还包含放线菌、真菌等[15]. HAN等[22]
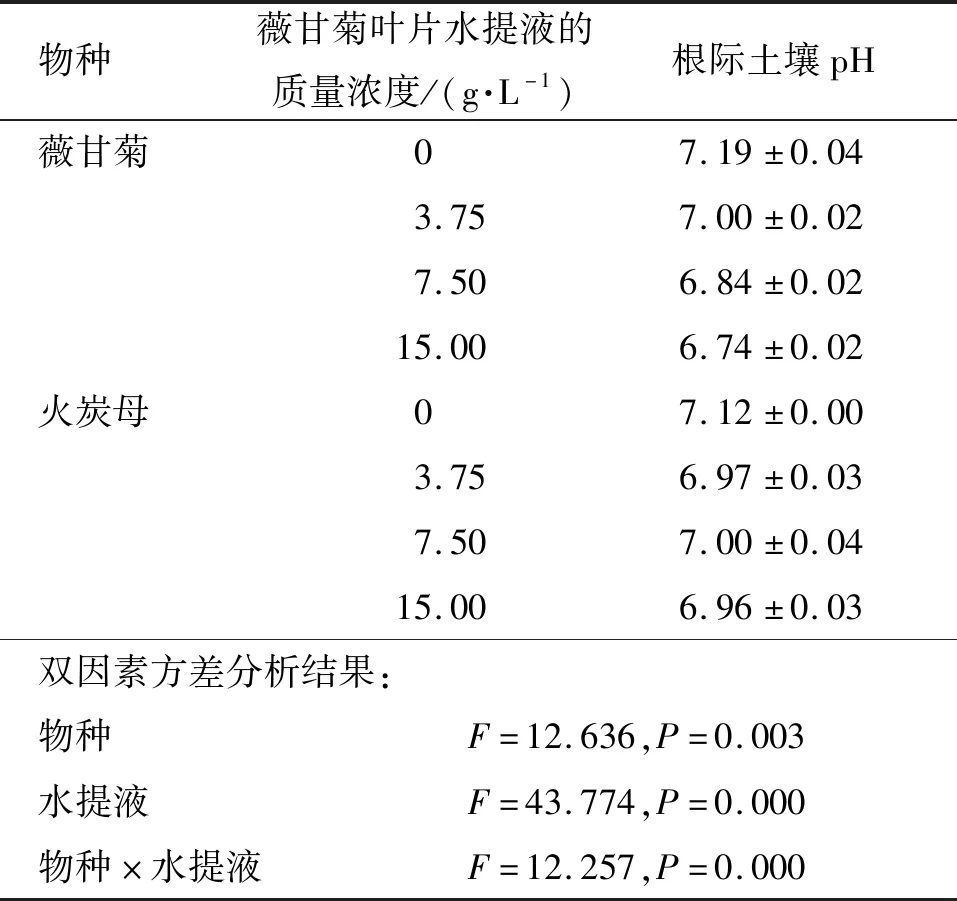
表1 薇甘菊叶片水提液对薇甘菊与火炭母根际土壤pH的影响Table 1 The effect of leaf leachates of M. micrantha on pH in rhizosphere soil of M. micrantha and P. chinense
注:表中数据为平均值±标准误,n=4.

图1 薇甘菊叶片水提液对薇甘菊与火炭母根际土壤中解钾菌数量和速效钾质量分数的影响
Figure 1 The effect of leaf leachates ofM.micranthaon the density of potassium-solubilizing bacteria and available potassium in rhizosphere soil ofM.micranthaandP.chinense
注:图中数据为平均值±标准误,n=4,图2到图4同.
研究发现:2株薇甘菊根际土壤的放线菌(Streptomycesrochei与Streptomycessundarbansensis)具有解钾的作用. 薇甘菊叶片水提液可能通过提高土壤真菌或放线菌的活性或丰度来促进土壤K+的释放.
2.3 薇甘菊叶片水提液对土壤酶活性的影响
在薇甘菊叶片水提液处理后,薇甘菊与火炭母根际土壤的脱氢酶活性均显著增加(图2,P<0.01),在15.00 g/L薇甘菊叶片水提液处理时,薇甘菊根际土壤的脱氢酶活性最高(1.42 μg/(g·h),图2A);而在3.75 g/L薇甘菊叶片水提液处理时,火炭母根际土壤的脱氢酶则活性最高(1.14 μg/(g·h)). 同时,高质量浓度的薇甘菊叶片水提液显著地提高了薇甘菊与火炭母根际土壤的β-葡糖苷酶活性(图2B,P<0.01),在15.00 g/L薇甘菊叶片水提液处理下,薇甘菊与火炭母根际土壤的β-葡糖苷酶活性分别是对照的1.60与1.36倍. 在未添加薇甘菊叶片水提液时(0 g/L),薇甘菊根际土壤的纤维素酶活性显著高于火炭母(图2C,P<0.05),但是薇甘菊叶片水提液对2种植物的根际土壤纤维素酶活性的影响均不显著(P>0.05),此外,植物物种与薇甘菊叶片水提液分别对2种植物的根际土壤酸性磷酸酶的活性存在交互作用(图2D,P<0.01). 薇甘菊叶片水提液对2种植物的根际土壤蛋白酶活性的影响不显著(图2E,P>0.05).
土壤酶活性的高低可以在一定程度上指示土壤微生物活性和生化反应的强度[16]. 研究结果表明:薇甘菊叶片水提液显著提高了土壤微生物活性,促使土壤碳循环的周转速率加快. 这可能是由于薇甘菊叶片水提液中含有可溶性的养分或化感物质刺激土壤碳循环相关微生物的繁殖或活性. 有的研究[4]也表明:入侵植物火炬树水提液通过增加土壤细菌与真菌丰度,提高土壤养分的矿化速率.
此外,薇甘菊叶片水提液可能对土壤氮循环的影响不显著.

图2 薇甘菊叶片水提液对薇甘菊与火炭母根际土壤酶活性的影响
Figure 2 The effect of leaf leachates ofM.micranthaon enzymes activity in rhizosphere soil ofM.micranthaandP.chinense
2.4 薇甘菊叶片水提液对薇甘菊与火炭母生物量的影响
薇甘菊叶片水提液显著降低了火炭母地上部分的生物量(图3A,P<0.05),与对照(0 g/L薇甘菊叶片水提液处理)相比,15.00 g/L薇甘菊叶片水提液处理下的火炭母地上部分的生物量下降了51.30%. 薇甘菊叶片水提液对火炭母的地下部分的生物量与总生物量的影响不显著(图3B、C,P>0.05). 这表明薇甘菊叶片水提液的化感物质对火炭母存在毒害作用. 已有研究[23]也发现:薇甘菊地上部分的化感物质阿魏酸与绿原酸能抑制水稻(Oryzasativa)与稗(Echinochloacrusgalli)幼苗的生长. 同时,入侵植物的化感物质能抑制本地植物根部抗氧化酶的活性,使本地植物抗胁迫的能力下降,本地植物易受病原体等因素的损伤,从而生长受限[24].
此外,植物物种的不同是导致薇甘菊与火炭母地下生物量存在显著差异的主要原因(图3B,P<0.05),在3.75、15.00 g/L薇甘菊叶片水提液处理时,薇甘菊地下部分生物量显著高于火炭母的地下部分生物量(P<0.05), 但薇甘菊叶片水提液对薇甘菊自身的生长没有显著的影响(图3). 有研究[25]表明:用含薇甘菊茎叶水提液的霍格兰营养液处理薇甘菊幼苗后,薇甘菊幼苗的生长受到抑制. 导致差异的原因可能与培养条件有关,该研究是液体培养,本实验是土壤培养. 入侵植物与土壤微生物或动物形成有别于本地植物的新的土壤-植物互作方式[26],这种新的土壤-植物互作关系可能是薇甘菊减弱化感物质自毒效应的重要手段.
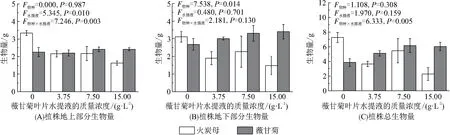
图3 薇甘菊叶片水提液对薇甘菊与火炭母生物量的影响Figure 3 The effect of leaf leachates of M. micrantha on biomass of M. micrantha and P. chinense
2.5 薇甘菊叶片水提液对薇甘菊及火炭母植株中钾的质量的影响
植物物种与薇甘菊叶片水提液分别对2种植物的地上部分钾质量与总钾质量的影响存在交互作用(图4A、C,P<0.01). 薇甘菊叶片水提液对薇甘菊植株钾质量积累的影响不显著(P>0.05),但火炭母地上部分的钾质量显著降低(P<0.05),在15.00 g/L薇甘菊叶片水提液处理时,火炭母地上部分的钾质量最低(0.02 g). 这可能由于薇甘菊叶片水提液中的化感物质抑制了火炭母的生长,火炭母根系转运土壤K+的效率下降,火炭母地上部分积累的钾质量减少. 此外,薇甘菊与火炭母地下部分钾质量、总钾质量对薇甘菊叶片水提液的响应不显著(P>0.05).
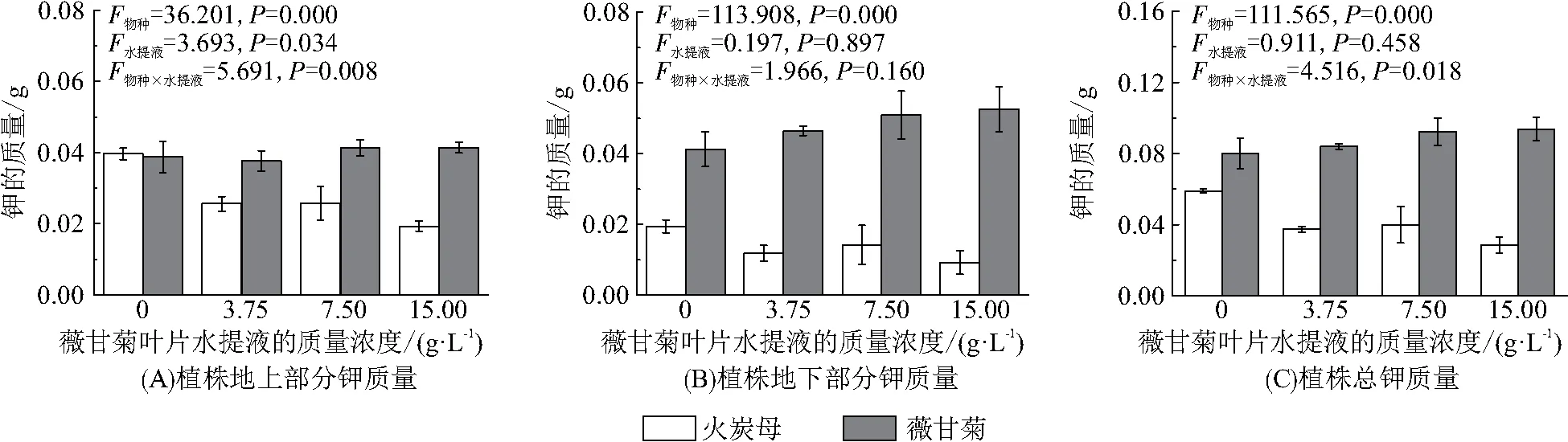
图4 薇甘菊叶片水提液对薇甘菊及火炭母植株中钾质量的影响Figure 4 The effect of leaf leachates of M. micrantha on potassium content in plant of M. micrantha and P. chinense
3 结论
薇甘菊为华南地区危害严重的入侵杂草之一,其生长速度极快[2]. 同时钾元素在植物生长中起着重要作用,如促进细胞伸长[27]. 薇甘菊的快速生长可能依赖于对土壤钾元素的大量积累. 本研究的结果表明:(1)薇甘菊叶片水提液对土壤钾素活化影响显著,薇甘菊叶片水提液一方面通过增加土壤的脱氢酶与β-葡糖苷酶活性,使微生物活性增强,加速含钾矿物的活化;另一方面通过降低土壤pH,增强酸解作用,促进K+的释放. (2)薇甘菊叶片水提液对植物生长具有较强的化感作用,薇甘菊叶片水提液的化感物质对薇甘菊自身存在促进生长作用,但薇甘菊叶片水提液对火炭母的生长有毒害作用. 这表明:薇甘菊叶片水提液富含化感物质,具有抑制本地植物生长的效果.
薇甘菊的化感物质在活化土壤钾养分与土壤酶活性中具有重要作用,提高自身的入侵力. 此外,薇甘菊对自身化感物质可能具有脱毒机制,从而形成利己的生长环境. 薇甘菊对自身化感物质的脱毒机制需要进一步的研究.

