E-cadherin和Her-2在Luminal B型乳腺癌中的表达和意义
张语嫣,李孟圈
(郑州大学第一附属医院 乳腺外科,河南 郑州 450052)
乳腺癌是女性常见的恶性肿瘤之一,乳腺癌浸润转移是晚期乳腺癌患者死亡的主要原因。根据免疫组化结果将乳腺癌大致分为Luminal A型、Luminal B型、人类表皮生长因子受体2(human epidermal growth factor-2,Her-2)阳性和三阴性,其中Luminal B型乳腺癌包括一大类预后不良指标的激素受体阳性的乳腺癌,在我国占全部乳腺癌的50%左右[1]。上皮钙黏素(E-cadherin)是一种钙依赖介导的跨膜糖蛋白,对维持上皮细胞的聚集、黏附及形态结构的稳定性有重要作用,在正常细胞中能够稳定表达,但在肿瘤细胞中表达多不稳定。E-cadherin表达的下调,会促进上皮间质化,进而降低上皮细胞间的紧密连接程度,与肿瘤细胞的浸润、转移密切相关。本研究探讨E-cadherin和Her-2在Luminal B型乳腺癌中的表达特点,分析其临床意义,以期为Luminal B型乳腺癌的个体化治疗提供参考。
1 资料与方法
1.1 病例资料选取2017年10月至2019年1月郑州大学第一附属医院收治的146例接受改良根治术的乳腺癌患者。经病理免疫组织化学检验证实为Luminal B型乳腺癌。病理组织学分级参照WHO分类标准,分期参照AJCC第八版《癌症分期手册》标准。146例患者均为女性,年龄29~70岁,中位年龄50岁。
1.2 实验方法采用免疫组化SP法检测E-cadherin。鼠抗人E-cadherin单克隆抗体、DAB显色试剂盒均购自福州迈新生物技术开发公司。SP试剂盒购自北京中杉金桥生物技术有限公司。将石蜡标本制备成4 μm的切片,采用免疫组织化学二步法(Envision法)进行检测,具体操作步骤按试剂盒说明书进行。
1.3 结果判读E-cadherin表达以半定量法判读:乳腺癌细胞中存在≥50%的连续膜染色,则认为E-cadherin表达为阳性;如果<50%,则认为E-cadherin表达为阴性或低表达。Her-2表达结果判读:免疫组化结果+++或Fish基因检测为阳性。Ki-67结果判读:在显微镜下,以细胞核内出现棕色颗粒定义为阳性计数1 000个细胞(10个高倍视野100个细胞),计算Ki-67阳性细胞占细胞总数的百分比。以Ki-67≤30%为低表达,Ki-67>30%为高表达。
1.4 统计学方法采用SPSS 21.0统计软件处理数据。计数资料(月经状态、组织学分级等)以频数和率(%)表示,组间比较采用χ2检验;用Spearman秩相关分析E-cadherin、Her-2与分子指标之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 Her-2与临床病理特征的关系146例Luminal B型乳腺癌患者中,Her-2阳性者50例(34.25%),Her-2阴性者96例(65.75%)。Her-2表达与原发肿瘤直径、组织学分类和淋巴结转移数目有关(均P<0.05)。Her-2表达与年龄、月经状态、组织学分级、切除淋巴结数目和TNM分期无关(均P>0.05)。见表1。
2.2 E-cadherin与临床病理特征的关系146例Luminal B型乳腺癌患者中,E-cadherin阳性者125例(85.62%),E-cadherin阴性者21例(14.38%)。E-cadherin表达与组织学分类和TNM分期有关(均P<0.05)。E-cadherin表达与年龄、月经状态、组织学分级、原发肿瘤直径、切除淋巴结数目和淋巴结转移数目无关(均P>0.05)。见表2。
2.3 相关分析在Luminal B乳腺癌组织中,E-cadherin表达与Ki-67、Her-2表达呈正相关(均P<0.05),与ER、PR表达无关(均P>0.05)。Her-2在Luminal B型乳腺癌组织中的表达与PR表达呈负相关(P<0.05),与Ki-67表达呈正相关(P<0.05),与ER表达无关(P>0.05)。见表3。
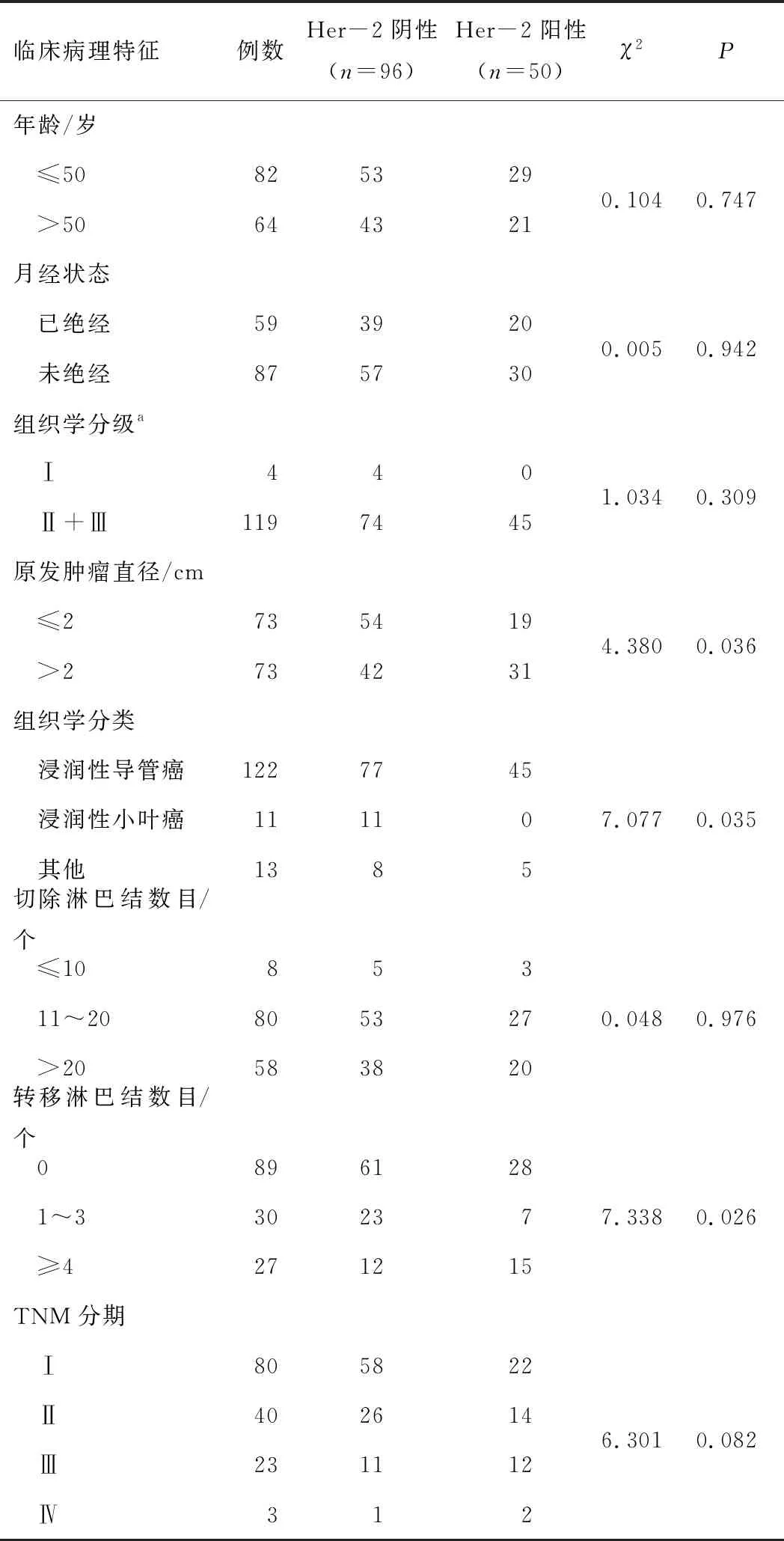
表1 146例Luminal B型乳腺癌患者Her-2与临床病理 特征的关系
注:a表示剔除23例无组织学分级者;Her-2—人类表皮生长因子受体2。
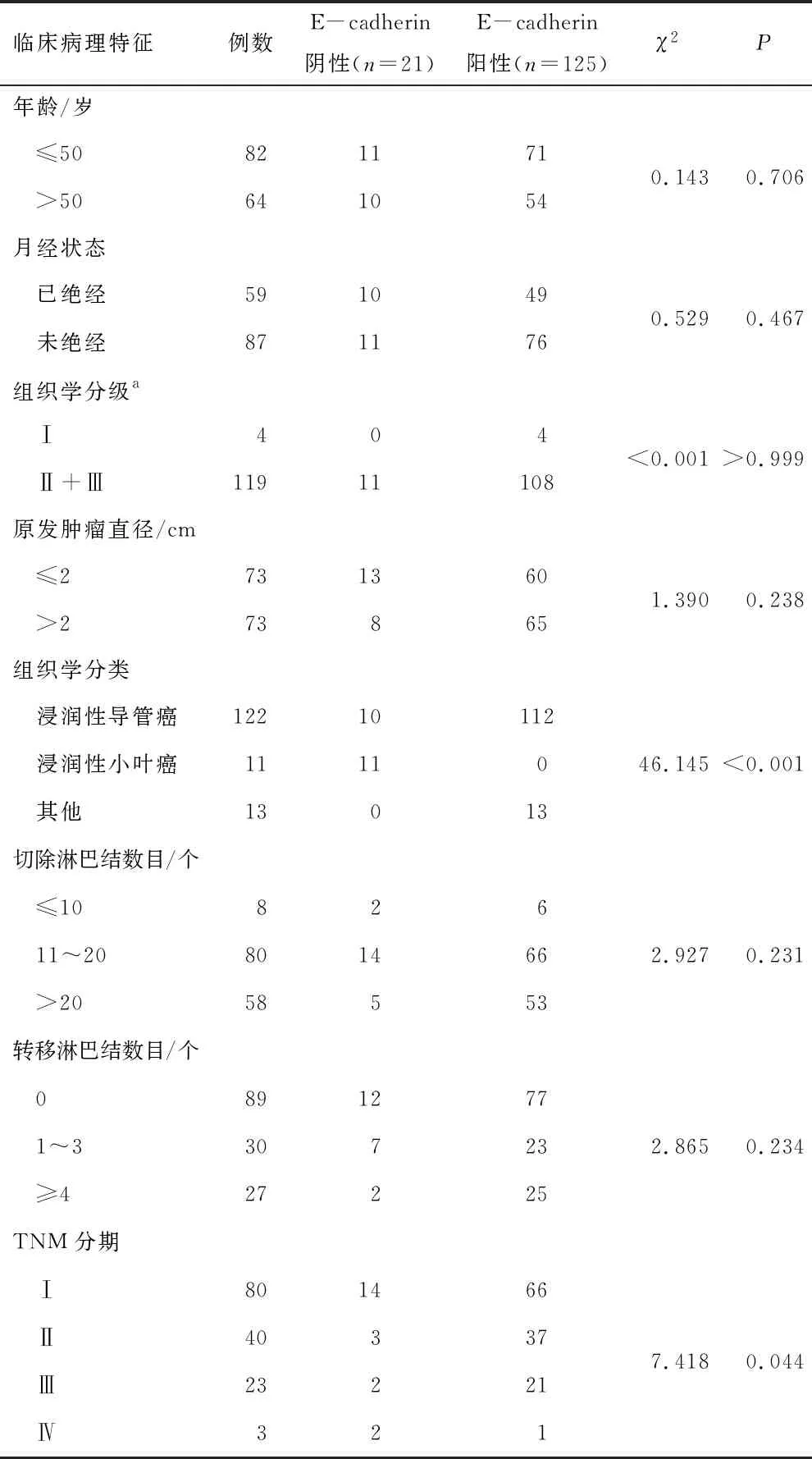
表2 146例Luminal B型乳腺癌E-cadherin表达与 临床病理特征的关系
注:a表示剔除23例无组织学分级者;E-cadherin—上皮钙黏素。

表3 Luminal B乳腺癌组织中E-cadherin和Her-2表达 与分子指标表达的相关性
注:ER—雌激素受体;PR—孕激素受体;E-cadherin—上皮钙黏素;Her-2—人类表皮生长因子受体2。
3 讨论
分子亚型与乳腺癌的转移方式和自然病程密切相关,针对不同分子亚型乳腺癌的特异性治疗有助于改善预后[2-3]。乳腺癌中占比最高的分子分型为Luminal B型。Luminal B型乳腺癌激素受体阳性率较高,总体预后较Luminal A型乳腺癌差。根据Her-2的表达情况将Luminal B型乳腺癌分为Her-2阴性型和Her-2阳性型。
E-cadherin作为钙黏附蛋白家族中的重要成员之一,促使正常乳腺上皮细胞的黏附、定位、紧密连接。上皮-间充质转化(epithelial to mesen-chymal transition,EMT)是上皮细胞丧失极性和黏附性并获得侵袭性和转移性的过程[4-5]。E-cadherin表达下调正是EMT发生的重要起始步骤。本研究发现,E-cadherin表达与组织学分类和TNM分期有关。在146例乳腺癌中,浸润性导管癌的E-cadherin阴性表达率为8.2%,浸润性小叶癌的E-cadherin阴性表达率为100.0%,与Singhai等[6]、董浙清等[7]研究发现相符。E-cadherin阴性表达往往表现为肿瘤细胞间的黏附能力减弱,侵袭能力增强,可考虑作为乳腺癌预后不良的指标之一。
Her-2是分子量为185 kDa的跨膜蛋白,其基因位于染色体17q12,是人类表皮生长因子受体家族成员之一,在调节细胞生长发育中起重要作用[8]。Her-2是调节乳腺生长发育的关键细胞因子,其过量表达常导致乳腺癌的发生,参与乳腺恶性肿瘤的生长、分化、侵袭、转移的过程。Her-2阳性Luminal B亚型乳腺癌较Her-2阴性亚型乳腺癌更容易出现复发和转移[9]。本研究结果显示,与Her-2阴性表达者相比,Her-2阳性表达者的原发肿瘤直径>2 cm的占比和淋巴结转移率较高。这提示在Luminal B型乳腺癌中,Her-2阳性者的恶性程度较高。
Her-2基因扩增或表达阳性与恶性肿瘤的高度侵袭性密切相关。E-cadherin的表达缺失可使上皮细胞间的黏附能力减弱,癌细胞转移的风险增加。本研究结果显示,E-cadherin表达与Her-2表达呈正相关。这提示两者之间存在复杂交互的作用机制,需进一步研究。Ki-67 抗原是细胞增殖最常用的免疫组织化学标记物,对评估乳腺癌预后有重要价值[10]。Ki-67的表达强度反映肿瘤细胞增殖的活跃程度。PR具有调节乳腺癌生长和分化的功能,PR缺失可能是癌细胞恶性增殖和激素治疗抵抗的因素之一[11]。本研究中,Her-2阳性表达与PR表达呈负相关,与Ki-67表达呈正相关。Her-2可能通过调控PR、Ki-67表达参与乳腺癌的侵袭转移过程。
综上所述,在Luminal B型乳腺癌中,E-cadherin低表达者和Her-2阳性表达者更容易出现肿瘤细胞的侵袭转移。

