黑土微生物群落对副球菌属(Paracoccus sp.)QD15-1修复邻苯二甲酸二甲酯污染土壤的响应*
朱晓慧 刘 虹 郭茹鑫 王恒煦 王志刚
(齐齐哈尔大学生命科学与农林学院,黑龙江 齐齐哈尔 161006)
邻苯二甲酸酯(PAEs)已成为全球主要的环境污染物之一[1-2],PAEs的生物降解成本低、降解速率快,且一般无二次污染[3-4]。目前,我国土壤中PAEs含量已达到mg/kg数量级,部分土壤中的PAEs达4.90 mg/kg[5-6],其中邻苯二甲酸二甲酯(DMP)是PAEs中检出率较高的污染物之一[7-8]。DMP污染会引起黑土微生物群落发生变化,从而对土壤生态环境系统造成损害[9],急需行之有效的修复技术。
黑土是我国最具价值的土壤类型之一[10]。据估计,1 g黑土中含有10亿个微生物[11],土壤微生物与植物生长和土壤肥力密切相关[12],微生物也是土壤乃至整个生态系统中的重要组成部分[13],其对环境的作用是通过多种代谢方式和生理功能来实现的。因此,微生物多样性被认为是评价土壤质量变化的重要指示因子[14],基于微生物群落的物种信息分析被广泛应用于土壤环境质量评价[15-18]。
生物修复因其高效、低成本等优点,备受关注。DMP作为副球菌属(Paracoccussp.)QD15-1的唯一碳源,副球菌属QD15-1能高效降解土壤中的DMP[19]。生物修复是修复PAEs污染土壤的有效技术。研究土壤微生物群落对微生物修复的响应具有一定的科学意义,但其在修复DMP污染土壤过程中微生物群落的响应过程尚不明确,深入研究微生物群落结构及多样性影响因素能为微生物修复提供有效的理论依据和理论基础。
1 材料与方法
1.1 主要供试材料与培养基
降解菌:齐齐哈尔大学微生物实验室提供的副球菌属QD15-1(-80 ℃保存)。
DMP、甲醇、丙酮、乙酸乙酯均为分析纯试剂。
黑土:采集自齐齐哈尔克山农场(125°7′E,48°11′N),未检测到DMP,由黏土、细粉砂、粗粉砂、砂粒组成,有机碳质量分数为5%~8%,有机质为75.1 g/kg,pH为5.8。
无机盐培养基:氯化铵2.0 g/L,硫酸镁0.5 g/L,氯化钠0.5 g/L,磷酸氢二钾2.0 g/L,磷酸二氢钾0.4 g/L,痕量元素储备液2 mL/L。其中痕量元素储备液:CaSO4·5H2O 4.0 g,FeSO4·7H2O 7.0 g,FeCl3·6H2O 7.0 g,CoCl2·6H2O 0.2 g,NaMnO4·2H2O 3.4 g,CaCl22.0 g,H2O 1 000 mL,pH 7.0
1.2 菌种的活化与收集
取1 mL降解菌于100 mL无机盐培养基中,恒温振荡培养48 h,4 000 r/min下离心3 min,用生理盐水洗涤2次,垂悬于10 mL的生理盐水中。8 000 r/min下离心5 min,收集降解菌菌体。
1.3 降解实验
取黑土每份500 g,添加不同浓度DMP溶液(溶剂载体为90%(体积分数)丙酮)混匀,依次得到0、100、200、400 mg/kg的DMP污染土壤。随后将DMP污染土壤放置于培养皿中,并添加1 mL降解菌菌液(600 nm处吸光度为1,菌落数为3×108cfu/mL),搅拌均匀,将培养皿放置于人工气候箱(25 ℃、空气湿度60%、土壤湿度30%)中培养21 d。每个处理设置3个重复,并以黑土为对照组,以未加降解菌的土壤自然降解为参考。
1.4 液相色谱法测定土壤中DMP浓度
选取培养0~21 d的DMP污染土壤,每个处理平行取样3次,每组10 g,以黑土作对照组,以未加降解菌的土壤中自然降解为参考。色谱流动相为10%(体积分数,下同)超纯水、90%甲醇,254 nm,使用Agilent 1290 Infinity Ⅱ液相色谱仪测定每个阶段土壤中DMP浓度。由DMP标准溶液质量浓度(Y,mg/kg)及峰值(X)得到的标准曲线如式(1)所示。
Y=0.201 8X-47.954,R2=0.997
(1)
1.5 高通量测序法测定土壤中微生物群落的变化
从培养7、21 d的0、200、400 mg/kg处理的DMP污染土壤中平行取样,每组10 g,分别标记为7 d-0、7 d-200、7 d-400、21 d-0、21 d-200、21 d-400。通过Illumina MiSeq高通量测序法测定土壤中微生物群落的分布与变化。
本研究委托上海美吉生物医药科技有限公司进行高通量测序,最终得到操作分类单元(OTU)聚类分析和物种分类学分析结果。根据分析结果,本研究对多样本的群落组成和系统发育信息深入进行多元分析和差异显著性检验等一系列统计学和可视化分析。
2 结果与分析
2.1 土壤中DMP浓度
由图1可知,加入降解菌后DMP降解明显,7 d内可有效将不同浓度的DMP降解,随时间延长,曲线趋于平缓;直至21 d时污染土壤中DMP趋向0 mg/kg。降解菌在土壤中可降解大部分DMP,平均降解率为94.7%。与未加入降解菌污染土壤自然降解条件下的DMP浓度产生鲜明对比,因此降解菌在土壤中有着良好的降解效果。
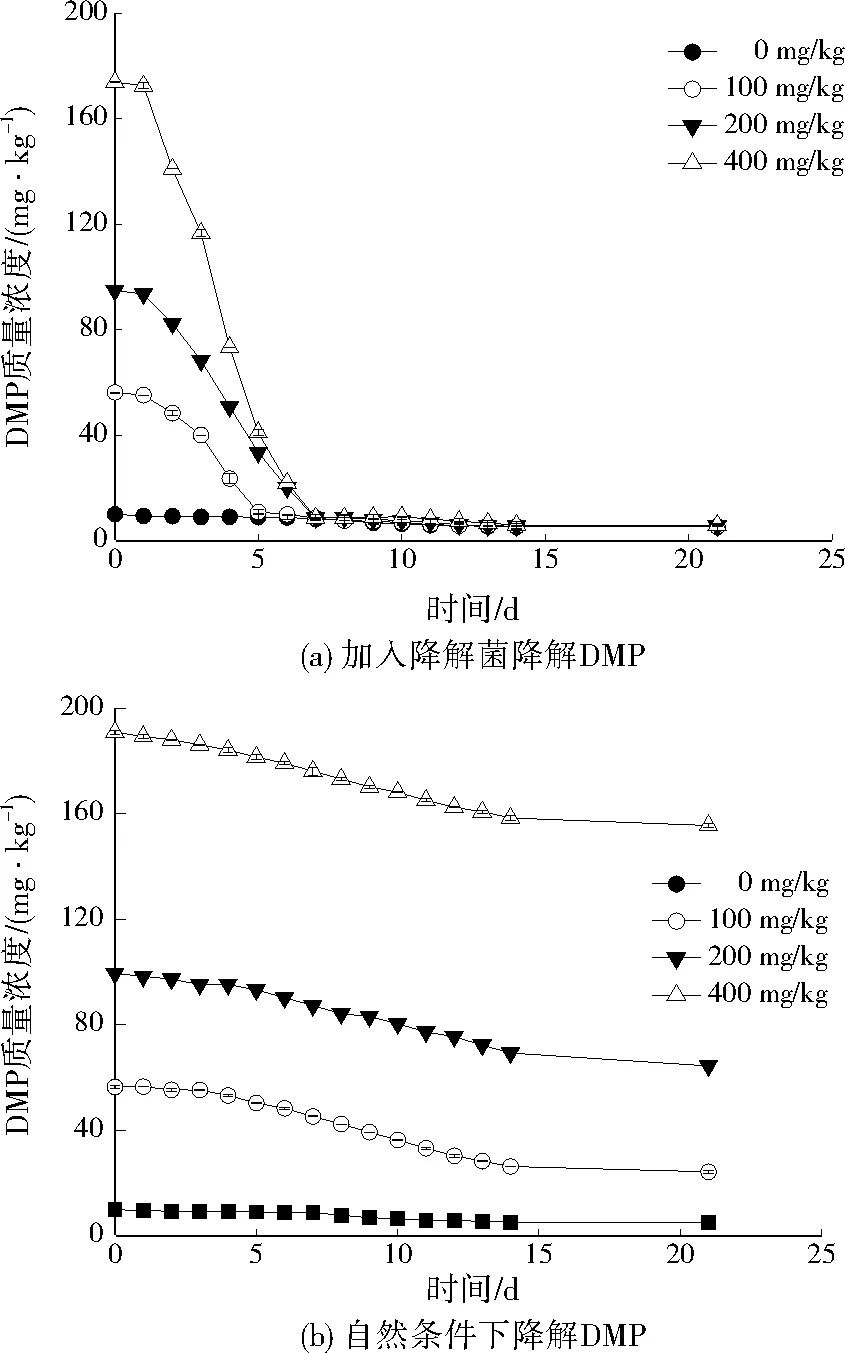
图1 不同条件下DMP污染土壤的降解Fig.1 Degradation rate of DMP in contaminated soil under different conditions
2.2 土壤中微生物丰富性和多样性的变化
OUT水平的Shannon、Sobs指数分别表征微生物多样性、丰富性。土壤中微生物的稀释曲线见图2。随DMP浓度的升高、时间的延长,Shannon指数降低;随测序数据量增加,Shannon指数稀释曲线趋于平缓。说明在时间延长及DMP浓度增大的情况下,土壤中绝大多数的微生物多样性改变。随测序数据量的增加,Sobs指数稀释曲线缓慢升高,并且覆盖度大,能覆盖样本中的绝大部分物种,物种数量多,在时间延长后可能会出现新的种群,增多群落丰富性。
2.3 DMP影响的土壤中微生物群落变化
由图3可知,土壤样本中含有22个菌门,其中放线菌门、变形菌门、酸杆菌门、绿弯菌门的相对丰度较高。DMP污染土壤加入降解菌培养7 d后的优势门为放线菌门;与7 d相比,DMP污染土壤加入降解菌培养21 d后放线菌门增加而变形菌门减少,优势门依然为放线菌门,占总菌门数的50%以上,也恰好证明培养7 d后土壤状态可达到稳定。
DMP导致细菌群落结构属水平的改变,主要为鞘氨醇单胞菌属(Sphingomonas)、类诺卡氏菌属(Nocardioides)、微球菌属(Micrococcaceae)、地杆菌属(Terrabacter)、小单孢菌属(Micromonospora)、链霉菌属(Streptomyces)等。由图4可见,总体上,土壤中鞘氨醇单胞菌属是第一优势菌属,第二优势菌属为类诺卡氏菌属。培养7 d,随DMP浓度的增加,鞘氨醇单胞、类诺卡氏、小单孢菌属相对丰度下降,微球、链霉菌属相对丰度先升高后降低,地杆菌属相对丰度升高。随时间的延长,培养21 d,所有菌属相对丰度变化趋势与7 d均一致,但类诺卡氏、微球、地杆菌属相对丰度升高,鞘氨醇单胞、小单孢、链霉菌属相对丰度下降。证明DMP污染后,影响土壤中细菌群落组成,降解菌在7 d修复后,土壤内环境菌属大致达到平衡。
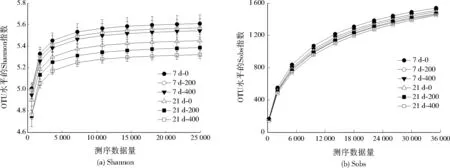
图2 土壤中微生物的稀释曲线Fig.2 Dilution curve of microorganism in soil

图3 土壤细菌群落热图和样本聚类分析Fig.3 Analysis of heatmap and sample clustering of soil bacterial community
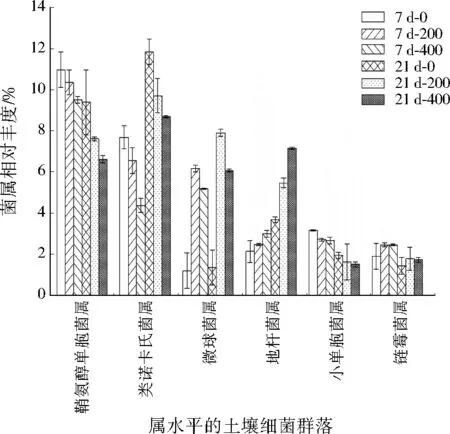
图4 土壤细菌群落属水平物种组成Fig.4 Soil bacterial community genus level species composition column diagram
通过主成分(PCA)分析发现,对照组与添加了DMP的处理组细菌群落组成有明显差异,可能是由于受到高浓度DMP的影响。主成分1和主成分2对结果的解释度分别为39.02%和33.51%,说明DMP虽然影响了土壤中细菌群落组成,但降解菌降解基本完全,土壤得以修复,并保持稳定。21 d后200、400 mg/kg DMP污染土壤中细菌群落组成差异不大,群落组成依旧保持稳定,这与物种相对丰度(见图4)相互呼应。
3 讨 论
金雷等[20]在长期受垃圾污染的土壤中筛选出一株降解率可达到82.7%的邻苯二甲酸二丁酯(DBP)降解菌,该菌株在含有100 mg/L的DBP培养基中生长5 d就可降解大部分DBP。张永乐等[21]分离了一株用于溴苯腈降解的副球菌属MXX-04,能以溴苯腈为唯一氮源进行生长,降解率为95.3%。本实验结果表明,在含有不同浓度DMP污染土壤中,降解菌7 d可降解大部分DMP,平均降解率较高,达到94.7%,并且直至21 d并未有太大改变。WANG等[22]通过高通量测序发现,DBP污染改变了土壤中属的相对丰度,并改变了细菌和真菌群落的结构;真菌群落的Shannon指数在DBP为5 mg/kg时上升,40 mg/kg时降低。本研究中随DMP浓度的升高、时间的延长,Shannon指数降低;随测序数据量增加,Shannon稀释曲线趋于平缓。说明DMP浓度的改变导致土壤中群落结构发生改变。
祁燕云等[23]利用高通量测序技术对微生物修复石油污染土壤过程中的微生物群落结构变化进行研究,结果表明,利用生物强化修复处理的土壤中,变形菌门为主要的优势菌门,相对丰度由修复前的37.44%增加为87.44%;假单胞菌属(Pseudomonas)成为土壤中的优势菌属,丰度由2.99%增加为76.37%。本实验土壤中微生物优势菌门为放线菌门、变形菌门,DMP污染土壤加入降解菌培养7 d后的优势门为放线菌门;与7 d相比,DMP污染土壤加入降解菌培养21 d后放线菌门增加而变形菌门减少,优势门依然为放线菌门,占总菌门数的50%以上;土壤中鞘氨醇单胞菌属是第一优势菌属,第二优势菌属为类诺卡氏菌属。文献[23]和本研究共同存在变形菌门,但放线菌门、属不一致。并且,本研究未发现副球菌属,可能是由于DMP作为唯一碳源,DMP被降解后,菌属无生存能力而死亡。
王志刚等[24]发现,黑土微生物丰富性和多样性受到DMP污染的抑制,且10、20、40 mg/kg处理的抑制效应在25 d内并未消除。本实验中黑土微生物丰富性和多样性同样受到DMP污染的抑制,但也恰好证明降解菌株可高效地在7 d内降解大部分DMP,直到21 d并未发生反复(见图1)。从细菌门、属的水平看,DMP影响了土壤微生物群落结构。
4 结 语
(1) 副球菌属QD15-1在7 d内可快速有效降解土壤中的DMP,平均降解率为94.7%,并能保持稳定;土壤中的优势门为放线菌门,占总菌门数的50%以上;鞘氨醇单胞菌属是第一优势菌属,第二优势菌属为类诺卡氏菌属。
(2) 土壤样品的高通量测序反映了土壤在不同DMP条件下微生物的物种多样性和丰富性的改变。还需进一步深入探究7 d内降解的土壤微生物群落变化。在达到既不损害土壤内部环境的条件下,降解污染物与保护环境兼顾一体,为微生物工业降解推广应用提供有利条件。

