光质对红茶萎凋叶蛋白酶和淀粉酶活性及相关成分的影响
罗红玉,王 奕,杨 娟,袁林颖,翟秀明,唐 敏,王 杰,黄尚俊,钟应富*
(1. 重庆市农业科学院茶叶研究所,重庆 永川 402160;2. 重庆市茶叶工程技术研究中心,重庆 永川 402160;3. 国家茶叶产业技术体系重庆综合试验站,重庆 永川 402160)
【研究意义】萎凋是红茶加工的第一道也是最关键的工序,即是将采回的茶鲜叶进行薄摊,让其散失一部分水分的工艺处理过程[1],同时也是茶鲜叶采后自然衰老的过程。在萎凋过程中,伴随着系列生理化学变化。萎凋叶品质的好坏直接决定了红茶品质的优劣。【前人研究进展】有研究表明,光质萎凋可促进氨基酸总量的增加、减少总糖含量[2-3],显著提升茶叶香气、鲜爽度及综合感官品质[4]。一直以来,普遍认为茶鲜叶在萎凋过程中游离氨基酸和可溶性糖含量的上升来源于蛋白质、淀粉的水解[5-7]。研究者在白茶萎凋过程中,发现大部分参与氨基酸和蛋白质合成的蛋白发生显著下调,而大部分参与蛋白质水解的蛋白发生显著上调,表明蛋白质水解是游离氨基酸含量升高的主要原因[8]。目前,茶叶中蛋白、蛋白酶及淀粉、淀粉酶的研究只见少量报道,研究表明人工光照萎凋可提前使萎凋叶中的蛋白酶活性达高峰,且高于室内自然萎凋[9],晒青和做青利于蛋白酶、淀粉酶的活化,做青可降低淀粉含量,利于氨基酸、可溶性蛋白及可溶性糖的积累[10-11]。在茶叶中,蛋白质含量丰富,约占干重的20 %~30 %,主要包括谷蛋白(82.05 %)、醇溶蛋白(13.61 %)、白蛋白(3.47 %)和球蛋白(0.87 %),其中只有1 %~2 %能溶于水,绝大部分不能溶于水而残留在茶渣中[1, 12]。本项目组前期实验采用透射电镜观察了红茶萎凋过程中叶片的超微结构,结果发现,鲜叶中的大粒淀粉变成了小粒淀粉甚至消失[13],还发现,黄光萎凋可提高萎凋叶中氨基酸、可溶性糖含量,蓝光萎凋可降低萎凋叶中茶多酚含量,两种光质能显著提高红茶感官品质,所制红茶外形乌黑较润、较紧细直,汤色红、明亮,甜香显,滋味醇厚,叶底红亮[14]。【本研究切入点】对萎凋过程中,不同光质如何通过影响萎凋叶蛋白酶和淀粉酶的活性,从而调节蛋白质、淀粉、氨基酸、可溶性糖含量仍然未知。【拟解决的关键问题】实验以室内自然萎凋为对照,通过研究黄光、蓝光萎凋过程中蛋白酶、淀粉酶及相关成分的变化规律,并探讨其相关性,以期为红茶设施萎凋中光质的筛选提供科学依据。
1 材料与方法
1.1 实验材料
供试原料为2017年9月采摘的福鼎大白(Camelliasinensiscv. ‘Fuding-dabaicha’)一芽二叶鲜叶,采自重庆市农业科学院茶叶研究所实验茶园 (北纬29°75′,东经105°71′,海拔440 m)。
1.2 实验仪器
光质萎凋槽:本实验室自制;6CR-40揉捻机:四川省名山县山峰茶机厂;6CH-54茶叶烘焙箱:福建安溪兴民茶叶机械厂;HB43-S水分测定仪:梅特勒-托利多国际股份有限公司;TU 1901紫外-可见分光光度计:北京普析通用仪器有限责任公司。
1.3 实验处理
在28 ℃条件下,采用2种不同的LED光源(黄光585 nm、蓝光460 nm,光强均为1500 lx)进行萎凋,对照为室内自然萎凋,萎凋时间20 h,萎凋结束时黄光组、蓝光组、对照组萎凋叶含水量分别为59.5 %、56.3 %、59.8 %。被照射叶量3.5 kg,摊叶厚度3~5 cm。
萎凋过程中,各萎凋组每4 h取样10 g测定水分,重复3次;同时取30 g样置于液氮速冻后保存于-20 ℃,再选择芽下第2叶用于测定蛋白酶及淀粉酶活性,以及总蛋白和淀粉含量;另取150 g萎凋叶先蒸汽杀青2 min后再80 ℃烘至足干,用于测定萎凋叶游离氨基酸及可溶性糖含量。
1.4 检测方法
酸性蛋白酶(Acid protease,ACP)、淀粉酶(Amylsse)活性,蛋白质及淀粉含量均采用试剂盒测定,购置于苏州科铭生物技术有限公司;游离氨基酸测定采用GB/T 8314-2013;可溶性糖测定采用硫酸-蒽酮比色法[15]。
1.5 数据分析
数据采用Excel 2013进行整理绘图、SPASS 17.0进行方差分析。测定结果以“平均数±标准差”表示,处理间平均值差异显著性用最小显著差异法(LSD)比较。
2 结果与分析
2.1 不同光质萎凋叶蛋白酶及淀粉酶的活性变化
萎凋过程中,各萎凋组的蛋白酶活性均呈升-降-升趋势(图1)。0~4 h为迅速升高阶段,萎凋至4 h,黄光组蛋白酶活性达最高,为1050.21 nmol·min-1·g-1,比茶鲜叶升高了7.4倍,与萎凋结束时相当,显著高于其余萎凋时段和萎凋组(P<0.5),其次为对照组,而蓝光组升高不显著(P>0.05);4~12 h为降低阶段,萎凋至8 h,黄光组、对照组迅速降低,蓝光组略有降低,萎凋至12 h,黄光组、对照组持续降低,蛋白酶活性与茶鲜叶无显著差异,蓝光组略有升高,此时,各萎凋组蛋白酶活性之间无显著差异;12~20 h为再次升高阶段,黄光组、对照组几乎呈线性升高,蓝光组在16 h处略有降低,随后显著升高,萎凋结束时,各组间无显著差异,其中黄光组最高,为505.75 nmol·min-1·g-1。

图1 不同光质萎凋过程中萎凋叶蛋白酶活性的变化Fig.1 The change of protease activity in tea leaves during different light withering
萎凋过程中,各萎凋组的总淀粉酶、β-淀粉酶活性变化总体呈升-降-升趋势(图2~3)。0~4 h为酶活性迅速升高阶段,萎凋第4小时处,对照组的2种酶活性最高,分别为101.00、84.61 mg·min-1·g-1,比茶鲜叶升高了2.1、3.9倍,显著高于其余萎凋时段和萎凋组,其次为黄光组,2种酶活性较高,分别升高了1.6、3.1倍,而蓝光组较低,分别升高了1.1、2.0倍,后两组的总淀粉酶活性无显著差异;在4~16 h过程中,2种酶活性有升有降,对照组在第16 h处最低,分别为47.23、40.82 mg·min-1·g-1,黄光组在第16 h处最低,分别为40.41、32.16 mg·min-1·g-1,蓝光组在第12 h处最低,分别为46.51、34.51 mg·min-1·g-1;萎凋结束时,对照组的总淀粉酶活性显著升高,蓝光组显著降低,而黄光组升高不显著,其酶活性最低,三者间差异显著,各萎凋组的β-淀粉酶活性升高不显著,蓝光组最高、黄光组最低,处理间差异显著。

图2 不同光质萎凋过程中萎凋叶总淀粉酶活性的变化Fig.2 The change of total amylase activity in tea leaves during different light withering
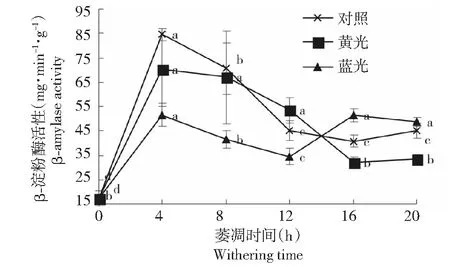
图3 不同光质萎凋过程中萎凋叶β-淀粉酶活性的变化Fig.3 The change of β-amylase activity in tea leaves during different light withering
萎凋过程中,各萎凋组的α-淀粉酶活性变化趋势不尽一致(图4)。对照组在0~8 h期间均无显著变化,8~16 h期间迅速下降,16 h处最低,为6.41 mg·min-1·g-1,显著低于其余萎凋时段和萎凋组,萎凋结束时又显著升高至13.76 mg·min-1·g-1;黄光组在0~8 h期间无显著变化,随后持续降低,萎凋结束时最低,为7.43 mg·min-1·g-1,显著低于0~8 h;蓝光组在0~4 h期间迅速升高,4 h处最高,为17.53 mg·min-1·g-1,升高了11.5 %,随后逐渐降低,萎凋结束时低至10.06 mg·min-1·g-1。
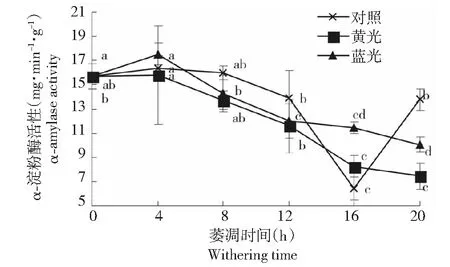
图4 不同光质萎凋过程中萎凋叶α-淀粉酶活性的变化Fig.4 The change of α-amylase activity in tea leaves during different light withering
2.2 不同光质萎凋叶蛋白酶、淀粉酶相关成分的变化
从表1可知,随萎凋进程,黄光组蛋白质含量先降后升,蓝光组呈降-升-降趋势,对照组呈缓慢降低趋势;各组萎凋叶的游离氨基酸含量均呈升-降-升趋势。

表1 不同光质萎凋过程中萎凋叶氨基酸及蛋白质含量的变化
就蛋白质含量而言,0~4 h为迅速降低阶段。第4小时处,降幅由大到小为黄光>蓝光>对照,降幅分别为53.7 %、47.5 %、15.9 %,各萎凋组间差异显著。4~16 h为黄光组持续降低阶段,萎凋第12、16小时处,显著低于其余时段,分别降低了63.9 %、63.7 %;萎凋结束时迅速升高,并与茶鲜叶相当。4~8 h为蓝光组持续降低阶段,第8小时处最低,降低了48.5 %;12 h处有较大幅度提升,随后缓慢降低。4~20 h对照组呈缓慢降低趋势,萎凋结束时最低,降低了22.4 %。
就游离氨基酸含量而言,0~4 h为迅速升高阶段。第4小时处,升高幅度由大到小为蓝光>对照>黄光,分别升高了42.0 %、38.1 %、27.6 %,前两者均升至最高,三者间无显著差异。4~12 h为黄光组持续升高阶段,12 h处最高,升高了53.3 %,显著高于其余萎凋组,16 h处降低,萎凋结束时升高33.7 %,显著高于其余萎凋组。4~12 h为蓝光组持续降低阶段,12 h处显著降低,与茶鲜叶相当,16 h处升高,萎凋结束时无显著变化。对照组在4~8 h期间维持较高水平,但与后续萎凋时段无显著差异。
从表2可知,各萎凋组总淀粉含量变化趋势存在差异,黄光组呈升-降-升趋势,蓝光组逐渐降低,对照组先降后升;对照组可溶性糖含量呈升-降-升趋势,黄光组和蓝光组呈先升后降趋势。

表2 不同光质萎凋过程中可溶性糖及总淀粉含量的变化
就总淀粉含量而言,黄光组在第4小时显著升高,显著高于其余萎凋时段和萎凋组,升高了8.3 %,在8~16 h过程中快速降低,显著低于其余萎凋时段,萎凋结束时,显著升高。蓝光组在萎凋结束时降至最低,降幅26.0 %。对照组在第12小时处降至最低,显著低于其余萎凋时段,降幅29.6 %,16~20 h又升高。
就可溶性糖含量而言,黄光组在第4小时达最高,为6.14 %,但与茶鲜叶无显著差异,8~16 h显著降低。蓝光组、对照组在第12、8小时处达最高,分别升高了15.7 %、12.6 %,显著高于茶鲜叶。萎凋结束时,蓝光组、对照组与鲜叶无显著差异,而黄光组则较鲜叶减少了11.7 %。
2.3 蛋白酶、淀粉酶活性及成分间的相关性
上述实验表明,黄光萎凋能在4 h内快速提高蛋白酶活性,并在随后的萎凋进程中,保持较高水平,能快速降低蛋白质含量,持续提高游离氨基酸含量,还可延缓总淀粉酶、β-淀粉酶活性的降低,迅速提升总淀粉含量。为进一步揭示黄光萎凋对相关物质的影响规律,实验进一步分析了黄光萎凋过程中,蛋白酶、淀粉酶活性及成分间的相关性。从表3可知,蛋白酶活性与蛋白质含量呈负相关,与游离氨基酸含量呈正相关,但未达显著水平;蛋白质含量与游离氨基酸含量呈较大负相关,相关系数为-0.586,说明蛋白质的减少对游离氨基酸的积累有较大贡献。总淀粉酶、α-淀粉酶、β-淀粉酶活性均与总淀粉、可溶性糖含量呈正相关,其中,α-淀粉酶活性与可溶性糖含量存在极显著正相关,系数为0.932;3种淀粉酶活性之间存在正相关,其中,总淀粉酶活性与β-淀粉酶活性存在极显著正相关,系数为0.989;总淀粉含量与可溶性糖含量存在较大正相关。蛋白酶活性与淀粉酶活性、淀粉、可溶性糖含量间均存在一定正相关,蛋白质含量与淀粉酶活性存在负相关,尤其与总淀粉酶和β-淀粉酶活性存在较大负相关,而与总淀粉以及可溶性糖含量存在正相关,游离氨基酸含量与总淀粉酶和β-淀粉酶活性存在较大正相关,与α-淀粉酶活性、总淀粉和可溶性糖含量存在一定负相关。
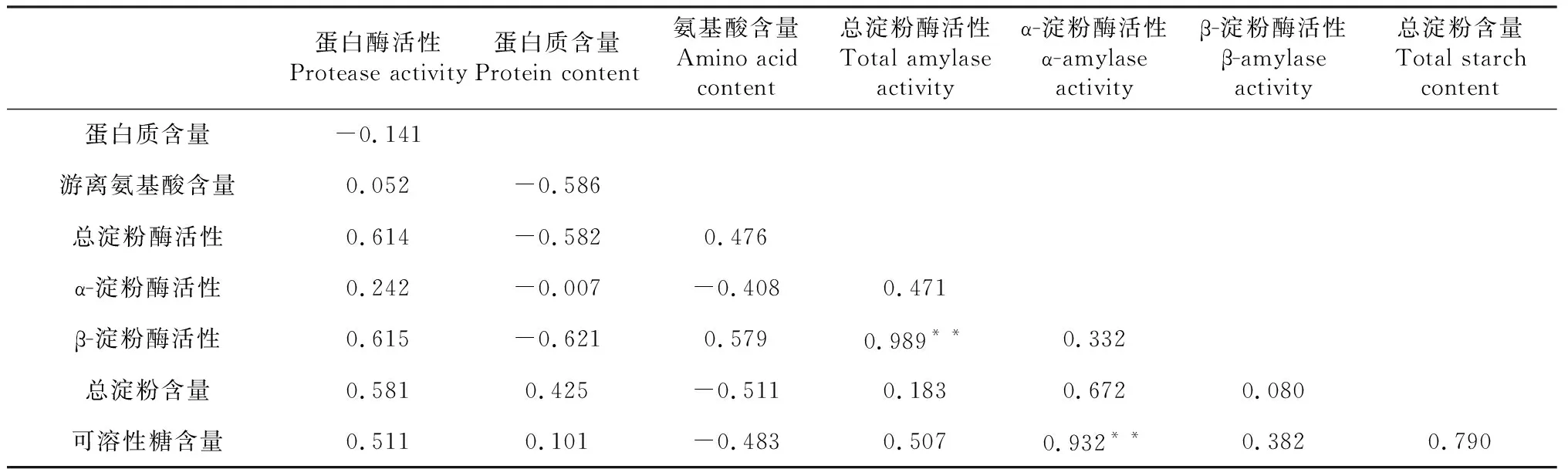
表3 萎凋叶蛋白酶、淀粉酶活性与成分间的相关性
3 结论与讨论
蛋白酶可将茶叶中的蛋白质水解成各种氨基酸,不仅能改善茶叶的香气和鲜爽度,而且可减少不溶性复合物产生,提高茶汤质量[16]。淀粉酶是一种重要的水解酶,是水解淀粉和糖原的一类酶的总称,淀粉酶作用于α-1,4-糖苷键,使淀粉水解成葡萄糖、麦芽糖、极限糊精等[17-18]。
实验发现,在萎凋过程中,各萎凋组的蛋白酶、总淀粉酶和β-淀粉酶活性,以及游离氨基酸含量均呈升-降-升趋势,黄光组蛋白酶活性高于蓝光组与对照组,可溶性糖含量变化规律存在差异;萎凋至4 h,黄光组的蛋白酶活性、对照组的总淀粉酶活性和β-淀粉酶活性、蓝光组的α-淀粉酶活性均最高,分别比茶鲜叶升高7.4倍、2.1倍、3.9倍、11.5 %;萎凋至12 h,黄光组的蛋白质含量最低,降低63.9 %,游离氨基酸含量最高,升高53.3 %,对照组总淀粉含量最低,降幅29.6 %,蓝光组的可溶性糖含量最高,升高15.7 %。相关性分析表明,黄光组的蛋白酶活性与蛋白质含量呈负相关,与游离氨基酸呈正相关,但未达显著水平,而蛋白质含量与游离氨基酸含量呈较大负相关,系数为-0.586;α-淀粉酶活性与可溶性糖含量、总淀粉酶活性与β-淀粉酶活性均存极显著正相关,系数分别为0.932、0.989。结果表明,在所选的光质萎凋条件下,黄光萎凋能显著提高萎凋叶蛋白酶活性和游离氨基酸含量,降低蛋白质含量;蓝光萎凋和室内自然萎凋则可提高萎凋叶淀粉酶活性和可溶性糖含量,降低总淀粉含量。
实验仅仅检测了蛋白酶促水解过程中酸性蛋白酶的活性及游离氨基酸含量,而蛋白质除了参与酶促水解外,还存在其他降解途径,比如胞内蛋白质降解[17],其他蛋白水解酶如肽链内切酶、外切酶等与蛋白质的关系可能更加密切,同时,蛋白质在水解过程中,会产生多肽,最后再生成游离氨基酸。另外,植物叶片中淀粉的水解途径涉及葡聚糖-水双激酶、异淀粉酶、磷酸葡聚糖磷酸酶、淀粉酶等多种酶类[19-20],而本实验仅仅检测了淀粉酶类。因此,实验结果表现出蛋白酶活性与蛋白质含量、游离氨基酸含量之间,总淀粉酶与淀粉、可溶性糖之间均无显著相关。后续实验将深入分析萎凋叶中蛋白和淀粉水解的酶类、活性及其在水解过程中的贡献程度,以明确关键的蛋白水解酶和淀粉水解酶,为茶叶萎凋工艺的改善提供更为确切的理论依据。

