茶叶主要特征性化合物抗心血管炎症研究进展
姚敏,李大祥,谢忠稳
茶叶主要特征性化合物抗心血管炎症研究进展
姚敏,李大祥,谢忠稳*
安徽农业大学茶树生物学与资源利用国家重点实验室,安徽 合肥 230036
慢性炎症是诱发动脉粥样硬化、高血压、心肌梗死等心血管疾病的重要原因之一。炎症因子如IL-6、TNF-α、IL-1β等均能导致心肌肥大、心肌纤维化和血管平滑肌细胞异常增殖。茶叶中富含的多种特征性化合物如茶多酚、茶氨酸、茶黄素、咖啡碱等,它们通过抑制重要炎症介质的产生和调控NF-κB、MAPK、Tolls样受体等信号通路,抑制心血管炎症的发生及发展,对心血管疾病具有预防和治疗作用。本文综述了近几年茶叶中的茶多酚、茶氨酸、茶黄素等特征成分通过抑制心血管炎症预防心血管疾病的作用及其机制的研究进展。
心血管炎症;茶多酚;信号通路;特征性化合物
茶是世界上最受欢迎的饮品之一。茶叶中富含多种生物活性成分,具有多种保健功能。随着近年来对茶叶健康功能的深入研究,发现茶叶中的特征性化合物如茶多酚、茶氨酸、茶黄素、咖啡碱等均有健康功效[1]。茶多酚是茶叶的天然组分,包含黄烷醇类、黄酮及黄酮醇类、花色素类和酚酸等四大类30余种化合物。茶多酚分子具有α-苯基苯并二氢吡喃为主体的基本结构,其活泼的羟基能提供氢,是一类天然的抗氧化剂[2]。儿茶素类尤其是表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)具有较强的抗氧化、抗炎作用,并且具有广泛的药理功效[3-4]。
随着社会经济的发展,心血管疾病已成为人类患病率最高的疾病之一,且具有高患病率、高致残率和高死亡率的特点,是一类严重威胁人类健康的常见慢性疾病。心血管疾病涉及心脏或血管的疾病,包括冠状动脉疾病(心绞痛和心肌梗塞)、中风、心力衰竭、心律失常、心肌炎、主动脉瘤、动脉粥样硬化和高血压等[5]。全世界每年因心血管疾病死亡的人数居各种死因首位[5-7]。基于1 680 126名35~75岁中国居民的心血管疾病风险评估调查数据显示,心血管疾病高危人群占总人群的9.5%,而糖尿病、血脂异常、肥胖等因素将加重心血管疾病[8]。基础研究数据表明炎症和免疫反应在心血管疾病的发生和发展中发挥着关键的作用。基于动物模型的研究发现,特定的免疫炎症转导途径可能是治疗心血管疾病的优先选择目标[9]。
动脉粥样硬化是一种最常发生的动脉病变。目前的一些研究认为,动脉粥样斑块从发生、发展到转移的全过程就是一个慢性炎症过程。炎症因子如白细胞介素-6(Interleukin 6,IL-6)、肿瘤坏死因子-α(Tumor necrosis Factor,TNF-α)、白细胞介素-1β(Interleukin 1β,IL-1β)等均能导致心肌肥大、心肌纤维化、心肌细胞凋亡和血管损伤等病症[10]。同时,大量研究揭示了多种炎性因子、生长因子等在粥样斑块形成中的作用[11]。另外,血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)作为构成血管壁组织结构的主要细胞,在血管病变早期,VSMCs发生由收缩表型转向增殖表型。炎症因子和生长因子的不正常表达与VSMCs表型转化密切相关,多种信号通路如NF-κB(Nuclear factor kappa-light-chain-enhancer of activated B cells)、AMPKs(Mitogen-activated protein kinases)、Notch、Tolls受体(Toll-like receptor)信号通路等及炎症介质如IL-6、TNF-α、IL-8等参与其中[12-13]。VSMCs的异常增殖和迁移是血管损伤后动脉粥样硬化和再狭窄的重要致病机制[14]。因此,通过抗炎途径来降低心血管疾病发病率可能成为一种积极的治疗措施。基于此,本文主要综述了近几年茶叶中的几种特征性化合物茶多酚、茶氨酸、茶黄素预防与治疗心血管炎症的研究进展,为进一步研究它们抗炎的分子机制提供基础。
1 饮茶降低人群的心血管炎症
大量研究证明,饮茶对于预防人和动物的心血管疾病具有重要的作用[15-16]。其中,茶叶中的重要活性成分茶多酚在抗动脉粥样硬化、高血压等心血管疾病中发挥重要的作用[17-18]。Pang等[19]利用Meta分析,对259 267人进行的9项研究证明了绿茶能够降低脑出血、脑梗死、心肌梗死等心血管疾病的风险。冠心病是冠状动脉血管发生动脉粥样硬化病变而引起血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死而导致的心脏病。王泽穆[20]通过Meta分析发现饮用绿茶能够显著降低冠心病的发病风险,同时证明EGCG可以抑制炎症因子TNF-α诱导的内皮功能紊乱,这可能是绿茶抗动脉粥样硬化作用的一个机制。李雅等[21]在探讨冠心病合并糖尿病患者血清中sCD146(Soluble cluster of differentiation 146)、PAPP-A(Pregnancy-associated plasma protein A)水平与斑块易损性的相关性及茶多酚对其影响的试验中,发现sCD146、PAPP-A水平在患者血清中明显高于健康对照者,斑块不稳定组明显高于斑块稳定组,斑块稳定组与正常对照组无统计学差异;口服茶多酚患者血清中sCD146、PAPP-A水平显著下降。证明了茶多酚具有稳定和改善冠脉斑块的作用。在高血压的预防和治疗方面,流行病学研究表明,在治疗高血压的药物中加入膳食黄酮类化合物对血压、血脂、瘦素、肥胖和炎症有额外的益处[22]。Nogueira等[23]调查了20名年龄在(41.1±8.4)岁肥胖的高血压前期女性短期饮茶后血压的变化,发现与安慰剂相比,绿茶提取物(Green tea extract,GTE)补充4周后能够显著降低血压。Bogdanski等[24]的试验证明,与安慰剂组相比,GTE显著降低高血压患者的收缩压和舒张压,GTE组空腹血糖、胰岛素水平和胰岛素抵抗显著降低,且GTE组血清中炎症因子TNF-α和高敏C反应蛋白(High-sensitive C-reactive protein,hs-CRP)显著降低,每天补充379 mg GTE(包括208 mg EGCG),对肥胖相关高血压患者的血压、胰岛素抵抗、炎症和氧化应激等有显著改善。
2 茶叶主要特征性化合物抗心血管炎症的机制
2.1 调控重要的分子抑制心血管炎症
2.1.1 抑制心血管炎症因子
茶叶主要特征性化合物抗炎的主要机制之一是调控炎症因子的表达,从而达到抑制炎症发生、减轻炎症程度或缩短炎症持续时间的作用。大量试验证明,茶叶特征性化合物具有广泛抑制炎症因子的功能。尤其是茶多酚类物质,其在炎症引起的心血管疾病的预防和治疗中有重要作用[25-31]。
绿茶多酚能够降低TNF-α的表达抑制炎症反应,从而避免慢性炎症引起的大鼠心肌纤维化[25]。IL-1β作为炎性因子在炎症等病理状态下发挥重要作用,刺激机体产生氧自由基,损害细胞。深入研究发现,EGCG能够显著抑制脂多糖(Lipopolysaccharides,LPS)诱导的人大脑微血管内皮细胞(Human cerebral microvascular endothelial cells,hCMEC)中IL-1β和TNF-α的表达[26]。表儿茶素预处理雄性SD大鼠,能够下调大鼠脑出血后IL-1β、TNF-α、IL-6,上调IL-4、IL-10、转化生长因子-β(Transforming growth factor-β,TGF-β)等炎症因子的表达,进而减轻脑出血后炎症反应,改善脑出血后期脑白质损伤情况[27]。心脏移植、心肌炎、心肌缺血和动脉粥样硬化的大鼠模型口服儿茶素后,IL-4、IL-6、基质金属蛋白酶(Matrix metalloproteinase,MMPs)等炎症因子可被显著抑制[28]。另外,在心衰大鼠体内的炎症反应中,儿茶素能够显著抑制TNF-α、IL-1、IL-17等炎症因子的过度分泌[29]。Mahajan等[30]用正常胆固醇血症高血压受试者的血清培养THP-1巨噬细胞,发现炎症因子IL-6和MMP-9的mRNA表达显著增加(<0.05),绿茶多酚干预显著降低了IL-6和MMP-9的表达,且呈时间依赖性(<0.05),这可能是茶多酚抑制高血压炎症的一种方式。
茶氨酸是茶叶中独特的生物活性成分,被广泛用作功能性成分和膳食补充剂,具有抗炎、抗氧化和肝保护作用。在LPS诱导的小鼠炎症模型中加入茶氨酸干预发现,茶氨酸显著抑制LPS诱导的血浆中干扰素γ(Interferon-γ,IFN-γ)的升高,并显著增加IL-10的表达,提高了IL-10/IFN-γ比率。此外,茶氨酸降低血浆CRP水平。因此,茶氨酸能够抑制炎症因子的表达,从而具有保护血管的作用[31]。
茶叶主要特征性化合物如茶多酚、茶氨酸能够调控许多炎症因子的表达,在控制炎症发生、发展中具有重要的作用,对临床预防和治疗慢性炎症引起的心血管疾病提供了重要的理论支持。
2.1.2 抑制心血管重要促炎分子降低炎症反应
茶叶主要特征性化合物抗炎作用的发挥除了与调控炎症因子有关,还和调控炎症相关的重要分子有关。茶多酚能够增加AKT、内皮一氧化氮合成酶(Endothelial nitric oxide synthase,eNOS)的磷酸化和一氧化氮的产生来抑制内皮细胞的胞外分泌,从而减少白细胞的聚集和血管炎症[32]。Hwang等[33]研究发现,L-茶氨酸显著降低卵清蛋白(Ovalbumin,OVA)诱导的哮喘小鼠肺血管炎性细胞浸润。细胞外基质金属蛋白酶诱导因子(Extracellular matrix metalloproteinase inducer,EMMPRIN)和MMPs在许多炎症性疾病中过表达,并在动脉粥样硬化斑块破裂中起重要作用。EGCG(10~50 μmol·L-1)能够显著抑制佛波酯诱导的巨噬细胞中EMMPRIN和MMP-9的表达以及炎症因子细胞外信号调节激酶1/2(Extracellular regulated protein kinase,ERK1/2)、p38和c-jun氨基-(N)-末端激酶1/2/3(c-Jun amino (N)-terminal kinases 1/2/3,JNK1/2/3)的激活[34]。另外,赵兴梅等[35]研究发现,儿茶素显著抑制oxLDL诱导的小鼠RAW264.7细胞中血管细胞粘附因子-1(Vascular cell adhesion molecule-1,VCAM-1)的表达,从而减轻VCAM-1介导的血管炎性病变,预防动脉粥样硬化等心血管疾病的发生。
2.2 抑制炎症相关信号通路
2.2.1 抑制NF-κB信号通路
NF-κB是真核细胞中重要的转录调节因子之一,在促炎基因表达调节中发挥重要的作用,介导多种炎症细胞因子如TNF-α、IL-1β、IL-6、IL-8的合成。NF-κB的P65与调节蛋白NF-κB抑制剂(Inhibitor of NF-κB,I-κB)结合,以无活性形式存在于细胞质中,机体可通过膜上受体蛋白感知外界刺激(如LPS)激活IκB激酶(IκB kinase,IKK),进而激活I-κB。I-κB被激活后降解,p65-p50异二聚体随即被释放出来,进入细胞核与DNA上的特定位点结合,启动炎症基因的表达[36]。已有研究证明,NF-κB可以影响许多慢性炎症引起的心血管疾病,包括动脉粥样硬化、心肌缺血/再灌注损伤、血管损伤、心肌梗死和心力衰竭等[37]。
研究表明,茶叶中的多种活性物质对NF-κB信号通路的调控有积极的作用[38-39]。Li等[40]研究发现,GTE降低了高脂饮食小鼠血清中炎症因子TNF-α的浓度,但不影响低脂饮食小鼠血清中TNF-α的浓度。另外,GTE的摄入能够通过调控NF-κB炎症通路降低Nrf2缺失小鼠血脂水平,从而降低动脉粥样硬化等血管疾病的发病几率[41]。
大量研究表明,茶叶中茶多酚的抗炎功效十分显著。茶多酚的主要成分EGCG在体内和体外试验中均被报道具有抗炎活性,能够抑制NF-κB的表达[42-43],并且EGCG能够抑制细胞TNF-α的产生[44],阻断NF-κB的激活进而抑制细胞粘附因子的表达,减少白细胞粘附及迁移到血管内皮[28],从而抑制炎症反应。研究表明,EGCG预处理显著抑制高浓度葡萄糖诱导的人主动脉内皮细胞(Human aortic endothelial cells,HAECs)中单核细胞产生和HAECs的粘附,并且降低HAECs中NF-κB调节的转录活性。且EGCG治疗能够减少db/db小鼠主动脉血管中NF-κB p65的核转位,可能对糖尿病诱发的血管炎症具有直接保护作用[45]。另外,多酚类物质槲皮素预处理VSMCs细胞,能够有效抑制ox-LDL诱导的单核细胞趋化蛋白-1(Monocyte chemotactic protein-1,MCP-1)和TNF-α的分泌及NF-κB(p65)核转位,NF-κB(p65)抑制剂预处理VSMCs也起到了与槲皮素类似的抗炎作用[46]。
茶黄素(Theaflavins,TFs)是茶多酚类物质的氧化物,是一类具有苯骈卓酚酮结构的酚性色素,具有抗氧化、抗菌、抗肿瘤等作用[47]。近几年研究发现茶黄素在抗炎方面也有显著效果。李伟[48]研究发现,EGCG、TF1、TF3抑制血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)引起的大鼠VSMCs炎症反应,可能是通过抑制ROS的产生和NF-κB信号途径,而不是p38/MAPK途径。李红月等[49]利用试验性大鼠脑缺血模型研究茶黄素对大鼠缺血性脑损伤所致炎症的作用,发现茶黄素能够降低血清中TNF-α、IL-1β及细胞间黏附分子-1(Intercellular adhesion molecule 1,ICAM-1)含量,抑制NF-κB mRNA的表达,从而缓解缺血损伤造成的血管炎症。TF3以剂量依赖性方式显著降低TNF-α、IL-1β和IL-6的mRNA表达,分子机制的研究表明,TF3阻止了IκB从细胞质部分磷酸化,并减少LPS诱导的NF-κB p65的核积累[50]。此外,Fu等[51]研究发现茶黄素通过抑制NF-κB相关途径减轻脑出血引起的大鼠炎症反应和脑损伤,该研究为脑出血的治疗提供了新的思路。
2.2.2 抑制MAPKs信号通路
MAPKs是信号从细胞表面传导到细胞核内部的重要传递者,是参与炎症信号转导机制中调节相关基因表达与细胞因子表达等的重要组成部分[52]。MAPKs信号级联反应在心血管疾病的发病机制中起重要作用。经典的MAPKs包括ERK1/2、JNK1/2/3和p38亚型(α、β、γ和δ)。
绿茶及茶多酚对炎症的调控可通过多靶点实现[53]。在培养的大鼠主动脉VSMCs中,AngⅡ诱导的增殖与ERK1/2、JNK1/2或p38MAPKs的磷酸化增加有关。绿茶儿茶素通过抑制MAPKs和激活蛋白-1信号通路的激活而降低AngⅡ刺激引起的VSMCs增殖[54]。Zheng等[55]发现,EGCG抑制AngⅡ诱导的VSMCs肥大,主要通过抑制JNK的激活和c-jun的转录,对AngⅡ激活的p38MAPK和ERK1/2的磷酸化没有显著抑制效果;而与EGCG结构类似的EGC却不能抑制AngⅡ诱导的VSMCs肥大。Yang等[56]报道EGCG可通过介导PKC、ERK1/2信号通路抑制高糖诱导的VSMCs增殖。此外,在动物试验中发现,绿茶多酚(Green tea polyphenols,GTP)的干预能降低动脉粥样硬化兔主动脉粥样硬化斑块中磷酸化p38MAPK的表达,从而减缓动脉粥样硬化斑块发展,起到保护血管的作用[57]。王齐明[58]的研究表明,EGCG能够增强高脂饮食诱导的ApoE-/-小鼠动脉粥样硬化斑块稳定性,其机制是通过EGCG与67 kDa层粘连蛋白受体(67 kDa laminin receptor,67LR)相互作用,抑制ERK1/2、p38以及JNK信号转导通路的激活,进而降低巨噬细胞EMMPRIN和MMP-9表达。在心脏保护方面,EGCG能够减少缺血再灌注(I/R)损伤造成的心肌梗死面积,EGCG通过激活再灌注损伤营救激酶(Reperfusion injury salvage kinase,RISK)途径和降低p38和JNK磷酸化对局部心肌I/R损伤起到保护作用,表明EGCG可能对接受心肌I/R损伤手术的患者具有心脏保护作用[59]。
TF3具有多种生物活性,包括降低冠心病发病率、预防癌症等能力。Wu等[60]的研究发现,TF3能够抑制由LPS诱导的RAW 264.7巨噬细胞JNK和p38 MAPKs的磷酸化,这也证明了TF3可能是治疗心血管疾病炎症的一个潜在的候选药物。
2.2.3 抑制Toll样受体信号通路
TLRs是重要的先天免疫信号受体之一,在抗炎免疫中发挥重要作用,启动复杂的信号通路,导致炎症反应。TLRs在心血管疾病尤其是慢性炎症引发的动脉粥样硬化、高血压、中风等疾病的发展中起决定性作用[61]。研究表明,当TLRs受体被激活后,可表达和分泌多种促炎症细胞因子如TNF-α、IL-6等,通过信号传导激活NF-κB。因此,抑制TLRs途径还能有效防止NF-κB途径的激活,起到抗炎作用。TLRs能在各种免疫细胞中表达,已被用于各种感染性和炎症疾病(包括癌症)靶向治疗药物的开发[62]。
EGCG具有预防各种炎症相关疾病的潜力。67LR是一种EGCG介导抗癌作用的细胞表面受体。Hong等[63]研究发现1 μmol·L-1EGCG降低巨噬细胞中TLR4的表达。通过67LR抑制剂或RNAi介导的67LR沉默后,显著减弱了EGCG对LPS诱导的下游信号通路激活和靶基因表达的抑制作用。还发现是67LR介导了EGCG降低TLR4的表达。另外,EGCG诱导了TLR信号的负调节因子Toll相互作用蛋白(Toll interacting protein,Tollip)的显著上调,通过67LR沉默或67LR抑制剂可阻止EGCG的作用。这些发现表明67LR介导了EGCG的抗炎作用。在LPS引起的内皮细胞炎症中,EGCG同样能够通过67LR抑制炎症的发生。另外,Tollip的沉默导致EGCG对LPS诱导的细胞相关粘附分子(例如ICAM-1和VCAM-1)表达的抑制作用消除[64]。这些新发现为理解TLRs信号通路的负调控机制和治疗炎症性疾病的有效治疗干预提供了新的见解。另外,MMP-9、MCP-1和TLR4被证实在动脉粥样硬化和斑块不稳定中起重要作用[65]。Li等[66]研究表明,EGCG(1 μmol·L-1)能够抑制TLR4/MAPK/NF-κB信号通路,降低斑块不稳定性介导细胞因子MMP-9和MCP-1的表达,证明EGCG可能有效稳定动脉粥样硬化斑块。
最近研究表明,TLR4的异常激活在肥胖引起的炎症性疾病中具有关键作用,包括高胰岛素血症、高甘油三酯血症和心血管疾病[67]。Kumazoe等[68]证明了67LR的天然激动剂EGCG通过E3泛素蛋白环指蛋白216(Ring finger protein 216)的上调抑制了TLR4的表达。并且,EGCG以sGC(Soluble guanylate cyclase)依赖性方式上调RNF216。此外,还发现高吸收率67LR激动剂EGCG3˝Me显著降低脂肪组织中TLR4的表达,完全抑制了高脂/高糖(HF/HS)诱导的脂肪组织TNF-α的上调和血清MCP-1的升高。EGCG3˝Me的摄入可预防HF/HS诱导的高胰岛素血症和高甘油三酯血症。因此,67LR是多酚类缓解肥胖引起的炎症的一个有吸引力的靶点。
李海禹等[46]用槲皮素预处理氧化低密度脂蛋白(ox-LDL)刺激的VSMCs,与ox-LDL刺激组相比,槲皮素预处理有效减少TLR4、MyD88 mRNA和蛋白的表达,并呈剂量依赖性(<0.01)。TLR4抑制剂预处理VSMCs也起到了与槲皮素类似的抗炎作用。因此,槲皮素减少ox-LDL诱导的VSMCs炎症因子的表达,可能依赖于其对TLR4介导的炎症通路的调控。
2.2.4 抑制STAT信号通路
IFN及其信号转导及转录激活因子(Signal transduction and activator of transcription,STAT)调节多种炎症反应,IFN-1/STAT系统与许多自身炎症综合症相关,并且可以充当炎症相关组织损伤的驱动因子或抑制剂[69]。IFNγ是一种在组织内稳态、免疫和炎症反应以及肿瘤免疫监测中具有重要作用的细胞因子。IFNγ受体的信号传导激活Janus激酶(Janus Kinase,JAK)和STAT1通路,诱导具有关键免疫效应器功能的经典干扰素刺激基因的表达。巨噬细胞的IFNγ介导极化为“M1样”状态增强促炎活性和巨噬细胞对耐受性和抗炎因子的抵抗力[70]。JAK-STAT信号传导的失调与各种心血管疾病有关,在心肌缺血、血管再狭窄、心力衰竭及心肌保护等过程中发挥重要作用[71]。
近两年的研究表明,茶多酚可以通过调控JAK2/STAT3信号通路发挥抗炎作用[72-74]。EGCG及JAK2特异性抑制剂AG490均能抑制PDGF-BB诱导的VSMCs的增殖和迁移,且EGCG能明显降低PDGF-BB刺激上调的VSMCs的JAK2、STAT3、Cyclin D1蛋白质水平及STAT3磷酸化(p-STAT3)水平。因此,EGCG抑制PDGF-BB诱导的VSMCs增殖和迁移可能通过抑制JAK2/STAT3信号转导通路而实现[75]。此外,石伟林等[76]的研究显示,EGCG通过STAT3通路抑制LPS诱导的血管内皮细胞炎症因子的表达。花青素类是多酚的一种,研究表明,花青素可通过抑制氧化应激和炎症减轻肝脏缺血再灌注损伤,其机制可能与抑制JAK2/STAT3/P53信号通路的激活有关[77]。原花青素可以抑制H9C2大鼠心肌细胞缺氧/复氧(Hypoxia/Reoxygenation,H/R)损伤引起的p-JAK2和p-STAT3水平下调,以及氧化应激反应[78]。
JAK-STAT信号通路在炎症和自身免疫疾病的发病机理中十分重要,长期慢性炎症是心血管疾病发病的重要原因,茶叶中的活性物质在抗炎方面有着显著的效果,但茶叶活性物质在这一信号通路中的调控作用研究较少,需要进一步的研究阐明其联系与内在机制,为茶叶主要活性成分靶向抗炎提供更多证据。
2.2.5 抑制Notch信号通路
Notch信号通路是一种存在于大多数多细胞生物体的细胞信号传导系统,高度保守,是发育和疾病中血管形成和形态发生的关键组成部分,异常或失调的Notch信号传导是许多心血管疾病发生的原因或促成因素[79]。研究表明,Notch信号是心肌梗死后心脏修复和再生的重要调节因子[80]。Notch1通路的激活与TLR4及NF-κB介导的炎症反应密切相关,抑制Notch通路能够改善缺血再灌注过程中对心脏的炎症损伤[81]。
EGCG可通过减少细胞中Notch1 mRNA的表达来抑制Notch1通路的活化[39],Wang等[82]首次确定了EGCG可直接与Notch受体结合。Huang等[83]同样也证实了Notch1作为EGCG靶标在早期炎症中发挥调节作用。在心脏中,Notch参与缺血时的保护反应,减少再灌注诱导的氧化应激和心肌损伤,以及心肌分化[84]。而Notch途径与PI3K/Akt和NF-κB信号通路有交叉作用,并且两种通路都是缺血预处理诱导的心肌保护中的因素[85]。因此Notch信号传导途径可能广泛参与茶叶特征性化合物抑制心血管炎症的过程。而目前的研究主要证明了EGCG在Notch通路中的作用。探索茶叶中的其他特征性成分对Notch信号通路的调控,可在今后临床治疗中达到靶向保护心脏的作用。同时能够更深入的了解茶叶活性成分的抗炎机制。
2.2.6 抑制Nrf2信号通路
Nrf2(Nuclear erythroid 2-related factor 2,Nrf2)是一种碱性亮氨酸拉链(Basic leucine zipper,bZIP)蛋白。近年来研究发现,Nrf2通过协调炎症细胞的募集和抗氧化反应元件(Anti-oxidative response element,ARE)调节基因表达调控炎症反应[86]。氧化应激、血管再狭窄、心脏缺血损伤等都是心血管疾病危险因素,Nrf2在心血管疾病的调控中具有重要的意义[87-88]。
一些研究表明,EGCG调控Nrf2信号通路,通过减少脑梗死面积、抑制平滑肌细胞增殖、调控炎症信号通路(p38MAPK、NF-κB等)等阻止心脑血管疾病的发生[89]。EGCG促进Nrf2-Keap1(Kelch样ECH相关蛋白1,Keap1)复合物的解离,解离的Nrf2易位至细胞核并激活含有ARE元件的基因转录,进而抑制NF-κB;解离的Keap1直接与IKKβ相互作用抑制NF-κB的激活[90]。在缺血性卒中早期,EGCG治疗促进短暂性大脑中动脉阻塞小鼠的血管生成,可能是通过上调Nrf2信号通路。EGCG的保护作用被MAPK/ERK抑制剂减弱[91]。另外,花青素可能通过激活Nrf2信号通路,抑制炎症因子如VCAM-1、MCP-1等的表达,保护内皮细胞减轻动脉粥样硬化[92]。综上所述,茶叶中的部分活性成分,能够通过抑制Nrf2信号通路下调炎症因子的表达,从而对预防慢性炎症引起的心血管疾病有一定的意义。
2.3 调控免疫系统
近年来的研究表明,心血管疾病的发生与免疫系统密切相关,炎症反应能够触发自身免疫系统[93]。EGCG能够参与调控T淋巴细胞和B淋巴细胞介导的炎症反应,抑制炎症的发生[94]。炎症小体是天然免疫系统的重要组成部分,主要有NLRP1、NLRP3、NLRC4、IPAF和AIM2 5种。炎症小体能够激活促炎症蛋白酶Caspase-1,诱导细胞的炎症坏死。已知的炎性小体一般均含有一种NOD样受体(NOD-like receptor,NLR)家族蛋白(如NLRP1),其在炎症性疾病发生发展中发挥了重要作用。其中NLRP3炎症小体被机体各种内外源性危险信号激活后,通过活化Caspase-1促进IL-1β、IL-18的成熟和释放,引起机体的炎症反应,参与肥胖、2型糖尿病、痛风、动脉粥样硬化等炎症性疾病的发生及发展[95-96]。研究表明,EGCG能够下调NLRP1、NLRP3的表达[97-99]。EGCG能够剂量依赖的抑制LPS启动NLRP3炎症小体后caspase-1的活化和IL-1β的分泌。另外,EGCG显著降低了高脂饮食诱导的肥胖小鼠caspase-1的活化和炎性因子IL-1β分泌[100]。花青素通过调节Bcl-2家族蛋白减轻了脑I/R引起的细胞凋亡。同时,花青素抑制TNF-α,IL-1β,IL-6等炎症因子的表达。此外,NF-κB和NLRP3炎性小体途径可能参与花青素的抗炎作用,对脑I/R损伤起到保护作用[101]。
高迁移率族蛋白B1(High mobility group box1,HMGB1)是高迁移率族(HMG)蛋白质超家族的成员,其成员是丰富且普遍存在的核蛋白质。在细胞外,HMGB1可以作为激活先天免疫系统、调节广泛生理病理反应的警报分子。炎症反应发生时,HMGB1可以与晚期糖基化终产物受体(Receptor for advanced glycation endproducts,RAGE)、TLR-2和TLR-4受体相互作用,并且通过与其他促炎介质协同的方式诱导炎症反应。另外,HMGB1在动脉粥样硬化的发展中具有重要的作用[102]。
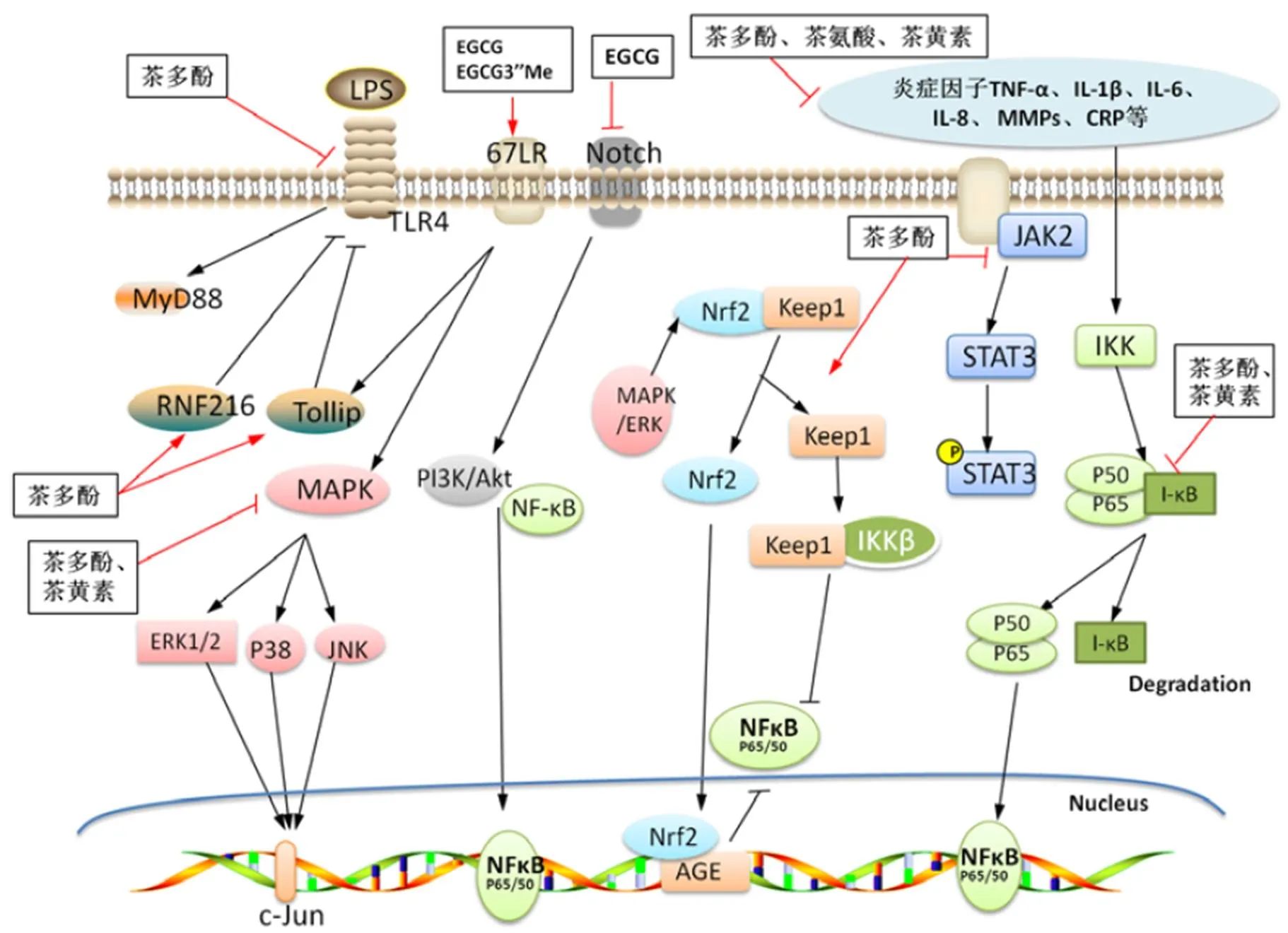
图1 茶叶中的主要特征性成分对NF-κB、MAPKs、TLRs、STAT、Notch及Nrf2信号通路的调控作用示意图
Yang等[103]的研究结果表明,EGCG能够降低颈动脉球囊损伤大鼠内膜面积和内膜面积/内侧面积的比例。EGCG处理显著抑制球囊损伤诱导的HMGB1和RAGE的表达水平。此外,EGCG显著抑制NF-κB活化,以及与HMGB1密切相关的炎症反应和氧化应激损伤。目前的数据提供了EGCG在颈动脉球囊损伤模型中减弱新内膜增生的证据,这表明EGCG可以作为临床中抑制血管再狭窄的潜在药物。另外,EGCG能够刺激自噬并降低内毒素刺激的巨噬细胞中的细胞质HMGB1水平[104]。槲皮素处理降低了内毒素血症动物体内HMGB1的循环水平,并且抑制了LPS诱导的巨噬细胞中HMGB1的释放以及细胞因子活性。因此,槲皮素具有预防LPS诱导的HMGB1释放和促炎症功能[105]。
综上所述,茶叶中的特征性活性成分能够抑制免疫增强的促炎信号及炎症反应,并且其预防心血管疾病的研究主要集中在多酚类物质,这为研究茶叶中其他特征性化合物利用免疫途径控制炎症的发生打下了基础,也为通过免疫途径预防和治疗心血管疾病炎症提供了依据。
3 总结与展望
茶作为世界三大饮料之一,茶叶中的主要特征性化合物的生物活性、药理作用和健康功能研究一直是国内外的热点。近几年的研究表明,心血管疾病是一种慢性炎症引起的疾病。动脉粥样硬化和各种血管手术再狭窄等血管疾病都是由于炎症反应引发的血管平滑肌细胞异常增殖及迁移导致。茶叶中茶多酚尤其是EGCG对心血管的保护作用已被广泛证明,但茶叶中其他特征性化合物及近年来新分离出来的多酚和其他新发现的化合物在抗心血管炎症方面仍有待研究。另外,一些研究结果显示,茶叶及茶叶特征性化合物对慢性炎症引起的高血压、冠心病等心血管疾病具有治疗作用,但对于机制研究较少,需要更深入的探究其分子机制,以便更有效的利用茶叶特征性化合物预防炎症引起的高血压、冠心病等疾病。揭示茶叶中主要特征性化合物抗心血管炎症及其信号传导的分子机制能为预防和治疗心血管疾病的药物研发提供重要的理论依据,为进一步丰富茶叶健康功能知识、推动茶产业的发展做出贡献。
[1] Yang C S, Hong J. Prevention of chronic diseases by tea: possible mechanisms and human relevance [J]. Annual Review of Nutrition, 2013, 33: 161-181.
[2] 毛清黎, 施兆鹏, 李玲, 等. 茶叶儿茶素保健及药理功能研究新进展[J]. 食品科学, 2007, 28(8): 584-589. Mao Q L, Shi Z P, Li L, et al. Research advances of health and pharmacological functions of tea catechins [J]. Food Science, 2007, 28(8): 584-589.
[3] 李露, 吕佳倩, 江承佳, 等. 茶多酚对心血管保护作用的研究进展[J]. 食品科学, 2016, 37(19): 283-288. Li L, Lü J Q, Jiang C J, et al. Advances in research on protective effect of polyphenols in cardiovascular disease [J]. Food Science, 2016, 37(19): 283-288.
[4] 高俊延, 万仁涛. 茶多酚抗动脉粥样硬化研究概况[J]. 中国民族民间药, 2017, 26(23): 54-56. Gao J Y, Wan R T. Research situation of tea polyphenols anti-atherosclerosis [J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2017, 26(23): 54-56.
[5] Collins D R, Tompson A C, Onakpoya I J, et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: systematic review of systematic reviews [J]. BMJ Open. 2017, 7(3): e013650. doi: 10.1136/bmjopen-2016-013650.
[6] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2017》概要[J]. 中国循环杂志, 2018, 33(1): 1-8. Chen W W, Gao R L, Liu L S, et al. Summary of China cardiovascular disease report 2017 [J]. Chinese Circulation Journal, 2018, 33(1): 1-8.
[7] Ueda P, Woodward M, Lu Y, et al. Laboratory-based and office-based risk scores and charts to predict 10-year risk of cardiovascular disease in 182 countries: a pooled analysis of prospective cohorts and health surveys [J].The Lancet Diabetes & Endocrinology, 2017, 5(3): 196-213.
[8] Lu J, Lu Y, Yang H, et al. Characteristics of high cardiovascular risk in 1.7 million Chinese adults [J]. Annals of Internal Medicine. 2019, 170(5): 298-308.
[9] Welsh P, Grassia G, Botha S, et al. Targeting inflammation to reduce cardiovascular disease risk: a realistic clinical prospect? [J]. British Journal of Pharmacology, 2017, 174(22): 3898-3913.
[10] Libby P. Inflammation in atherosclerosis [J]. Arteriosclerosis, Thrombosis, and Vascular Biology. 2012, 32(9): 2045-2051.
[11] Emini Veseli B, Perrotta P, De Meyer GRA, et al. Animal models of atherosclerosis [J]. European Journal of Pharmacology, 2017, 816: 3-13.
[12] Chistiakov D A, Orekhov A N, Bobryshev Y V, et al. Vascular smooth muscle cell in atherosclerosis [J]. Acta Physiologica, 2015, 214(1): 33-50.
[13] Lim S, Park S. Role of vascular smooth muscle cell in the inflammation of atherosclerosis [J]. BMB Rep, 2014, 47(1): 1-7.
[14] Ashino T, Yamamoto M, Numazawa S. Nrf2/Keap1 system regulates vascular smooth muscle cell apoptosis for vascular homeostasis: role in neointimal formation after vascular injury [J]. Scientific Reports, 2016, 6: 26291. doi: 10.1038/srep26291.
[15] Serino A, Salazar G. Protective role of polyphenols against vascular inflammation aging and cardiovascular disease [J]. Nutrients, 2019, 11(1): 53. doi: 10.3390/nu11010053.
[16] 郭盼盼, 冯任南, 陈杨. 饮茶对心血管疾病的保护作用[J]. 卫生研究, 2018, 47(5): 858-861.
[17]Williamson G. The role of polyphenols in modern nutrition [J]. Nutrition Bulletin, 2017, 42(3): 226-235.
[18] Shirakami Y, Sakai H, Kochi T, et al. Catechins and its role in chronic diseases [J]. Advances in Experimental Medicine and Biology, 2016, 929: 67-90.
[19] Pang J, Zhang Z, Zheng T Z, et al. Green tea consumption and risk of cardiovascular and ischemic related diseases: A meta-analysis [J]. International Journal of Cardiology, 2016, 202: 967-974.
[20] 王泽穆. 饮食与心血管病风险的Meta分析及绿茶多酚EGCG的抗炎机制实验研究[D]. 南京: 南京医科大学, 2014.Wang Z M. Dietary intake and risk of cardiovascular disease: a meta-analysis, and the anti-inflammatory effects of green tea polyphenol EGCG in HUVECs [D]. Nanjing: Nanjing Medical University, 2014.
[21] 李雅, 冯翠娜, 刘胜辉, 等. 茶多酚对冠心病合并糖尿病患者sCD146和PAPP-A水平的影响[J]. 福建茶叶, 2016, 38(5): 12-13. Li Y, Feng C N, Liu S H, et al. Effects of Tea Polyphenols on the level of sCD146 and PAPP-A in the patients with coronary artery disease combined with diabetes mellitus [J]. Tea in Fujian, 2016, 38(5):12-13.
[22] Marina María de Jesús Romero-Prado, Jesús Aarón Curiel-Beltrán, María Viviana Miramontes-Espino, et al. Dietary flavonoids added to pharmacological antihypertensive therapy are effective in improving blood pressure [J]. Basic & Clinical Pharmacology & Toxicology, 2015, 117(1): 57-64.
[23] Nogueira L P, Nogueira Neto J F, Klein M R, et al. Short-term effects of green tea on blood pressure, endothelial function, and metabolic profile in obese prehypertensive women: A crossover randomized clinical trial [J]. Journal of the American College of Nutrition, 2017, 36(2): 108-115.
[24] Bogdanski P, Suliburska J, Szulinska M, et al. Green tea extract reduces blood pressure, inflammatory biomarkers, and oxidative stress and improves parameters associated with insulin resistance in obese, hypertensive patients [J]. Nutrition Research, 2012, 32(6): 421-427.
[25] Shen C L, Samathanam C, Tatum O L, et al. Green tea polyphenols avert chronic inflammation-induced myocardial fibrosis of female rats [J]. Inflammation Research, 2011, 60(7): 665-672.
[26] Li J, Ye L, Wang X, et al. (−)-Epigallocatechin gallate inhibits endotoxin-induced expression of inflammatory cytokines in human cerebral microvascular endothelial cells [J]. Journal of Neuroinflammation, 2012, 9(1): 161. doi: 10.1186/1742-2094-9-161.
[27] 殷文晗. 表儿茶素对大鼠脑出血的保护作用及相关机制的研究[D]. 郑州: 郑州大学, 2017. Yin W H. The protective effect of orally intake of (-)-epicatechin in intracecebral hemorrhage rats and the related mechanisms [D]. Zhengzhou: Zhengzhou University, 2017.
[28] Suzuki J, Isobe M, Morishita R, et al. Tea polyphenols regulate key mediators on inflammatory cardiovascular diseases [J]. Mediators of Inflammation, 2009: 494928. doi: 10.1155/2009/494928.
[29] 章琦. 儿茶素对实验性大鼠心衰模型的保护作用及其初步机制研究[D]. 合肥: 安徽医科大学, 2014. Zhang Q. Study on protective effects of catchin on exprimental heart failure in rats and its mechanism [D]. Hefei: Anhui Medical University, 2014.
[30] Mahajan N, Dhawan V, Sharma G, et al. Induction of inflammatory gene expression by THP-1 macrophages cultured in normocholesterolaemic hypertensive sera and modulatory effects of green tea polyphenols [J]. Journal of Human Hypertension, 2008, 22(2): 141-143.
[31] Wang D, Gao Q, Zhao G, et al. Protective effect and mechanism of theanine on lipopolysaccharide-induced inflammation and acute liver injury in mice [J]. Journal of Agricultural and Food Chemistry, 2018, 66(29): 7674-7683.
[32] Yamakuchi M, Bao C, Ferlito M, et al. Epigallocatechin gallate inhibits endothelial exocytosis [J]. Biological Chemistry, 2008, 389(7): 935-941.
[33]Hwang Y P, Jin S W, Choi J H, et al. Inhibitory effects of l-theanine on airway inflammation in ovalbumin-induced allergic asthma [J]. Food & Chemical Toxicology, 2017, 99: 162-169.
[34] Wang Q M, Wang H, Li Y F, et al. Inhibition of EMMPRIN and MMP-9 expression by epigallocatechin-3-gallate through 67-kDa laminin receptor in PMA-induced macrophages [J]. Cellular Physiology and Biochemistry, 2016, 39(6): 2308-2319.
[35] 赵兴梅, 范春雷. 儿茶素对小鼠巨噬细胞VCAM-1表达的影响[J]. 中国药理学通报, 2011, 27(3): 443-444. Zhao X M, Fan C L. Effect of catechin on expression of vascular cell adhesion factor-1 in mouse macrophages [J]. Chinese Pharmacological Bulletin, 2011, 27(3): 443-444.
[36] Liu T, Zhang L, Joo D, et al. NF-κB signaling in inflammation [J]. Signal Transduction and Targeted Therapy, 2017, 2: e17023. doi: 10.1038/sigtrans.2017.23.
[37] Van Der Heiden K, Cuhlmann S, Luong L, et al. Role of nuclear factor κB in cardiovascular health and disease [J]. Clinical Science, 2010, 118(10): 593-605.
[38] Lagha A B, Grenier D. Tea polyphenols protect gingival keratinocytes against TNF-α-induced tight junction barrier dysfunction and attenuate the inflammatory response of monocytes/macrophages [J]. Cytokine, 2019, 115: 64-75.
[39] 文祎, 蔡淑娴, 黄建安. 茶叶活性成分的抗炎作用及其机制研究进展[J]. 食品安全质量检测学报, 2017, 8(10): 3925-3930. Wen Y, Cai S X, Huang J A. Research progress in anti-inflammatory effects of tea active ingredients and its mechanisms [J]. Journal of Food Safety & Quality, 2017, 8(10): 3925-3930.
[40] Li J, Sapper T N, Mah E, et al. Green tea extract treatment reduces NF-κB activation in mice with diet-induced nonalcoholic steatohepatitis by lowering TNFR1 and TLR4 expression and ligand availability [J]. The Journal of Nutritional Biochemistry, 2017, 41: 34-41.
[41] Li J, Sapper T N, Mah E, et al. Green tea extract provides extensive Nrf2-independent protection against lipid accumulation and NF-κB pro-inflammatory responses during nonalcoholic steatohepatitis in mice fed a high-fat diet [J]. Molecular Nutrition & Food Research, 2016, 60(4): 858-870.
[42] Tipoe G, Leung T M, Hung M W, et al. Green tea polyphenols as an anti-oxidant and anti-inflammatory agent for cardiovascular protection [J]. Cardiovascular & Hematological Disorders-Drug Targets, 2007, 7(2): 135-144.
[43] Nam S, Smith D M, Dou Q P. Ester bond-containing tea polyphenols potently inhibit proteasome activityand[J]. Journal of Biological Chemistry, 2001, 276(16): 13322-13330.
[44] Wang Z M, Gao W, Wang H, et al. Green tea polyphenol epigallocatechin-3-gallate inhibits TNF-α-induced production of monocyte chemoattractant protein-1 in human umbilical vein endothelial cells [J]. Cell Physiology Biochemistry. 2014, 33(5): 1349-1358.
[45] Babu P V, Si H, Liu D. Epigallocatechin gallate reduces vascular inflammation in db/db mice possibly through an NF-κB-mediated mechanism [J]. Molecular Nutrition & Food Research, 2012, 56(9): 1424-1432.
[46] 李海禹, 孟哲, 王琛, 等. 槲皮素对氧化低密度脂蛋白诱导的血管平滑肌细胞炎症反应的影响[J]. 中国合理用药探索, 2018, 15(3): 29-33. Li H Y, Meng Z, Wang C, et al. Effects of quercetin on inflammatory reactions induced by oxidized low density lipoprotein in vascular smooth muscle cells [J]. Chinese Journal of Rational Drug Use, 2018, 15(3): 29-33.
[47] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003. Wan X C. Tea biochemistry [M]. 3rd. Beijing: China Agricuture Press, 2003.
[48] 李伟. 茶黄素中压色谱制备及对大鼠平滑肌细胞的炎症抑制作用[D]. 合肥: 安徽农业大学, 2016. Li W. The inflammatory inhition of theaflavin prepare by MPLC in VSMC [D]. Hefei: Anhui Agriculture University, 2016.
[49] 李红月, 邓惠芳, 戴长蓉, 等. 茶黄素对大鼠缺血性脑损伤所致炎症反应的作用[J]. 中国医院药学杂志, 2016, 36(20): 1755-1759. Li H Y, Deng H F, Dai C R, et al. Effects of theaflavin on inflammation caused by ischemic brain injuries in rats [J]. Chinese Journal of Hospital Pharmacy, 2016, 36(20): 1755-1759.
[50] Wu Y, Jin F, Liu J, et al. Protective effect of theaflavin-3-digallate on lipopolysaccharide-induced inflammation injury in macrophage cells [J]. International Journal of Pharmacology, 2017, 13: 980-989.
[51] Fu G L, Wang H, Cai Y L, et al. Theaflavin alleviates inflammatory response and brain injury induced by cerebral hemorrhage via inhibiting the nuclear transcription factor kappa β-related pathway in rats [J]. Drug Design, Development and Therapy, 2018, 12: 1609-1619.
[52] Yang Y, Kim S C, Yu T, et al. Functional roles of p38 mitogen-activated protein kinase in macrophage-mediated inflammatory responses [J]. Mediators of Inflammation, 2014: 352371. doi: 10.1155/2014/352371.
[53] Ohishi T, Goto S, Monira P, et al. Anti-inflammatory action of green tea [J]. Anti-Inflammatory & Anti-Allergy Agents in Medicinal Chemistry, 2016, 15(2): 74-90.
[54] Won S M, Park Y H, Kim H J, et al. Catechins inhibit angiotensin II-induced vascular smooth muscle cell proliferation via mitogen-activated protein kinase pathway [J]. Experimental & Molecular Medicine, 2006, 38(5): 525-534.
[55] Zheng Y, Song H J, Kim C H, et al. Inhibitory effect of epigallocatechin 3--gallate on vascular smooth muscle cell hypertrophy induced by angiotensin Ⅱ[J]. Journal of Cardiovascular Pharmacology, 2004, 43(2): 200-208.
[56] Yang J, Han Y, Sun H, et al. (−)-Epigallocatechin gallate suppresses proliferation of vascular smooth muscle cells induced by high glucose by inhibition of PKC and ERK1/2 signalings [J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11483-11490.
[57] 刘洪, 唐旭, 汤志梅, 等. 绿茶多酚对兔主动脉粥样硬化斑块中磷酸化p38MAPK的影响[J]. 天然产物研究与开发, 2017, 29(9): 1568-1572. Liu H, Tang X, Tang Z M, et al. Effect of green tea polyphenols on phosphorylated p38MAPK in experimental atherosclerosis rabbits [J]. Natural Product Research and Development, 2017, 29(9): 1568-1572.
[58] 王齐明. 绿茶多酚EGCG增强动脉粥样硬化斑块稳定性及其相关机制研究[D]. 南京: 南京医科大学, 2017. Wang Q M. Green tea polyphenol epigallocachin-3-gallate enhance atherosclerotic plaque stability in high-fat diet fed apolipoprotein e-deficient mice [D]. Nanjing: Nanjing Medical University, 2017.
[59] Kim S J, Li M, Jeong C W, et al. Epigallocatechin-3-gallate, a green tea catechin, protects the heart against regional ischemia-reperfusion injuries through activation of RISK survival pathways in rats [J]. Arch Pharmarcology Research. 2014, 37(8): 1079-1085.
[60] Wu Y, Fujun Jin F, Wang Y, et al.andanti-inflammatory effects of theaflavin-3,3'-digallate on lipopolysaccharide- induced inflammation [J]. European Journal of Pharmacology, 2017, 794: 52-60.
[61] Goulopoulou S, Mccarthy C G, Webb R C. Toll-like receptors in the vascular system: sensing the dangers within [J]. Pharmacological Reviews, 2015, 68(1): 142-167.
[62] Kumar V. Toll-like receptors in immunity and inflammatory diseases: Past, present, and future [J]. International Immunopharmacology, 2018, 59: 391-412.
[63] Hong B E, Fujimura Y, Yamada K, et al. TLR4 signaling inhibitory pathway induced by green tea polyphenol epigallocatechin-3-gallate through 67-kDa laminin receptor [J]. The Journal of Immunology, 2010, 185(1): 33-45.
[64] Byun E B, Mi S Y, Kim J H, et al. Epigallocatechin-3-gallate-mediated Tollip induction through the 67-kDa laminin receptor negatively regulating TLR4 signaling in endothelial cells [J]. Immunobiology, 2014, 219(11): 866-872.
[65] Kobayashi N, Takano M, Hata N, et al. Matrix metalloproteinase-9 as a marker for plaque rupture and a predictor of adverse clinical outcome in patients with acute coronary syndrome: An optical coherence tomography study [J]. Cardiology, 2016, 135(1): 56-65.
[66] Li Y F, Wang H, Fan Y, et al. Epigallocatechin-3-gallate inhibits matrix metalloproteinase-9 and monocyte chemotactic protein-1 expression through the 67-κDa laminin receptor and the TLR4/MAPK/NF-κB signalling pathway in lipopolysaccharide-induced macrophages [J]. Cell Physiologyl Biochemistry. 2017, 43(3): 926-936.
[67] Pal D, Dasgupta S, Kundu R, et al. Fetuin-A acts as an endogenous ligand of TLR4 to promote lipid-induced insulin resistance [J]. Nature Medicine, 2012, 18(8): 1279-1285.
[68] Kumazoe M, Nakamura Y, Yamashita M, et al. Green tea polyphenol epigallocatechin-3-gallate suppresses toll-like receptor 4 expression via up-regulation of E3 ubiquitin-protein ligase RNF216 [J]. Journal of Biological Chemistry, 2017, 292(10): 4077-4088.
[69] Rauch I, Müller, Mathias, Decker T. The regulation of inflammation by interferons and their STATs [J]. JAK-STAT, 2013, 2(1): e23820. doi: 10.4161/jkst.23820.
[70] Ivashkiv L B. IFNγ: signalling, epigenetics and roles in immunity, metabolism, disease and cancer immunotherapy [J]. Nature Reviews Immunology, 2018, 18(9): 545-558.
[71] Kishore R, Verma S K. Roles of STATs signaling in cardiovascular diseases [J]. JAK-STAT, 2012, 1(2): 118-124.
[72] 肖鹏. 表没食子儿茶素没食子酸酯对脂多糖诱导的小鼠巨噬细胞炎症相关因子表达的影响[D]. 新乡: 河南师范大学, 2014. Xiao P. Effects of epigallocatechin-3-gallate on the expression of inflammation-related cytokines in mouse macrophage [D]. Xinxiang: Henan Normal University, 2014.
[73] Singh A K, Fechtner S, Wang D, et al. Epigallocatechin-3-Gallate (EGCG) suppresses systemic inflammation by inhibiting IL-6-induced STAT3 activation in cultured hepatocytes and in liver tissue of Adjuvant-Induced Arthritis (AIA) rats [J]. Arthritis Rheumatology, 2018, 70: 111.
[74] 席进, 葛思堂, 左芦根, 等. 绿茶多酚抑制肠道JAK2/STAT3信号通路保护三硝基苯磺酸诱导的小鼠结肠炎肠黏膜屏障[J]. 细胞与分子免疫学杂志, 2018, 34(3): 237-241. Xi J, Ge S T, Zuo L G, et al. Protective role of green tea polyphenols in intestinal mucosal barrier function of mice with colitis induced by TNBS through inhibiting JAK2/STAT3 pathway [J]. Chinese Journal of Cellular and Molecular Immunology, 2018, 34(3): 237-241.
[75] 邓颖, 史伟浩, 童进东, 等. EGCG对血小板源性生长因子-BB诱导的大鼠血管平滑肌细胞增殖和迁移的影响[J]. 复旦学报(医学版), 2018, 45(4): 503-508. Deng Y, Shi W H, Tong J D, et al. Effects of epigallocatechin-3-gallate on the proliferation and migration of vascular smooth muscle cells induced by platelet-derived growth factor BB in rats [J]. Fudan University Journal of Medical Sciences, 2018, 45(4): 503-508.
[76] 石伟林, 徐瑶, 宋如晦, 等. EGCG通过STAT3抑制血管内皮细胞炎性因子表达[J]. 生物技术, 2018, 28(2): 124-129, 135. Shi W L, Xu Y, Song R H, et al. EGCG inhibits LPS-induced inflammatory cytokines through STAT3 pathway in vascular endothelial cells [J]. Biotechnology, 2018, 28(2): 124-129, 135.
[77] 罗林娜, 杨萍, 黄伟. 花青素对大鼠肝缺血再灌注损伤的作用及其机制[J]. 西安交通大学学报(医学版), 2016, 37(4): 594-598. Luo L N, Yang P, Huang W. The effect and mechanism of anthocyanin on hepatic ischemia reperfusion injury in rats [J]. Journal of Xi'an Jiaotong University(Medical Sciences) , 2016, 37(4): 594-598.
[78] 俞辰斌, 赵国龙, 于立明, 等. JAK2/STAT3信号通路介导原花青素抗H9C2细胞缺氧/复氧损伤[J]. 生理学报, 2016, 68(5): 568-574. YU C B, ZHAO G L, Yu L M, et al. Proanthocyanidin protects H9C2 cells against hypoxia/reoxygenation injury via JAK2/STAT3 signaling pathway [J]. Acta Physiologica Sinica, 2016, 68(5): 568-574.
[79] Baeten J T, Lilly B. Notch signaling in vascular smooth muscle cells [J]. Advance Pharmacology, 2016, 78: 351-382.
[80] Li Y, Hiroi Y, Liao J K. Notch signaling as an important mediator of cardiac repair and regeneration after myocardial infarction [J]. Trends in Cardiovascular Medicine, 2010, 20(7): 228-231.
[81] 徐晓嫦, 朱晔, 张慧涛, 等. Notch通路在大鼠肾脏缺血再灌注损伤TLR4介导的炎症反应中的作用[J]. 中国病理生理杂志, 2016, 32(3): 485-491. Xu X C, Zhu Y, Zhang H T, et al. Role of Notch pathway in Toll-like receptor 4 mediated inflammatory response in renal ischemia reperfusion injury in rats [J]. Chinese Journal of Pathophysiology, 2016, 32(3): 485-491.
[82] Wang T F, Xiang Z M, Wang Y, et al. (−)-Epigallocatechin gallate targets notch to attenuate the inflammatory response in the immediate early stage in human macrophages [J]. Frontiers in Immunology, 2017, 8: 433. doi: 10.3389/fimmu.2017.00433.
[83] Huang Y W, Zhu Q Q, Yang X Y, et al. Wound healing can be improved by (−)-epigallocatechin gallate through targeting Notch in streptozotocin-induced diabetic mice [J]. The FASEB Journal, 2019, 33(1): 953-964.
[84] Nistri S, Sassoli C, Bani D. Notch signaling in ischemic damage and fibrosis: Evidence and clues from the heart [J]. Frontier Pharmacology, 2017, 8: 187. doi: 10.3389/fphar.2017.00187.
[85] Yang Y, Duan W, Jin Z, et al. New role of Notch-mediated signaling pathway in myocardial ischemic preconditioning [J]. Medical Hypotheses, 2011, 76(3): 427-428.
[86] Ahmed S M, Luo L, Namani A, et al. Nrf2 signaling pathway: Pivotal roles in inflammation [J]. Biochimica et Biophysica Acta - Molecular Basis of Disease. 2017, 1863(2): 585-597.
[87] 李泽龙, 王茂, 鄢东海, 等. Nrf2与心脏衰老的相关研究进展[J]. 西南国防医药, 2019, 29(1): 91-93. Li Z L, Wang M, Yan D H, et al. Research progress of Nrf2 and heart aging [J]. Medical Journal of National Defending Forces in Southwest China, 2019, 29(1): 91-93.
[88] Kloska D, Kopacz A, Piechota-Polanczyk A, et al. Nrf2 in aging-Focus on the cardiovascular system [J]. Vascular Pharmacology, 2019, 112: 42-53.
[89] 杨涪, 刘旭, 李明春. 表没食子儿茶素没食子酸酯作为Nrf2/ARE信号通路激活剂的研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(8): 832-839. Yang F, Liu X, Li M C. Epigallocatechin-3-gallate as an activator of Nrf2/ARE signaling pathway: a review [J]. Chinese Journal of Pharmacology and Toxicology, 2017, 31(8): 832-839.
[90] Jiang J, Mo Z C, Yin K, et al. Epigallocatechin-3-gallate prevents TNF-α-induced NF-κB activation thereby upregulating ABCA1 via the Nrf2/Keap1 pathway in macro-phage foam cells [J]. International Journal of Molicular Medecine, 2012, 29(5): 946-956.
[91] Bai Q, Lyu Z, Yang X, et al. Epigallocatechin-3-gallate promotes angiogenesis via up-regulation of Nfr2 signaling pathway in a mouse model of ischemic stroke [J]. Behavior Brain Research, 2017, 321: 79-86.
[92] Aboonabi A, Singh I. Chemopreventive role of anthocyanins in atherosclerosis via activation of Nrf2-ARE as an indicator and modulator of redox [J]. Biomedicine & Pharmacotherapy, 2015, 72: 30-36.
[93] Fernándezgutiérrez B, Perrotti P P, Gisbert J P, et al. Cardiovascular disease in immune-mediated inflammatory diseases: A cross-sectional analysis of 6 cohorts [J]. Medicine, 2017, 96(26): e7308. doi: 10.1097/MD.0000000000007308.
[94] 阎羽欣, 彭昊, 陈广洁. EGCG介导的免疫调节及其在自身免疫病模型中的应用[J]. 现代免疫学, 2018, 38(5): 420-424. Yan Y X, Peng H, Chen G J. Immune regulation mediated by EGCG and its application in autoimmune disease model [J].Current Immunology, 2018, 38(5): 420-424.
[95] 刘旦旦, 周静, 高峰. NLRP3炎症小体及其与心血管疾病的关系[J]. 世界最新医学信息文摘, 2018, 18(72): 88-89, 91. Liu D D, Zhou J, Gao F. New development of NLRP3 inflammasome and the connection with cardiovascular diseases [J]. World Latest Medicine Information, 2018, 18(72): 88-89, 91.
[96] Zhou W, Chen C, Chen Z, et al. NLRP3: A novel mediator in cardiovascular disease [J]. J Immunology Research, 2018, 2018: 5702103. doi: 10.1155/2018/5702103.
[97] Gao Z, Han Y, Hu Y, et al. Targeting HO-1 by epigallocatechin-3-gallate reduces contrast-induced renal injury via anti-oxidative stress and anti-inflammation pathways [J]. PLOS One, 2016, 11(2): e0149032. doi: 10.1371/journal.pone.0149032.
[98] Ellis L Z, Liu W, Luo Y, et al. Green tea polyphenol epigallocatechin-3-gallate suppresses melanoma growth by inhibiting inflammasome and IL-1β secretion [J]. Biochemistry Biophysics Research Communication, 2011, 414(3): 551-556.
[99] Tsai P Y, Ka S M, Chang JM, et al. Epigallocatechin-3-gallate prevents lupus nephritis development in mice via enhancing the Nrf2 antioxidant pathway and inhibiting NLRP3 inflammasome activation [J]. Free Radical Biological Medecine, 2011, 51: 744-754.
[100]阴海鹏. 多酚类化合物通过抑制NLRP3炎症小体发挥抗炎作用的研究[D]. 济南: 山东大学, 2018. Yin H P. polyphenols prevents inflammation through inhibition of the NLRP3 inflammasome [D]. Jinan: Shandong University, 2018.
[101]Pan Z, Cui M, Dai G, et al. Protective effect of anthocyanin on neurovascular unit in cerebral ischemia/reperfusion injury in rats [J]. Frontier Neuroscience, 2018, 12: 947. doi: 10.3389/fnins.2018.00947.
[102]Chen J, Zhang J, Xu L, et al. Inhibition of neointimal hyperplasia in the rat carotid artery injury model by a HMGB1 inhibitor [J]. Atherosclerosis, 2012, 224(2): 332-339.
[103]Yang B, Gao P, Wu X, et al. Epigallocatechin-3-gallate attenuates neointimal hyperplasia in a rat model of carotid artery injury by inhibition of high mobility group box 1 expression [J]. Experimental and Therapeutic Medicine, 2017, 14(3): 1975-1982.
[104]Li W, Zhu S, Li J, et al. EGCG stimulates autophagy and reduces cytoplasmic HMGB1 levels in endotoxin-stimulated macrophages [J]. Biochemical pharmacology, 2011, 81(9): 1152-1163.
[105]Tang D, Kang R, Xiao W, et al. Quercetin prevents LPS-induced high-mobility group box 1 release and proinflammatory function [J]. American Journal of Respiratory Cell and Molecular Biology, 2009, 41(6): 651-660.
Recent Advance on Anti-cardiovascular Inflammation of Major Characteristic Compounds in Tea
YAO Min, LI Daxiang, XIE Zhongwen*
State Key Laboratory of Tea Plant Biology and Utilization. Anhui Agricultural University, Hefei 230036, China
Chronic inflammation is one of the important causes of cardiovascular diseases such as atherosclerosis, hypertension and myocardial infarction. Inflammatory factors such as IL-6, TNF-α and IL-1β can induce many cardiovascular diseases, including myocardial hypertrophy, myocardial fibrosis and abnormal proliferation of vascular smooth muscle cells. Tea is rich in characteristic compounds. These compounds play preventive and therapeutic roles for cardiovascular diseases by inhibiting proinflammatory cytokines production, and regulating the signal pathways such as NF-κB, MAPK and Tolls-like receptors. In this review, we summarized the recent advance of the main characteristic compounds in tea on preventing inflammation related cardiovascular diseases.
cardiovascular inflammation, tea polyphenols, signaling pathways, characteristic compounds
S571.1;Q946.84+1
A
1000-369X(2020)01-001-14
2019-03-26
2019-07-04
国家自然科学基金(31571207)、安徽省高等学校自然科学重大项目(KJ015ZD22)
姚敏,女,硕士研究生,主要从事茶与健康方面的研究。yaomin1993rz@126.com。
zhongwenxie@ahau.edu.cn

