7株木霉菌对火龙果3种病原菌的拮抗作用
陈迪 侯巨梅 邢梦玉 彦哲 刘铜
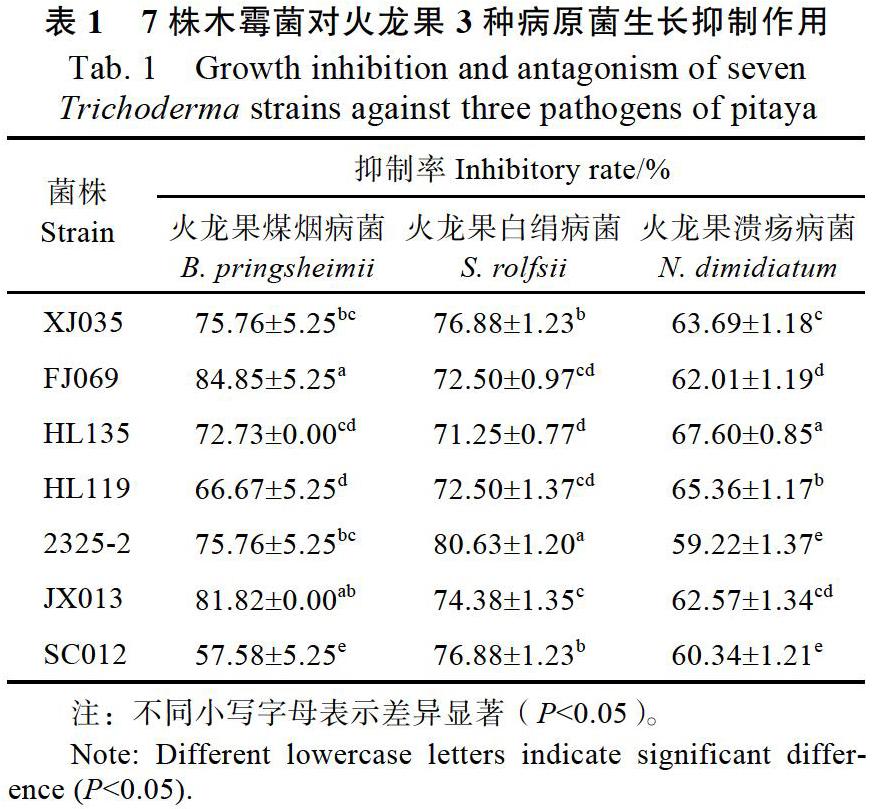


摘 要:本研究利用对峙培养及发酵液、挥发性物质的抑菌活性测定,分析了7株木霉菌对火龙果溃疡病菌、煤烟病菌和白绢病菌的拮抗作用,并测定木霉菌几丁质酶活性。结果表明:通过对峙培养发现7株木霉菌对火龙果3种病原菌均有一定的抑制作用,其中木霉菌HL135、FJ069和2325-2分别对火龙果溃疡病菌、煤烟病菌和白绢病菌抑制率最大,其抑制率分别为(67.60±0.85)%、(84.85±5.25)%和(80.63±1.20)%。7株木霉菌的发酵液和挥发性物质对3种病原菌也有不同程度的抑制作用。通过对木霉菌几丁质酶活性测定,发现木霉菌SC012具有较高的几丁质酶活性。这些结果将为开发木霉菌复合制剂防治火龙果病害提供理论基础。
关键词:木霉菌;发酵液;挥发性物质;几丁质酶;拮抗活性;火龙果;病原菌
中图分类号:S476.1 文献标识码:A
Abstract: The antagonistic activity of seven Trichoderma strains against three pathogens of pitaya were analyzed using confront test and determination of antifungal acitivity of fermentation broth and volatile substances, and the chitinase activity of the Trichoderma strains were measured. The seven Trichoderma strains inhibited the growth of three pathogens to some extent. In dual culture, Trichoderma strain HL135, FJ069 and 2325-2 inhibited Neoscytalidium dimidiatum, Blastocladia pringsheimii and Sclerotium rolfsii with the highest inhibition rate of (67.60±0.85)%, (84.85±5.25)% and (80.63±1.20)%, respectively. The fermentation broth and volatile substances of the seven Trichoderma strains had different degree of inhibition on the three pathogens of pitaya. The chitinase activity of Trichoderma SC012 was higher than that of other strains by the determination of chitinase activity. The results would provide a theoretical basis for the development of Trichoderma compound agents to control pitaya disease.
Keywords: Trichoderma; fermentation broth; volatile inhibitors; chitinase; antagonistic activities; pitaya; pathogen
DOI: 10.3969/j.issn.1000-2561.2020.12.018
火龙果(Hylocereus undatus Britt. et Rose)属于仙人掌科(Cactaceae)量天尺属(Hylocereus),是一种具有较高经济价值和营养价值的集水果、花卉为一体的热带、亚热带果树,被誉为保健食品和果品珍品[1],于20世纪90年代初引种到中国台湾。随着种植规模的扩大,火龙果已逐步成为我国南方地区农民经济收入的重要来源。在火龙果种植过程中,由于种植集中,种植品种单一化,火龙果溃疡病(Neoscytalidium dimidiatum)、白绢病(Sclerotium rolfsii)和煤烟病(Blastocladia pringsheimii)逐年加重,致使火龙果产量和品质急剧下降。目前,这些病害的防治主要以化学防治为主,但化学防治会对人类健康和生态环境造成危害和破坏作用,也易导致病原菌产生抗药性。因此,寻求安全有效且环境友好的病害防治手段将有助于火龙果产业的绿色健康发展。
木霉菌(Trichoderma spp.)是广泛分布于森林、农田等潮湿生境中土壤、腐木、落叶以及真菌子实体上的拮抗微生物[2],在生物防治中的应用和研究非常广泛。木霉菌对植物病原菌的广谱拮抗作用,已被用于曲霉菌(Aspergillus spp.)、腐霉菌(Pythium spp.)、假单胞菌(Pseudomons adaceae)、轮枝孢菌(Pseudomons adaceae)等多种病原菌引起的植物病害的防治[3-6]。本研究拟通过测定7株木霉菌与火龙果3种病原菌的对峙培养、发酵液和挥发性物质抑制作用及几丁质酶的活性,研究木霉菌对火龙果病原菌的拮抗效果,为下一步开发木霉菌复合制剂防治火龙果病害提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 靶标病原菌为引起火龙果溃疡病的新暗色柱节孢(Neoscytalidium dimidiatum)、煤烟病的芽枝霉(Blastocladia pringsheimii)和白绢病的齐整小核菌(Sclerotium rolfsii),均由海南大学植物保护学院谢昌平副教授惠赠。哈茨木霉2325-2(T. harzianum)、哈茨木霉XJ035(T. harzianum)、棘孢木霉FJ069(T. asperellum)、棘孢木霉HL119(T. asperellum)、棘孢木霉HL135(T. asperellum)、棘孢木霉JX013(T. asperellum)和棘孢木霉SC012(T. asperellum),均由海南大學植物保护学院木霉菌研究课题组提供。
7株木霉菌震荡培养4 d后检测几丁质酶活性,结果表明:木霉菌SC012的几丁质酶活性最高,达到1.83 U/mL,与其他木霉菌株的几丁质酶活性差异显著(P<0.05),而木霉菌FJ069的几丁质酶活性最低,为0.83 U/mL,只有木霉菌SC012几丁质酶活性的45%,结果表明不同木霉菌株产生几丁质酶的能力存在一定的差异。
3 讨论
木霉菌对环境的适应能力强,生长速度快,能够抢夺病原菌的营养和生存空间,致使病原菌的生长受到抑制[11]。平板对峙试验可直观地观察到木霉菌对病原菌的抑菌效果,因此可以快速筛选出具有较强拮抗作用的木霉菌株。夏海波等[12]用平板对峙实验,筛选出8株对蔬菜病害防治效果良好的菌株。张建等[13]筛选得到9株棘孢木霉,对桑葚菌核病菌的抑菌率达到80%以上。Jiang等[14]通过对峙培养、细胞学和超微结构显示,棘孢木霉CGMCC 6422对辣椒疫霉病具有较强的抑制作用。本研究通过对峙培养试验,筛选到对火龙果煤烟病菌具有较好拮抗效果的木霉菌FJ069和JX013,对火龙果白绢病菌具有较好拮抗效果的木霉菌2325-2,抑菌率均达80%以上。而所有供试木霉菌对火龙果溃疡病菌的抑制率均不高,表明对于生长速度较快的病原菌,木霉菌难以通过快速生长占领其生存空间,致使抑制率降低。因此在利用木霉菌防治病原菌时,应以预防为主,才能达到更好的防治效果。
几丁质酶是木霉菌产生的细胞壁降解酶类(CWDEs)之一[15],木霉菌在重寄生过程中可以通过释放细胞壁降解酶降解病原菌的细胞壁来杀死病原菌,在丝状真菌中,木霉菌所含的几丁质酶基因是最多的[16]。木霉菌可以产生抗真菌活性的几丁质酶和水解几丁质酶,且不同几丁质酶对病原菌的拮抗活性表现出特异性,部分几丁质酶无拮抗真菌的活性[17]。本研究测定了7株木霉菌的几丁质酶活性,其中木霉菌SC012和HL135具有较高的几丁质酶活性,这2株木霉菌在发酵液和挥发性物质抑菌试验中均表现出了较好的抑菌效果,但在对峙培养中抑菌效果较差,可能是由于木霉菌SC012和HL135的生长速度较其他木霉菌慢,不能快速地占领病原物的生存空间,以及其几丁质酶中拮抗真菌活性的几丁质酶较少所致。Lorito等[18-20]通过研究指出,木霉菌几丁质酶只有几种同时具有水解几丁质活性和抗真菌活性。李华[21]也发现木霉菌对病原菌的生防能力与几丁质酶活性高低没有直接的相关性。因此,在评定木霉菌的拮抗作用时,应当结合多种影响因子进行分析。
木霉菌可以产生较丰富的抗生次生代谢产物,目前已经确定的抗生代谢产物已经超过了140种,而且不同菌株之间产生的次生代谢产物种类存在一定差异[22]。例如,陈凯等[23]发现绿色木霉LTR-2产生的吡喃酮类物质5,6-二氢-6-戊基-2H-吡喃-2-酮在20 mg/L的浓度下对11种植物病原菌均有抑制作用。Liu等[24]从哈茨木霉中提取的6种蒽醌类化合物,以及Vinale等[25]从木霉T. cerinum的培养滤液中分离出一种新的羟基内酯对灰葡萄孢菌具有抑制作用。本研究中,7株木霉菌的发酵液对3种病原菌均有抑制作用,但木霉菌HL135对火龙果煤烟病菌的抑制率达(50.00±3.77)%,而木霉菌FJ069对火龙果煤烟病的抑制率仅为(34.78±0.00)%,表明木霉菌产生抗生次生代谢物的种类有一定的差异。
除了产生次生代谢产物外,木霉菌还可以产生一些抗病原真菌的活性挥发性物质,其中挥发性物质吡喃酮-6-戊基-2H-吡喃-2-酮(简称6PP)研究较为广泛,在多种木霉菌中被检测到。例如,Vos等[26]报道了木霉菌挥发性物质6PP对立枯丝核菌、尖孢镰刀菌和灰葡萄孢菌均具有抑制作用。另外木霉菌产生的一些挥发性小分子化合物能够诱导植物的抗性反应,例如,Martínez-Medina等[27]报道了棘孢木霉T-34和哈茨木霉T-78产生的挥发性物质能够引发拟南芥的系统性防御反应,提高对灰霉病的抗性,且能促进根部对铁离子的吸收。本研究结果显示,木霉菌产生的挥发性物质对病原菌有一定的抑制作用,其中,木霉菌SC012和木霉菌HL135的挥发性物质都显示出较强抑菌活性,表明这2株木霉菌可能产生具有抑菌活性的挥发性物质。供试木霉菌挥发性物质对病原菌的抑制率在3.49%~37.84%之间,低于对峙培养对病原菌的抑制率(57.58%~84.85%)以及发酵液对病原菌的抑制率(26.09%~77.08%),表明木霉菌产生的挥发性物质对病原菌的抑制率不高,暗示了木霉菌产生挥发性物质的主要作用不仅仅为抑菌,可能还具有诱导植物抗性等其他作用。目前对于木霉菌挥发性物质的研究不多,对于挥发性物质的成分以及作用等尚待进一步挖掘和研究。
木霉菌种类繁多,生防机制复杂[28],在生防过程中对病原菌的生防机制包括竞争作用、重寄生作用、产生抑菌物质、诱导植物产生抗性以及促进植物生长等作用,且菌株之間的生防能力也存在着较大的差异[29]。在本研究中,木霉菌HL135有较高的几丁质酶活性,且其挥发性物质、发酵液均有较强的抑菌率,但其发酵液对火龙果溃疡病菌抑制效果较差,木霉菌FJ069的几丁质酶活性最低,但其发酵液对火龙果溃疡病菌的抑制率都较其他6株木霉菌高,虽然木霉菌JX013的几丁质酶活性不高,且其对火龙果白绢病菌、火龙果溃疡病菌的抑制效果均不理想,但是其对峙培养、发酵液以及挥发性物质对火龙果煤烟病菌有着良好的抑制效果。因此,在筛选生防菌的时候,应该结合多因素筛选方法,才能够合理地筛选出针对不同病原菌、不同拮抗特点的生防菌株。针对不同木霉菌对不同病原菌的防治效果具有差异的特点,可以采用不同木霉菌复配使用,以提高对多种病原菌的综合防治效果。
参考文献
张振华, 林 江, 王文雅, 等. 火龙果溃疡病原菌拮抗菌株的筛选与生物防治效果初探[J]. 河南农业科学, 2019, 48(8): 88-94.
朱兆香. 中國产子囊座的木霉属分类研究及该属分子系统学[D]. 北京: 中国科学院大学, 2014.
彭 阁, 姜乾坤, 谭 军, 等. 烟草黑胫病拮抗真菌的筛选及活性评价[J]. 中国烟草科学, 2018, 39(1): 77-84.
李纪顺, 陈 凯, 李 玲, 等. 木霉融合子Tpf-2的定殖及其对番茄防御酶系的影响[J]. 植物保护, 2018, 44(4): 65-69, 91.
鲁海菊, 沈云玫, 陶宏征, 等. 内生木霉P3.9菌株的多功能性及其枇杷根腐病的盆栽防效[J]. 西北农业学报, 2017, 26(11): 1681-1688.
Viterbo A, Harel M, Horwitz B A, et al. Trichoderma mitogen-activated protein kinase signaling is involved in induction of plant systemic resistance[J]. Applied and Environmental Microbiology, 2005, 71(10): 6241-6246.
Jaime Monreal, Elwyn T Reese. The chitinase of Serratia marcescens. Canadian Journal of Microbiology, 1969, 15(7):689-696.
陈毓荃. 生物化学实验方法和技术[M]. 北京: 科学出版社, 2002.
王秉丽, 李广纪, 郭玉人, 等. 不同野生木霉菌拮抗作用的比较[J]. 中国生物防治学报, 2012, 28(1): 147-151.
Berger L R, Reynold D M. The chitinase system of a strain of Streptomyces griseus[J]. Biochimica et Biophysica Acta, 1958, 29(3): 522-534.
孙 虎, 杨丽荣, 全 鑫, 等. 木霉生防机制及应用的研究进展[J]. 中国农学通报, 2011, 27(3): 242-246.
夏海波, 潘好芹, 李艳青. 拮抗蔬菜土传病害木霉菌株的筛选及鉴定[J]. 北方园艺, 2017(6): 127-130.
张 健, 马佳慧, 韩蓓蓓, 等. 对桑椹菌核病病原菌有拮抗作用的木霉菌菌株筛选及生防效果试验[J]. 蚕业科学, 2015, 41(5): 825-832.
Jiang H, Zhang L, Zhang J Z, et al. Antagonistic interaction between Trichoderma asperellum and Phytophthora capsici in vitro[J]. Journal of Zhejiang University?Science B, 2016, 17(4): 271-281.
Benítez T, Rincón A M, Limón M C, et al. Biocontrol mechanisms of Trichoderma strains[J]. International Microbiology, 2004, 7(4): 249-260.
Gruber S G, Seidl-Seiboth V. Self versus non-self: Fungal cell wall degradation in Trichoderma[J]. Microbiology, 2012, 158(1): 26-34.
Sela-Buurlage M B, Ponstein A S, Bres-Vloemans S A, et al. Only specific tobacco (Nicotiana tabacum) chitinase and β-1, 3-glucanases exhibit antifungal activity[J]. Plant Physiology, 1993, 101(3): 857-863.
Lorito M. Purification, characterization, and synergistic activity of a glucan 1,3-β-glucosidase and an N-acetyl-β-glucosuminidase from Trichoderma harzianum[J]. Phytopathology, 1994, 84(4): 398-405.
Lorito M, Peterbauer C, Hayes C K, et al. Synergistic interaction between fungal cell degrading enzymes and different antifungal compounds enhances inhibition of spore germination[J]. Microbiology, 1994, 140(3): 623-629.
Lorito M, Mach R L, Sposato P, et al. Mycoparasitic interaction relieves binding of the Crel carbon catabolite repressor protein to promoter sequences of the ech42 (Endochitinase-Encoding) gene in Trichoderma harzianum[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(25): 14868-14872.
李 华. 产几丁质酶木霉菌菌株筛选及特性的研究[D]. 泰安: 山东农业大学, 2003.
José Luis Reino, Guerrero R F, Rosario Hernández-Galán, et al. Secondary metabolites from species of the biocontrol agent Trichoderma[J]. Phytochemistry Reviews, 2008, 7(1): 89-123.
陈 凯, 杨合同, 李纪顺, 等. 绿色木霉菌LTR-2孢子提取物的抑菌活性及化学成分分析[J]. 微生物学通报, 2007, 34(3): 455-458.
Liu S Y, Lo C T, Shibu M A, et al. Study on the anthraquinones separated from the cultivation of Trichoderma harzianum strain Th-R16 and their biological activity[J]. Journal of Agricultural and Food Chemistry, 2009, 57(16): 7288-7292.
Vinale F, Girona I A, Nigro M, et al. Cerinolactone, a hydroxy-lactone derivative from Trichoderma cerinum[J]. Journal of Natural Products, 2012, 75(1): 103-106.
Vos C M, de-Cremer K, Cammue B P, et al. The toolbox of Trichoderma spp. in the biocontrol of Botrytis cinerea disease[J]. Molecular Plant Pathology, 2015, 16(4): 400-412.
Martínez-Medina A, Van Wees S, Pieterse C M. Airborne signals from Trichoderma fungi stimulate iron uptake responses in roots resulting in priming of jasmonic acid-dependent defences in shoots of Arabidopsis thaliana and Solanum lycopersicum[J]. Plant Cell and Environment, 2017, 40(11): 2691-2705.
辛雅芬, 商金杰, 高克祥. 拮抗木霉菌的生防機制研究进展[J]. 东北林业大学学报, 2005, 33(4): 88-91.
Verma M, Brar S K, Tyagi R D, et al. Antagonistic fungi, Trichoderma spp.: Panoply of biological control[J]. Biochemical Engineering Journal, 2007, 37(1): 1-20.

