富含亚麻酸的膳食亚麻籽油对2型糖尿病大鼠外周血和脾脏髓源抑制细胞及炎症因子的影响①
朱丽丽 张晓霞 王 振 薛 静 汪 婷 王 浩
(宁夏医科大学基础医学院,银川 750004)
糖尿病是公认的重大健康问题[1],全球患病人数超过4.5亿[2],严重威胁人类身体健康。2型糖尿病(type 2 diabetes mellitus,T2DM)是一种由遗传和环境多种因素共同引起的以胰岛素抵抗为主、同时伴有胰岛 β 细胞功能受损的内分泌疾病[3]。临床研究显示[4],炎症因子如IL-6、IL-1β和TNF-α可激活一系列信号通路,诱发低度炎症反应,干扰正常胰岛素信号传导,引起胰岛素抵抗。其中炎症因子介导的慢性免疫炎症反应在T2DM发病机制中起着至关重要的作用[5]。
髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)是骨髓祖细胞和未成熟髓细胞组成的异质细胞群,是树突状细胞、粒细胞和巨噬细胞的前体。MDSCs在罹患癌症、炎症和感染期间增殖明显[6-8],显著抑制T细胞反应[9-11]。目前,对MDSCs不仅局限于肿瘤的研究,在慢性炎症、病毒感染和自身免疫性疾病中的研究也日益增多[12]。
除临床干预外,膳食添加剂有望成为预防和缓解糖尿病的重要手段。而亚麻籽油(flxseed oil,FO)是目前ω-3 多不饱和脂肪酸含量最高的植物油脂之一[13],含有丰富的亚麻酸(α-linolenic acid,ALA),具有包括抗炎在内的多种生物学功能的优质食用油[14]。本课题组前期研究发现,FO可以通过降低小鼠血浆中TNF-α、IL-1β、IL-6水平及调节肠道菌群来改善酒精性肝病[15]。然而,FO对T2DM大鼠MDSCs及血浆炎症因子的影响尚不清楚。在该实验中为确保摄入能量一致,采用链脲佐菌素(streptozotocin,STZ)和烟酰胺(nicotina-mide,NA)依次腹腔注射成功诱导T2DM模型[16],并用流式细胞术检测外周血和脾脏中MDSCs比例变化,用ELISA测定血浆中炎症因子表达,用Pearson方法分析MDSCs和炎症因子的相关性,初步探索FO对T2DM的作用,为FO抗炎和实际开发应用提供更多理论依据。
1 材料与方法
1.1材料 180~200 g雄性SD大鼠32只,由宁夏医科大学实验动物中心提供,许可证号:SCXK(宁)2015-0001。FO购自宁夏六盘珍坊生态农业科技有限公司,饲料由南通特罗菲饲料科技有限公司提供,血糖仪和试纸购自鱼跃公司。STZ和NA均购自Sigma公司。RPMI1640 培养基购自HyClone试剂公司。大鼠荧光抗体FITC-His48和PE-CD11b/c购自美国赛默飞世尔公司。IL-10、IL-1β和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)试剂盒购自江莱生物。大鼠外周血细胞分离试剂盒购自索莱宝公司。Cytoflex流式细胞仪是美国贝克曼库尔特有限公司产品,酶标仪是美国赛默飞世尔科技公司产品。
1.2方法
1.2.1实验分组、造模与给药 同一批次的SD雄性大鼠32只,适应性喂养1周后,随机分为正常组和造模组。造模方法如下,按参考文献[17,18],大鼠禁食不禁水12 h后,以65 mg/kg剂量腹腔注射新鲜配制的STZ溶液(现用现配,避光冰上操作),15 min后,腹腔注射110 mg/kg的 NA溶液,正常组腹腔注射等体积的柠檬酸缓冲液和生理盐水,分别于注射后第3天和第7天,尾静脉取血检测空腹血糖,两次血糖值均≥11.1 mmol/L并伴有多饮、多食、多尿症状视为T2DM造模成功。随机从正常组和糖尿病组选取8只分别作为正常组(NC)、糖尿病组(T2DM)、亚麻籽油干预对照组(NC+FO)和亚麻籽油干预组(T2DM+FO)。NC组和T2DM组脂肪主要为10%w/w玉米油,NC+FO组和T2DM+FO组是亚麻籽油等量代替玉米油,确保能量相等。
1.2.2标本采集 亚麻籽油连续干预5周后,禁食过夜,腹腔注射水合氯醛麻醉大鼠,腹主动脉采血后,将其置于含EDTA-2K抗凝管中,4℃ 2 000 r/min离心10 min,分离出血浆和血细胞。
1.2.3外周血单细胞悬液的制备 用等体积的PBS稀释大鼠新鲜血细胞,在离心管中加入和血细胞等体积的淋巴细胞分离液,将稀释后血细胞平铺于分离液上方,4℃ 2 000 r/min离心5 min后吸取白膜层,加入细胞清洗液洗涤白膜层细胞,4℃ 1 500 r/min 离心5 min后弃上清。然后加入适量红细胞裂解液,1 500 r/min离心5 min后,清洗细胞,弃上清。最后加入RPMI1640重悬细胞,调整细胞悬液浓度为2×106个/ml,供后续实验使用。
1.2.4脾脏单细胞悬液的制备 分离各组大鼠脾脏组织,将取出的脾脏放入培养皿中,加入适量RPMI1640后,分离研磨脾脏。300目滤膜过滤,4℃ 1 500 r/min离心5 min后弃上清,然后加入适量红细胞裂解液,4℃ 1 400 r/min离心8 min,弃上清,用RPMI1640清洗细胞一次,如红细胞过多,再裂解一次。RPMI1640重悬细胞,调整细胞悬液浓度为2×106个/ml,供后续实验使用。
1.2.5流式细胞仪检测MDSCs 吸取上述提取的细胞悬液各100 μl加入流式管中,分别加入1 μl 抗大鼠FITC标记的His48和PE标记的CD11b/c表面抗体,轻轻混匀,4℃避光孵育30 min后,每管加入1 ml 细胞染色缓冲液,4℃ 1 400 r/min离心5min清洗细胞,弃上清,重复洗涤细胞一次,然后用滤纸将流式管管口吸干,最后加入300 μl RPMI1640重悬细胞,立即上机检测。
1.2.6血浆中炎症因子的检测 IL-10、IL-1β和TNF-α按照江莱试剂盒说明书进行检测。

2 结果
2.1FO对T2DM大鼠外周血中MDSCs的影响 实验结果如图1所示,在NC、T2DM、NC+FO和T2DM+FO组中,外周血中MDSCs的比例分别为(3.54±1.31)%、(7.44±1.67)%、(4.41±1.32)%和(9.62±2.12)%。T2DM组大鼠外周血中MDSCs比例显著高于NC组(P<0.05);与T2DM组比较,T2DM+FO组MDSCs比例显著升高(P<0.05)。上述结果表明,FO干预T2DM大鼠可增加外周血MDSCs水平。
2.2FO对T2DM大鼠脾脏细胞中MDSC的影响 实验结果如图2所示,在大鼠脾脏细胞中,NC、T2DM、NC+FO和T2DM+FO组中MDSCs的比例分别为(3.84±1.37)%、(6.35±1.50)%、(4.10±1.33)%和(9.11±3.49)%。T2DM组大鼠脾脏细胞中MDSCs比例显著高于NC组(P<0.05);与T2DM组比较,T2DM+FO组脾脏中MDSCs比例显著升高(P<0.05)。以上结果说明,FO可明显增加T2DM大鼠脾脏细胞中MDSCs含量。
2.3FO对T2DM大鼠炎症因子表达水平的影响,与NC组比较,T2DM组大鼠血浆IL-1β和TNF-α表达水平显著升高(P<0.001);FO干预后,血浆中IL-1β和TNF-α含量显著降低,差异具有统计学意义(P<0.05)。T2DM+CO组IL-10含量低于NC+CO组,FO干预后IL-10含量升高,但差异无统计学意义(P>0.05)(图3)。
2.4各组大鼠血浆炎症因子与MDSCs相关性分析 大鼠外周血(MDSCs vs.IL-1β:r=-0.785 5,P=0.002 5;MDSC vs.TNF-α:r=-0.820 4,P=0.001 1)和脾脏(MDSCs vs.IL-1β:r=-0.822 8,P=0.001 0;MDSCs vs.TNF-α:r=-0.809 5,P=0.001 4)中MDSCs含量和大鼠血浆中IL-1β、TNF-α呈负相关(图4)。
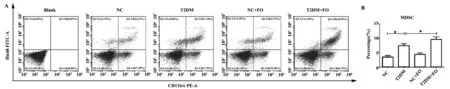
图1 流式细胞术检测FO对T2DM大鼠外周血MDSCs比例的影响Fig.1 Flow cytometry analysis of percentage of MDSCs from peripheral blood in T2DM rats after FO interventionNote:*.P<0.05.
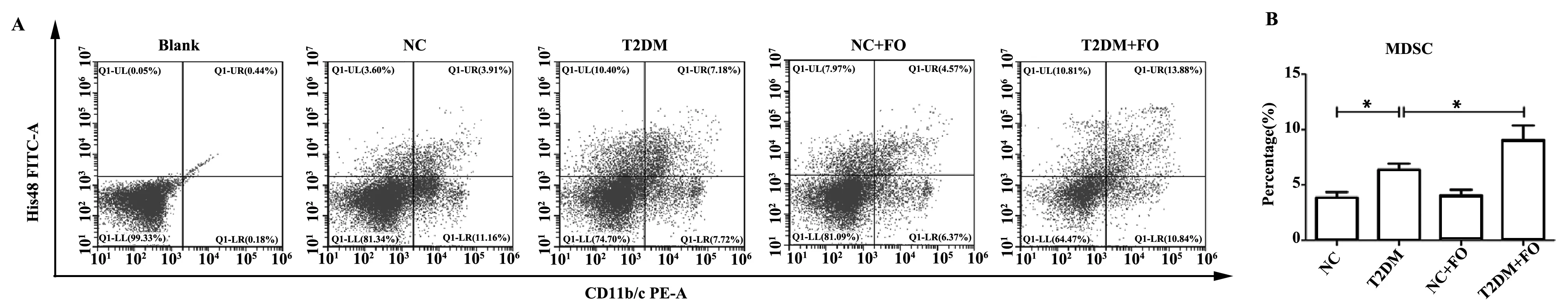
图2 流式细胞术检测FO对T2DM大鼠脾脏细胞中MDSCs比例的影响Fig.2 Flow cytometry analysis of percentage of MDSCs from spleen in T2DM rats after FO interventionNote:*.P<0.05.
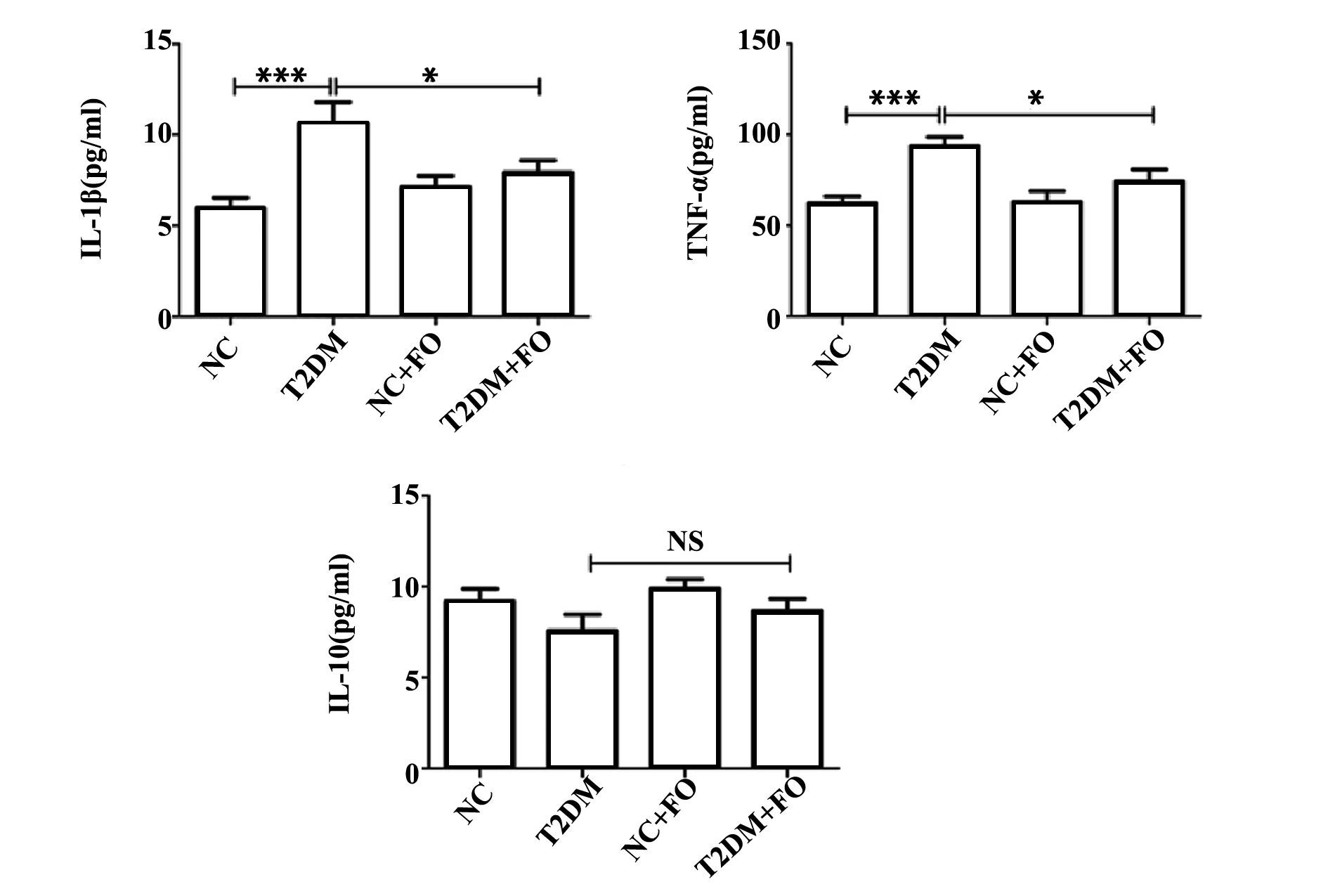
图3 ELISA检测各组大鼠血浆IL-1β、TNF-α和IL-10水平Fig.3 ELISA analysis levels of plasma IL-1β,TNF-α and IL-10 in different groupsNote:*.P<0.05,***.P<0.001.
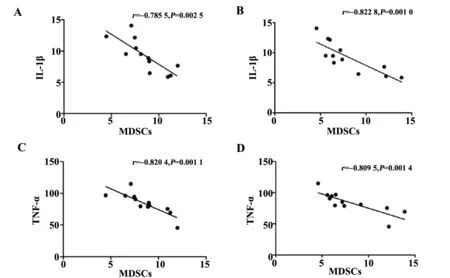
图4 炎症因子与外周血及脾脏中MDSCs相关性分析Fig.4 Correlation between inflammatory cytokines and MDSCs of peripheral blood and spleenNote:A,B.Correlation analysis between IL-1β and MDSCs in peripheral blood and spleen;C,D.Correlation between TNF-α and MDSCs in peripheral blood and spleen.
3 讨论
T2DM属于一种慢性低度炎症状态,TNF-α、IL-1β和 IL-6等促炎因子升高,抗炎因子IL-10降低[19,20],炎症因子通过调节免疫系统,从而参与T2DM的发生发展[21]。近年来研究显示,T2DM的进展与慢性低度炎症密切相关[22-26]。FO作为一种优质的食用油,富含ω-3 多不饱和脂肪酸,可阻断 NF-κB 信号通路,抑制多种炎症因子的表达,降低炎症反应[27,28]。除此之外,FO还具有抗动脉粥样硬化、降血糖、降血压、降血脂等多种作用[14,29]。
MDSCs是骨髓来源的具有免疫抑制作用的一群异质性细胞,主要包括:未成熟粒细胞、单核细胞、骨髓前体细胞和树突样细胞,在感染、炎症及肿瘤中MDSCs的数量显著增加[30,31]。有研究显示,MDSCs可以抑制促炎因子IL-1β和TNF-α的生成,促进抗炎因子IL-10的产生,发挥抑制炎症作用[32]。最近有研究发现,在T2DM患者外周血和脾脏细胞中,MDSCs比例显著增加,延缓了疾病的发生发展[33]。Yin等[34]通过动物模型研究证实,在MDSCs移植到T2DM小鼠体内后,发现转移的MDSCs具有降低血糖和预防糖尿病发作的能力。目前为止尚未确定大鼠MDSC分子标志,CD11b/c、His48是当前研究中报道最多的谱系标志[35,36],故本研究采用其作为检测标志分子。
在本研究中,通过流式细胞术分析发现,T2DM组大鼠外周血和脾脏细胞中MDSCs比例明显高于NC组;而相对于T2DM组,T2DM+FO组外周血和脾脏细胞中MDSCs比例也显著增加,说明FO能够使MDSCs在外周血和脾脏中大量增殖,抑制其向成熟的髓系细胞分化,从而发挥负向免疫调控的作用[37,38]。通过ELISA检测大鼠血浆中细胞因子,发现T2DM组血浆炎症因子IL-1β和TNF-α水平显著高于NC组,此结果提示T2DM大鼠炎症因子的表达升高,与之前的研究结果一致[19,20],这可能和胰岛素抵抗有关[39]。在FO干预后,T2DM+FO组IL-1β和TNF-α水平明显降低,说明FO可有效改善T2DM的炎症反应,可能与ALA激活GPR120和抑制TLR4下游信号通路有关[40,41],为此我们将在接下来开展相关深入研究。在本研究中,抗炎因子IL-10在T2DM组减少,在T2DM+FO组增加,但是差异没有统计学意义。分析外周血和脾脏细胞中MDSCs含量与血浆中IL-1β和TNF-α的相关性,发现MDSCs与炎症因子IL-1β和TNF-α呈负相关,可能和MDSCs抑制炎症因子的表达有关[10]。
综上所述,FO可诱导T2DM大鼠的MDSCs在外周血和脾脏细胞中募集,并且降低血浆中炎症因子IL-1β和TNF-α的含量,延缓T2DM的进展,可为T2DM的免疫抑制治疗提供新的思路。而且FO作为一种优质食用油,安全实惠,提示其对T2DM的辅助治疗具有良好应用前景。

