药食两用模式植物苦蘵基因功能研究方法的建立
康利花,蒙琪琪,俞彤苑,蔡佳玲,陈茹意,黄靖汶,阮文茹,蔡晓萱,张 弦
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
苦蘵(PhysalisangulataL.),别名灯笼果、黄姑娘、天泡子等,为茄科酸浆属草本药食两用植物,在我国广泛分布.苦蘵的果、根或全草皆可入药,具有清热利尿、解毒之功.
国内外目前对苦蘵提取物中分离得到的甾体类化合物的药理活性研究发现,酸浆苦素类(physagulin)化合物以及睡茄内酯类(withanolide)具有较高的抗肿瘤活性[1-2],结构研究亦表明酸浆苦素R(physagulin R)可能具有抗生素及抗炎药物活性,因而成为国内外研究热点[3-5].目前对苦蘵physagulin R的药性利用要求解决physagulin R合成途径基因的筛选和鉴定这一难题.
据文献报道,到目前为止已从苦蘵中总共分离得到17个酸浆苦味素类化合物.通过对其研究,可知这些化合物在生源合成中都来源于几种共同的前体,这说明其次生代谢途径具有一定的保守性,不同药用活性成分的生源合成规律和机制存在一定的共性[6-8].近期,苦蘵基因组即将测序完成,将为酸浆苦味素类化合物代谢合成途径研究提供了遗传基础.
狗尾草花叶病毒(Foxtailmosaicvirus, FoMV)属于马铃薯X病毒属,是一种单组分、单链、正义RNA病毒,基因组大小约6.2 kb,种传病毒,可广泛地侵染单双子叶植物[9].FoMV侵染单子叶植物后,仅产生较轻的症状或基本无症状,但保持了持续稳定的复制表达能力.以上特点使得FoMV成为一种优秀的病毒表达载体,可应用于单双子叶植物基因功能的研究,已有研究表明FoMV可成为一种优秀的生物反应器[10].
病毒诱导的基因沉默(virus induced gene silencing,VIGS)是通过病毒携带靶基因的片段在侵染植物后,能够诱导植物内源(靶)基因的表达沉默,可在转录水平和翻译水平抑制靶基因的表达,进而形成植物表型或生理指标上的差异,无需植物组织培养;能够在不同遗传背景下的受侵染植物上起作用,通过差异化的表型和基因型分析,能对基因功能进行更透彻的分析[11-14].烟草脆裂病毒(Tobaccorattlevirus,TRV)为双组分+ssRNA病毒(TRV1和TRV2),TRV2上有克隆外源基因的位点,侵染植物后可引起相应基因的表达沉默,是广泛运用的VIGS病毒载体[15].近年来应用 VIGS 技术进行药用植物次生代谢产物调控的研究取得诸多重要成果,如那可汀和甜菜红素的生物合成等[16].
本实验成功地在苦蘵上通过FoMV实现了外源基因绿色荧光蛋白(eGFP)的表达,以TRV病毒为载体,对苦蘵的八氢番茄红素脱氢酶(phytoenedesaturase,PDS)实现了基因沉默,验证了苦蘵上通过植物病毒系统开展基因功能研究的有效性.可以通过该方法对Physagulin R基因合成途径上候选基因的表达进行调控,再结合对合成产物的检测结果明确相关基因.
1 材料与方法
1.1 实验材料
苦蘵及本氏烟(Nicotianabenthamiana)植物种子均为本实验室保存,均生长在无虫恒温(25 ℃)温室中,光照强度8 000 Lx,并给予16 h光照/8 h黑暗日照条件.苦蘵种子储存于4 ℃保存箱进行去春化处理,经表面消毒后,用0.01 mol/L PBS浸泡3 d,待发芽出苗后移植于营养土中.至3周后于6叶期即可用于农杆菌浸润侵染实验.
1.2 克隆载体及试剂
狗尾草花叶病毒侵染性克隆(pCambia2300:FOMV,EF630359)由清华大学生命科学学院刘玉乐教授惠赠,烟草脆裂病毒(TRV)侵染性克隆(pBin19:pTRV1,AF406990;pCAMBIA1309:TRV2, AF406991)由杭州师范大学洪益国教授惠赠.peGFP质粒、农杆菌LBA4404由本实验室保存.pEASY-Blunt3克隆载体、Trans-T1感受态细胞购自北京全式金生物技术公司;质粒提取试剂盒、PCR产物纯化回收试剂盒、植物基因组提取试剂盒、植物RNA提取试剂盒购自QIAGEN;2×TaqMIX试剂盒购自康为世纪;常用化学试剂及细菌培养基均购自上海生工;限制性内切酶SpeI、HpaI及逆转录酶M-MLV反转录试剂盒购自New English Biolabs;引物合成和测序均由英潍捷基(上海)贸易有限公司完成,DNA Marker购自TaKaRa,KOD-PlusPCR扩增酶购自TOYOBO公司.
1.3 苦蘵中外源基因病毒表达载体的构建
通过生物软件DNAMAN设计eGFP ORF的扩增引物,设计含HpaI酶切位点及保护碱基的上游引物为eGFP_Hpa-F及含AscI酶切的下游引物为eGFP_ASC-R (表1).以peGFP质粒为模板,通过KOD-Plus扩增eGFP ORF片段,反应条件为:95 ℃预变性5 min,95 ℃变性18 s, 退火温度为58 ℃,退火时间为20 s,72 ℃延伸40 s,33个循环后延伸10 min,产物经1.5%的琼脂糖凝胶电泳检测,扩增片段大小无误,PCR产物使用罗氏(ROCHE)PCR回收试剂盒按说明进行纯化,再利用HpaI和AscI酶切,与同样经过酶切处理的质粒pCambia2300:FOMV连接,转化Trans-T1感受态细胞后通过引物:进行菌落PCR检测,条件与前述扩增条件相同.筛选到的阳性克隆经测序验证,引物为pFoMV-seq-F/R (表1),正确的pCambia2300:FOMV/eGFP表达质粒通过电击法转入农杆菌LBA4404.

表1 合成相关基因引物Tab.1 Related primers in this study

续表1
1.4 苦蘵八氢番茄红素脱氢酶基因(PDS)片段的RT-PCR扩增
采集3周生长期的苦蘵叶片1 g,用液氮冷冻,加入5 mm直径钢珠3颗,用组织振荡破碎仪破碎,处理条件为35 Hz/s 持续2 min破碎.利用QIAGEN的RNA试剂盒按说明进行苦蘵总RNA的提取.提取后的RNA样品溶解于50 μL RNase Free Water,用Thermo Scientific NanoDrop进行浓度测定及电泳检查.
取2 μg总RNA样品,采用全式金生物(TransGen Biotech)的TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒,按说明进行逆转录,引物为Anchored Oligo(dT)18,获得的cDNA通过核酸微量紫外分光光度计NanodropND-2000(美国ThermoScientific公司)测量反应总体系浓度后稀释至100 ng/μL,分装为10 μL/小管备用.
以苦蘵cDNA为模板,PCR扩增目的基因PDS的部分401 bp片段,使用引物为含HpaI酶切位点KZ_PDS 401 Seq-F/含SpeI酶切位点的KZ_PDS 401 Seq-R (表1),反应条件为:94 ℃预变性5 min,94 ℃变性18 s,退火温度为52 ℃,退火时间为20 s,72 ℃延伸30 s,33个循环后延伸10 min,产物经1.5%的琼脂糖凝胶电泳后,扩增片段大小无误,PCR产物使用罗氏(ROCHE)PCR回收试剂盒按说明进行纯化留用.
1.5 PDS基因片段的酶切及连接至pCAMBIA1309:TRV2载体
PDS基因的PCR片段及VIGS载体pCAMBIA1309:TRV2分别用HpaI和SpeI双酶切后,分别回收目的片段和载体进行连接,重组质粒通过化学法转化至全式金生物的Trans1-T1 抗噬菌体感受态细胞中,pTRV2-F/-R为引物(表1),用菌落PCR筛选重组质粒.重组质粒取3个送赛默飞生物(苏州)公司测序验证,正确的重组质粒pCAMBIA1309:TRV2/PDSi通过电击法转入农杆菌LBA4404,并通过pTRV2克隆构建引物pTRV1-F/R进行PCR验证.
1.6 含目的靶基因的农杆菌培养及浸润接种
将含有目的靶基因的VIGS载体的农杆菌接种到含卡那霉素及链霉素抗性的YEP培养基中,28 ℃,200 r/min过夜培养.用4 000 r/min,离心15 min收集菌体,用无菌的0.01 MPBS重悬,调菌液至OD600为1.0左右,加入终浓度为0.01 mmol/L乙酰丁香酮以增强农杆菌侵染效率.用1 mL无菌注射器将菌液注射到6叶期的苦蘵叶片中,注射后在第7、10、14、21天进行症状的观察,并使用Sony照相机进行拍照及样品的采集.
1.7 苦蘵种子萌发阶段的农杆菌侵染实验
将30颗苦蘵种子涂布在预先浸湿的无菌9 cm Waterman滤纸上,置于直径10 cm培养皿内.保持在25 ℃的生长室中,同时保持光照.在这样的条件下2 d后,种子开始破坏它们的外衣并发芽.在此阶段,收集种子于50 mL离心管中,与5 mL OD600为0.5的农杆菌悬浮混合.使用真空泵保持0.085 MPa的负压,来实现农杆菌渗滤种子10 min.然后将农杆菌渗入的种子转移到营养土中,保持黑暗24 h,然后置于25 ℃下16 h光照/ 8 h黑暗的无昆虫生长室中培养,定期检查局部和全身感染的发展,并进行照相记录.
1.8 外源基因表达的观察及检测
为了检测来自FoMV/eGFP的绿色荧光蛋白的表达,在苦蘵叶子接种农杆菌浸润接种10 d后收集系统新长出的幼叶,并在Nikon A1共聚焦显微镜下检查绿色荧光.根据制造商的使用说明,设定450~490 nm激发和520 nm发射的条件以激发GFP并监测绿色荧光的发射,同时在明视野下拍摄苦蘵的表皮叶肉细胞,使用Nikon A1软件处理共聚焦图像,拼合不同信号通道的图片.
1.9 样品的分子生物学分析及RT-PCR定量检测
收集的苦蘵及本氏烟叶片,根据制造商的说明书,使用RNAprep Pure Plant Kit(TIANGEN)从苦蘵叶组织中提取总RNA,使用FastQuant RT试剂盒(TIANGEN),通过M-MLV逆转录酶从经DNase I处理的总RNA(2 μg)合成第一链cDNA,通过RT-PCR用特异引物检测过表达系统中FoMV的侵染及eGFP的转录;引物pTRV1-F/R来检测VIGS系统中TRV的侵染.利用CFX96荧光定量PCR仪(Bio-Rad,USA)对相关靶基因进行表达量的检测,使用引物为:以KZ.GAPDH和18S作为内参,PDS基因的定量引物qRT_PDS-F/R(表1),10 μL反应体系包含2×UltraSYBRMIXER 5 μL,cDNA 1 μL(100 ng),以及相应基因的上下游引物各0.5 μL,每个反应包含4个平行重复,以溶解曲线检查产物扩增的特异性,使用相对定量法计算VIGS靶基因的相对表达量.
2 结果与分析
本实验通过FoMV构建外源基因表达的病毒载体,实验设计如图1a所示,增强型绿色荧光蛋白(eGFP)的ORF为720 bp,目前作为一种报告基因来研究基因表达、调控,我们使用eGFP表达作为技术体系的阳性对照.通过PCR获得了eGFP的编码序列,对纯化的PCR样品和表达载体我们进行了酶切和连接,通过PCR的方法筛选了阳性的克隆,其电泳结果(图1b)显示插入片段条带大小约为900 bp(CP启动子170 bp+eGFP720 bp,使用引物为pFoMV-seq-F/eGFP_Asc-R)和线性化的载体大小均符合预期.将两者连接转化大肠杆菌,经测序验证我们的阳性克隆含有目的插入片段.通过农杆菌浸润接种6叶龄的苦蘵,7 d后通过尼康共聚焦显微镜对新生的苦蘵系统叶片进行了观察,显示在其中均匀存在绿色荧光信号(图1c),这一结果说明FoMV/GFP已经实现了整株植物的侵染,其携带的GFP蛋白实现了表达.作为一种潜病毒可以持续稳定地表达外源或内源基因,体现出相应的基因功能,这是本技术平台的优势.
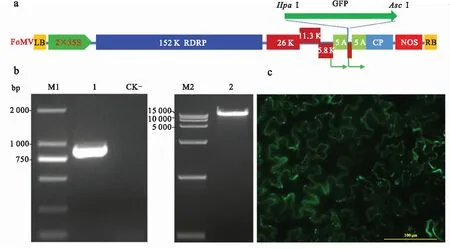
a.FoMV病毒表达载体的示意图,通过农杆菌将含有病毒全长序列的片段插入植物基因组,然后通过花椰菜花叶病毒的35S启动子转录为全长的RNA病毒,外源片段通过病毒的外壳蛋白(CP)的启动子进行转录翻译.b.eGFP片段的PCR电泳结果(CP启动子170 bp+eGFP720 bp)及FoMV/eGFP质粒的线性化片段电泳结果.c.FoMV/eGFP接种苦蘵7 d后在系统新叶上观察到的GFP荧光.
图1 基于FoMV在苦蘵中的GFP表达
Fig.1 FoMV-based eGFP expression inPhysalisperuviana

a.基于烟草脆裂病毒的基因沉默载体构建示意图,TRV为双组分+ssRNA病毒(TRV1和TRV2),TRV2上有克隆外源沉默基因的位点.b.PDS基因部分片段401 bp和线性化的pTRV2的电泳结果.c.PDS的沉默载体转化农杆菌后接种 6 叶龄的苦蘵,2 周后可以观察到新生的系统叶上出现褪绿变白的表型.
图2 基于烟草脆裂病毒VIGS技术的苦蘵功能研究技术
Fig.2 TRV-based VIGS system and the syptom ofPDSionPhysalisL.
基于烟草脆裂病毒(Tobaccorattlevirus, TRV)的VIGS载体体系可以克服寄主分生组织障碍的局限性,可以有力地蔓延整个植物组织,包括分生组织,而且侵染的症状与其他病毒相比更加轻微.在药食两用植物的基因功能研究中尚未见报道.因此,我们建立了基于TRV的苦蘵基因表达抑制载体.其载体设计如图2a所示,TRV2携带有目的片段.
提取的苦蘵总RNA,经过逆转录为cDNA后,通过PCR扩增出PDS基因的401 bp部分片段,经酶切连接插入pTRV2(图2b),经测序验证我们的沉默载体构建正确,同样转化农杆菌后接种6叶龄的苦蘵,2周后可以观察到新生的系统叶上出现褪绿变白的表型,这显示了PDS的合成受到了破坏,我们成功构建了基于TRV的苦蘵VIGS技术平台.
由于接种6叶龄的苦蘵出现VIGS表型的时间在两周后,周期较长,因此,我们对该体系的适用性进行了进一步优化,即对种子萌发阶段的苦蘵进行了农杆菌的浸润接种.结果显示经处理后,萌发2 d(图3a)苦蘵子叶上即出现了PDS基因沉默的表型,TRV病毒的持续侵染,使得PDS的沉默表型在4、6、8、10、14、21 d(图3b-f)均能持续实现和保持其基因沉默的表型.在接种2月后,苦蘵进入花期(图3g)及坐果期(图3h),其成熟果实的外萼上同样出现PDS沉默的表型,对于有褪绿表型的样品,我们进行了采样和定量分析.PDS基因在萼片、叶片、果肉中的表达仅为野生型中的4.36%、5.97%和4.98%(图4).这说明基于TRV2的VIGS的基因表达沉默效率很高,且各花器官中的沉默水平稳定,以上结果显示我们的实验设计合理,能够实现靶基因的表达干扰.

a.萌发后2 d;b.萌发后4 d; c.萌发后6 d; d.萌发后8 d; e.萌发后14 d; f.萌发后21 d; g.花期;h.坐果期.

图4 通过VIGS技术使不同器官的PDS表达受到抑制Fig.4 The inhibited expression of PDS of different organs
基因功能的阐释,离不开“一正一反”的Gain/Loss of function的过程分析.本研究中利用潜病毒狗尾草花叶病毒构建了基因过表达系统,成功地在苦蘵上实现了外源基因GFP的表达,绿色荧光蛋白的表达稳定,在系统新叶中稳定而明亮,进而可以利用实现苦蘵内源基因的表达,可以实现某未知功能基因的超表达,从而获得某一次生代谢物合成上的变化或外观性状的变化.而与此对应的是基于TRV的基因沉默技术,可以通过针对未知的基因设计特定的序列结构,通过病毒的接种后,在苦蘵的萌发期、幼苗期、成苗期、坐果期不同生长阶段均能实现靶基因的转录mRNA的特异性降解,抑制效果显著且持久,通过病毒介导的基因超表达及基因表达抑制技术可实现苦蘵功能基因的差异表达,表型可以通过性状观察或次生代谢物含量的检测分析得以明确,通过本方法可对药食两用植物苦蘵的重要基因进行功能研究.

