黑果腺肋花楸果汁的酶解制备工艺优化及其功能性质
徐 杰,李新光,王建中,王丰俊
(北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
黑果腺肋花楸(Aroniamelanocarpa),又称不老莓、野樱莓等,是一种原产于北美的小型浆果[1],其果实不仅含有丰富的原花青素、花色苷等多酚类物质,还含有大量的有机酸、碳水化合物、维生素和矿物元素等[2-3],这些生物活性成分的存在使黑果腺肋花楸具有较强的抗氧化活性和潜在的药用价值[4-6]。2018年9月,中国国家卫生健康委员会确定黑果腺肋花楸果可作为新食品原料食用[7],这为其产品的开发提供了依据。
黑果腺肋花楸果实含有丰富的纤维素和果胶,使其具有较低的出汁率,原花青素等营养成分析出不完全。因此提高出汁率和保留较多的生物活性成分是该果实利用的关键问题[8]。果汁的制备方法有多种,如压榨法、水浴法、离心法、酶解法、超声波辅助法等[9-10],其中酶解法处理条件温和,果实营养素损失小,可以有效地提高果实的出汁率和果汁稳定性,具有低成本、高度专一、无有机残留等优点[11]。马艳弘[12]等使用果胶酶和纤维素酶复合酶解无花果,在最优条件下出汁率为 75.13%,汁中多酚含量高达 626.79 μg/mL。目前,我国对黑果腺肋花楸的研究主要集中在植株栽培技术的改进和果实营养成分的分析,但对于相关产品如果汁的研究尚浅,缺少酶解制汁工艺和其果汁功能性质方面的研究[13]。
本文旨在针对黑果腺肋花楸果实果胶含量高、取汁困难的特点,使用果胶酶与纤维素酶的复合酶进行酶解实验,以果实的出汁率和原花青素含量为指标,对酶解效果进行比较。在单因素实验的基础上,通过设计响应面试验优化确定果汁的最佳酶解制备条件;同时测定果汁对DPPH自由基的清除效果以及对α-淀粉酶、酪氨酸酶和黄嘌呤氧化酶的抑制作用来评价其功能性质,以期为黑果腺肋花楸食品的研究及保健产品的开发提供参考。
1 材料与方法
1.1 材料与仪器
黑果腺肋花楸果实 采摘自辽宁黑果腺肋花楸繁育基地,于-18 ℃低温条件下冻藏备用;果胶酶(40 U/mg)、纤维素酶(30 U/mg) 泰兴一鸣生物制品有限公司;原花青素标准品(UV≥95%) 购自上海源叶生物科技有限公司;亚硫酸钾、邻苯二酚、香草醛、无水甲醇、氯化钾、醋酸钠、磷酸二氢钠、磷酸氢二钠 均为分析纯 西陇化工股份有限公司;α-淀粉酶、酪氨酸酶、黄嘌呤氧化酶、1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司。
LK-200B打浆机 北京鑫骉仪器;HW-SY11-K电热恒温水浴锅 北京长风仪器仪表公司;SCIENTZ-12冷冻干燥机 宁波新芝生物科技股份有限公司;T6紫外分光光度计 北京普析通用仪器有限公司;HC-2518R高速冷冻离心机 安徽中科中佳科学仪器有限公司;ST-360酶标仪 上海科华实验系统有限公司;SJ-3FpH计 上海泸西分析仪器。
1.2 实验方法
1.2.1 黑果腺肋花楸果汁制备 挑选颗粒饱满的黑果腺肋花楸果实,去梗、清洗,经蒸汽热烫2 min预处理后,破碎打浆,得到花楸果浆。向其中添加一定量的纤维素酶和果胶酶,充分搅拌,酶解后于 90 ℃水浴条件下灭酶5 min,待冷却至室温后于4000 r/min离心20 min,得到澄清的黑果腺肋花楸果汁备用。
1.2.2 单因素实验设计
1.2.2.1 复合酶比例对酶解效果的影响 控制加酶量0.05%,酶解温度45 ℃,酶解时间3.5 h,考察复合酶(果胶酶∶纤维素酶)质量比(2∶5、3∶5、4∶5、5∶5、6∶5)对出汁率和果汁原花青素含量的影响。
1.2.2.2 加酶量对酶解效果的影响 控制复合酶质量比为4∶5,酶解温度45 ℃,酶解时间3.5 h,考察加酶量(0.000%、0.025%、0.050%、0.075%和0.100%)对出汁率和果汁原花青素含量的影响。
1.2.2.3 酶解温度对酶解效果的影响 控制复合酶比例为4∶5,加酶量0.05%,酶解时间3.5 h,考察酶解温度(35、40、45、50和55 ℃)对出汁率和果汁原花青素含量的影响。
1.2.2.4 酶解时间对酶解效果的影响 控制复合酶质量比为4∶5,加酶量0.05%,酶解温度45 ℃,考察酶解时间(2.5、3.0、3.5、4.0和4.5 h)对出汁率和果汁原花青素含量的影响。
1.2.3 响应面优化试验 在单因素实验的基础上,以果汁原花青素含量为考察指标,复合酶(果胶酶∶纤维素酶)质量比、加酶量、酶解时间和酶解温度为实验变量,进行响应面优化实验[14],实验因素和水平见表1。
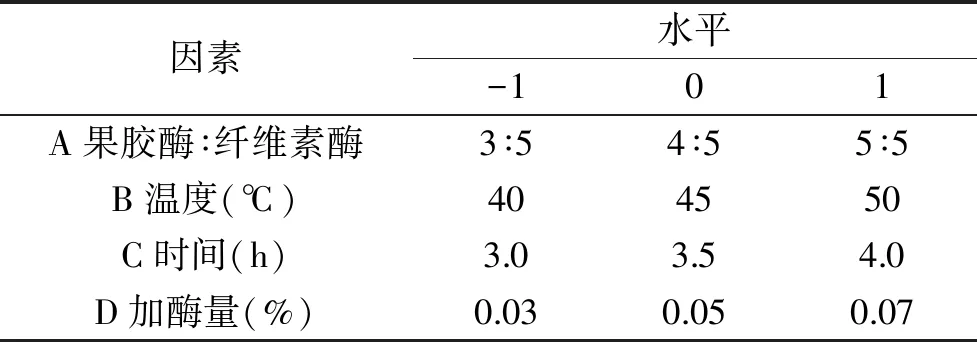
表1 响应面试验因素与水平表Table 1 Factors and levelsTable of response surface methodology
1.2.4 出汁率测定 称量花楸果浆质量和离心后的澄清果汁质量,按照式(1)计算出汁率。

式(1)
1.2.5 原花青素含量的测定
1.2.5.1 标准曲线的制作 准确吸取不同浓度(0、80、160、240、320和400 μg/mL)的原花青素标准溶液1 mL,分别加入A(1%的香草醛甲醇溶液)、B(4%的盐酸-甲醇溶液)显色剂各2.5 mL,涡旋混匀,30 ℃水浴0.5 h,冷却,于500 nm处测其吸光值,绘制原花青素标准曲线[15]。其线性回归方程为:y=1.0986x+0.001(R2=0.9995)。
1.2.5.2 果汁中原花青素含量的测定 准确吸取1 mL果汁于试管中,分别加入A(1%的香草醛甲醇溶液)、B(4%的盐酸-甲醇溶液)显色剂各2.5 mL,涡旋混匀,30 ℃水浴0.5 h,冷却,测定波长500 nm处的吸光值。以吸光值为Y值,根据标准曲线计算果汁中原花青素的含量。原花青素含量计算公式如式(2)。
式(2)
式中:C为原花青素标准溶液浓度,mg/mL;V为果汁体积,mL;N为稀释倍数;M为黑果腺肋花楸果实质量,g。
1.2.6 黑果腺肋花楸酶解果汁功能性质测定
1.2.6.1 DPPH自由基清除率的测定 用去离子水将冻干后的黑果腺肋花楸果汁以及抗坏血酸配制成浓度分别为 0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的样品溶液。在具塞试管中依次加入1.5 mL不同浓度的样品溶液、蒸馏水和 0.2 mmol/L DPPH无水乙醇溶液。混匀后于室温下避光反应20 min,测定517 nm波长吸光值A1;无水乙醇溶液代替 DPPH无水乙醇溶液,测定吸光值A2;蒸馏水代替样品,测定吸光值A0;以等体积的蒸馏水和无水乙醇混合液进行空白调零实验[16]。DPPH自由基清除率的计算公式如式(3)。
式(3)
式中,A1为DPPH溶液+样品溶液吸光值;A2为样品溶液+无水乙醇吸光值;A0为DPPH溶液+蒸馏水吸光值。
1.2.6.2α-淀粉酶活性抑制的测定 用去离子水将冻干后的黑果腺肋花楸果汁和阿卡波糖配制成浓度分别为 1.0、2.0、3.0、4.0、5.0、6.0 mg/mL的样品溶液。在具塞试管中按照表2依次加入试剂,于37 ℃水浴30 min,加入2 mL DNS溶液后沸水浴10 min,冷却至室温,取出0.5 mL反应液加入4.5 mL蒸馏水,混合均匀,于540 nm测其吸光值[17]。α-淀粉酶抑制率计算公式如式(4)所示。

式(4)
式中,A0为样品管的吸光度值;A1为对照管1的吸光度值;A2为对照管2吸光度值。
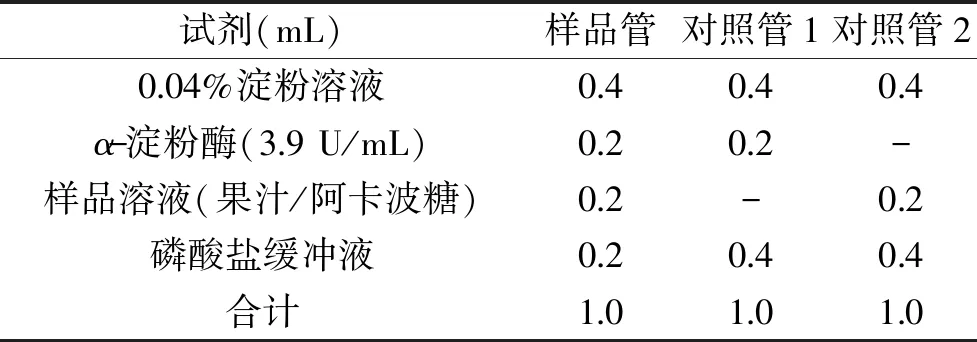
表2 实验操作表Table 2 Experimental operation table
1.2.6.3 酪氨酸酶活性抑制的测定 分别称取适量的左旋多巴(L-DOPA)和酪氨酸酶溶于磷酸盐缓冲液(0.2 mol/L,pH6.8)中,配制成1.0 mg/mL的L-DOPA和150 U/mL的酪氨酸酶溶液。将冻干后的果汁配制成浓度为10、20、30、40、50、60 mg/mL的样品溶液。抗坏血酸作为阳性对照物,配制成相应浓度进行实验[18],酪氨酸酶活性抑制测定方法如表3。

表3 实验操作表Table 3 Experimental operation table
30 ℃水浴反应10 min后,加入0.2 mL酪氨酸酶溶液,混合均匀,静置1 min,在475 nm波长下测定其吸光值。酪氨酸酶抑制率计算公式如式(5)所示。
式(5)
式中:A1、A2、A3、A4分别代表表中1、2、3、4反应体系的吸光度值。
1.2.6.4 黄嘌呤氧化酶活性抑制的测定 分别称取适量的黄嘌呤氧化酶和黄嘌呤溶于磷酸盐缓冲液(0.07 mol/L,pH7.5)中,配制成0.1 U/mL的黄嘌呤氧化酶溶液和150 μmol/mL的黄嘌呤溶液。将冻干后的果汁配制成浓度为 10、20、30、40、50、60 mg/mL的样品溶液。采用别嘌呤醇作为阳性对照物,配制成相应浓度进行试验。向酶标板孔中准确加入60 μL磷酸盐缓冲液,50 μL样品溶液,50 μL黄嘌呤氧化酶溶液,平行振荡酶标板,25 ℃反应15 min,加入60 μL黄嘌呤,混合均匀[19],静置5 min后于295 nm波长下测定其吸光值A2。以等量的90%乙醇代替样品溶液作为对照组(A1),以等量的磷酸盐缓冲液代替酶溶液作为样品空白组(A3),以90%的乙醇和磷酸盐缓冲液分别代替样品溶液和酶液作为空白组(A0)。黄嘌呤氧化酶抑制率计算公式如式(6)
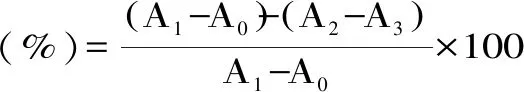
式(6)
式中:A1为对照组的吸光值;A0为空白组的吸光值;A3为样品空白组的吸光值;A2为实验组的吸光值。
1.3 数据处理
所有实验均至少测定3次,选取平均值。采用Microsoft Excel 2013、Design-Expert 8.0和SPSS Statistics 22.0软件对数据进行整理分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 复合酶(果胶酶∶纤维素酶)比例对酶解效果的影响 由图1可知,复合酶比例处于2∶5~4∶5之间时,出汁率和果汁原花青素含量均显著提高(P<0.05),当复合酶质量比为4∶5时,出汁率最高达76.11%。超过这一比例后,果实出汁率和原花青素含量有所下降,可能是因为纤维素酶添加量的减少导致黑果腺肋花楸果实细胞壁中纤维素降解不完全,细胞组织没有完全软化,细胞液化不彻底[20],这也不利于原花青素的溶出,导致其含量有所降低。

图1 复合酶比例对出汁率和果汁原花青素含量的影响Fig.1 Effect of compound enzyme ratio on juice yield and proanthocyanidin content in the juice注:同一指标标记不同字母表示 差异显著(P<0.05);图2~图4同。
2.1.2 加酶量对酶解效果的影响 由图2可知,随着加酶量的增加,黑果腺肋花楸出汁率和原花青素的含量显著提高(P<0.05),当加酶量大于0.050%时,黑果腺肋花楸果实中的可溶性固形物基本完全溶出,出汁率无明显变化(P>0.05)。酶的浓度过高会使果胶酶和纤维素酶颗粒在果浆中达到饱和而凝结,果浆通道被堵塞,使得黑果腺肋花楸果汁的提取更加困难[21]。同时,当加酶量超过最佳值后,加酶量继续增加,果汁中原花青素的溶出变化也不再显著,这是因为酶与底物接触面积过剩,继续添加也将造成酶制剂的浪费。综合考虑选择复合酶的加酶量为0.050%。
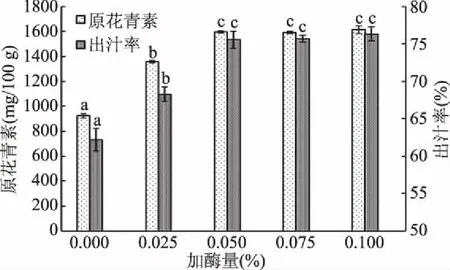
图2 加酶量对出汁率和果汁原花青素含量的影响Fig.2 Effect of enzyme amount on juice yield and proanthocyanidin content in the juice
2.1.3 温度对酶解效果的影响 随着温度的增加,黑果腺肋花楸果实出汁率和果汁原花青素含量均呈现出先增加后下降的趋势。45 ℃时,出汁率最高为74.54%,原花青素的含量也达到最大值,与其它酶解温度的效果具有显著差异(P<0.05)。这是因为生物酶的活性具有最适宜的温度,同时适当提高温度可以使细胞壁的渗透性增强并增加酶作用底物的分子热能,从而获得更高的出汁率,更利于原花青素等生物活性成分从果肉细胞组织中溶出。

图3 酶解温度对出汁率和果汁原花青素含量的影响Fig.3 Effect of enzymolysis temperature on juice yield and proanthocyanidin content of the juice
2.1.4 酶解时间对酶解效果的影响 由图4可知,在2.5~3.5 h之间,出汁率和原花青素含量增加幅度较大,且不同酶解时间的指标之间具有显著性差异(P<0.05)。当酶解时间为3.5 h时,酶解效果的各项指标达到最大值。随后,出汁率基本不再提高,而原花青素含量有所下降,这可能是因为随着酶解时间的延长,部分原花青素发生了氧化。

图4 酶解时间对出汁率和果汁原花青素含量的影响Fig.4 Effect of enzymolysis time on juice yield and proanthocyanidin content in the juice
2.2 响应面分析法优化结果及分析
2.2.1 回归模型建立与显著性分析 依据单因素的实验结果,选取复合酶(果胶酶∶纤维素酶)比例、加酶量、酶解温度、酶解时间为试验因素,以果汁中原花青素含量为响应面值,确定黑果腺肋花楸果汁酶解制备的最佳条件。响应面试验结果见表4。

表4 响应面试验设计及结果Table 4 Design and results of response surface methodology

表5 原花青素含量的回归方程方差分析表Table 5 Regression equation variance analysisTable for proanthocyanidin content
注:*代表P<0.05显著水平,**代表P<0.01极显著水平。
运用Design Expert 8.0软件对酶解响应面实验得到的数据进行回归分析,得到果汁中原花青素含量的二次多项回归模型为:
Y=1676.07-21.54A-9.19B+39.38C+113.05D-149.42AB-68.18AC-29.93AD+136.96BC-44.22BD+0.38CD-144.82A2-205.14B2-220.71C2-286.56D2
对得到的回归方程进行方差分析,分析结果如表5。
如表5所示,原花青素含量的回归方程的拟合度达到了极显著水平(P<0.0001);失拟项不显著,拟合的模型方程效果较好,实验受其他外来因素的影响较小,该模型成立有效[22]。模型中A影响显著(P<0.05),C、D的影响达到了极显著的水平(P<0.01),各因素对花楸汁中原花青素含量的影响程度由大到小依次为:加酶量(D)>酶解时间(C)>果胶酶:纤维素酶(A)>酶解温度(B);交互项BD的影响显著(P<0.05),AB、AC、BC的影响达到了极显著的水平(P<0.01),这表明酶解温度与加酶量、果胶酶∶纤维素酶比例与酶解温度、果胶酶∶纤维素酶比例与酶解时间、温度与酶解时间对花楸果汁中原花青素含量均具有交互作用。二次项A2、B2、C2、D2的影响极显著(P<0.01)。
2.2.2 响应面分析及优化 根据回归模型,将其中的任两个水平固定在零水平,得到另外的两个因素的交互作用的响应面图以及其对应的等高线图,这反映了各个因素的交互作用对花楸果汁原花青素含量的影响。各个因素的交互作用见图5。
响应面图的陡峭程度可以反映出两个因素交互作用的强弱。对比各响应面图可知,AB(果胶酶∶纤维素酶-酶解温度)、BC(酶解温度-酶解时间)的交互作用最为明显,即对果汁汁中原花青素含量的影响最大;AC(果胶酶∶纤维素酶-酶解时间)的交互作用次之;而BD(酶解温度-加酶量)曲线相对比较平缓,交互作用较弱。对回归方程进行分析,得到黑果腺肋花楸果汁中原花青素含量的最优酶解制备工艺条件为:果胶酶∶纤维素酶比例为3.85∶5,酶解温度45.28 ℃,酶解时间3.57 h,加酶量0.06%,此条件下花楸果汁中原花青素含量的预测值为1691.42 mg/100 g。根据实际情况对酶解的工艺条件进行修正为果胶酶∶纤维素酶4∶5,酶解温度45 ℃,酶解时间3.5 h,加酶量0.06%,在此条件下进行重复验证实验,得到果汁中原花青素含量为(1679.85±6.11) mg/100 g,与理论预测值的相对误差为0.684%;同时在此条件下测得黑果腺肋花楸果实出汁率为78.65%±1.05%。
2.3 黑果腺类花楸果汁功能性质分析
2.3.1 加酶与无酶处理果汁的DPPH自由基清除率 由图6可知,加酶处理和无酶处理制备的黑果腺肋花楸果汁均有较强的DPPH·清除能力,且随着浓度的增加清除能力增强。加酶处理的果汁清除DPPH·的能力优于不加酶处理的果汁,其半数抑制浓度为0.232 mg/mL,这是因为酶制剂的使用破坏了细胞结构,释放出更多的原花青素等抗氧化物质。浓度大于0.4 mg/mL时,清除率增长速度减缓,即抗氧化活性成分与DPPH的电子结合接近饱和。当浓度为0.5 mg/mL时,使用复合酶酶解的果汁(68.16%)的清除能力大于抗坏血酸(65.13%)。
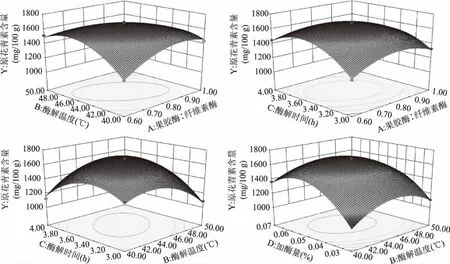
图5 各因素对果汁中原花青素含量的影响的响应面图Fig.5 Response surface plots for the effects of various factors on on proanthocyanidin content in the juice

图6 黑果腺肋花楸果汁浓度 对DPPH自由基清除能力的影响Fig.6 Effect of Aronia melancarpa juice concentration on DPPH free radical scavenging ability
2.3.2 加酶与无酶处理果汁对α-淀粉酶活性的抑制效果α-淀粉酶抑制剂可以阻断淀粉等转变成寡糖和糊精的过程,最终达到降低血糖的目的[23]。
由图7可知,两种不同处理下制得的黑果腺肋花楸果汁均有较强的α-淀粉酶抑制能力,并且随着浓度的增加抑制能力有所增强(P<0.05),但低于阿卡波糖(一线降血糖药物)的抑制能力。在等浓度下,加酶处理的果汁α-淀粉酶的抑制率始终高于无酶处理的果汁,且其半数抑制浓度仅为2.326 mg/mL,这是因为加入复合酶后,细胞破壁,促进了抑酶因子的释放。这些活性成分可与α-淀粉酶活性中心部位结合[24],抑制其活性的发挥,阻碍双糖的降解,有效地控制餐后血糖的含量。

图7 黑果腺肋花楸果汁浓度对α-淀粉酶活性的影响Fig.7 Effect of Aronia melancarpa juice concentration on activity of α-amylase
2.3.3 加酶与无酶处理果汁对酪氨酸酶活性的抑制效果 酪氨酸酶抑制剂具有抑制酪氨酸酶活性的功效,进而减少黑色素的合成[25]。
以L-多巴为底物,通过酪氨酸酶的催化反应,测定黑果腺肋花楸果汁的酪氨酸酶活性抑制率。由图8可知,随着浓度的增加,黑果腺肋花楸果汁对酪氨酸酶抑制能力显著增强(P<0.05),但低于等浓度抗坏血酸标准品。研究表明,从天然植物中提取得到的类黄酮具有极高的酪氨酸酶抑制能力,且无安全隐患[26]。黑果腺肋花楸果汁中含有丰富的原花青素等类黄酮成分,具有抑制酪氨酸酶活性的功效。加酶处理的果汁抑制能力(IC50=22.587 mg/mL)始终高于无酶处理的果汁(IC50=61.450 mg/mL),即复合酶酶解使果汁的抑制能力增强。
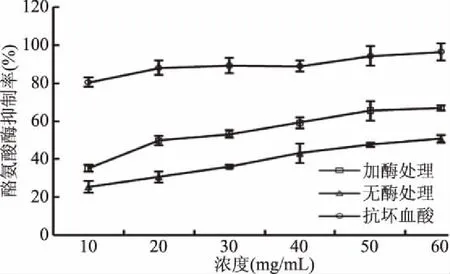
图8 黑果腺肋花楸果汁对酪氨酸酶活性的影响Fig.8 Effect of Aronia melancarpa juice concentration on activity of tyrosinase
2.3.4 加酶与无酶处理果汁对黄嘌呤氧化酶活性的抑制效果 黄嘌呤氧化酶抑制剂可以有效的抑制黄嘌呤氧化酶活性,减少尿酸的生成,降低高尿酸血症和痛风的发病率[27]。
由图9可知,随着浓度的增加,不同处理方式下制备的黑果腺肋花楸果汁对黄嘌呤氧化酶的抑制能力逐渐提高,且具有显著性差异(P<0.05)。加酶处理制备的果汁黄嘌呤氧化酶抑制能力的IC50值为30.722 mg/mL,无酶处理的果汁IC50值为51.549 mg/mL,这说明酶处理使果汁对黄嘌呤氧化酶的抑制能力增强。在加酶处理果汁浓度为30 mg/mL时,其对黄嘌呤氧化酶活性的抑制率(50.11%)与等浓度的别嘌呤醇标准品(53.27%)差异不显著,可以作为辅助降尿酸的功能食品。

图9 黑果腺肋花楸果汁对黄嘌呤氧化酶活性的影响Fig.9 Effect of Aronia melancarpa juice concentration on activity of xanthine oxidase
3 结论
采用复合酶酶解法制备黑果腺肋花楸果汁,并通过单因素试验及建立响应面模型优化得到了黑果腺肋花楸果汁酶解制备的最佳工艺参数即果胶酶∶纤维素酶为4∶5,温度45 ℃,时间3.5 h,加酶量0.06%,在此条件下,果汁中原花青素含量为(1679.85±6.11) mg/100 g,果实出汁率为78.65%±1.05%。
黑果腺肋花楸果汁具有较强的DPPH自由基清除能力,同时对α-淀粉酶、酪氨酸酶和黄嘌呤氧化酶均表现出较强的抑制能力,复合酶酶解使果汁中活性成分含量显著提高,从而加强了酶解型果汁的功能效果。这些研究结果表明黑果腺肋花楸果汁可能具有抗氧化、控制餐后血糖、祛斑美白和防治痛风的功效,本文为黑果腺肋花楸果汁成为功能性食品的开发利用提供了一定的理论依据。

