双源CT测量心周脂肪体积联合血尿酸、同型半胱氨酸监测对冠心病早期诊断的价值分析
1.江苏省泰兴市第三人民医院CT室(江苏 泰兴 225400)
2.江苏省泰兴市人民医院CT室(江苏 泰兴 225400)
肖日国1 许晓杰2
冠心病(Coronary Heart Disease,CHD)是指冠状动脉粥样硬化导致心肌缺血、缺氧而引起的心脏病[1],以中老年人、吸烟者、高血压患者、糖尿病患者、肥胖者多发,临床表现为突发心前区疼痛,多为发作性绞痛或压榨痛,近年来,其发病率逐年呈上升趋势,严重威胁患者生命安全。且部分患者无明显症状,极易错过治疗最佳时期,从而导致不良后果。因此,早发现、早诊断对预后至关重要[2]。研究证实[3],心周脂肪会分泌多种促炎因子,与动脉粥样硬化的发展有着密切联系;另外,Geltler提出UA与CDH关系密切,今年来相关研究表明[4],血清HCY、UA水平呈高表达可增强炎症反应,从而促进血栓形成,是CHD的独立危险因素。然而目前关于者三者与冠心病的相关性综合性报道罕见,本研究主要探讨双源CT测量PAT联合UA、HCY监测对冠心病CHD早期诊断的价值,现报告如下。
1 资料与方法
1.1 一般资料 选取2016年5月-2018年5月我院收治的经冠状动脉造影确诊的60例CHD患者为研究对象,设为观察组,另选取60例于我院体检的健康者作为对照组。纳入标准:(1)冠心病符合世界卫生组织(WHO)诊断标准;(2)具备基本沟通、理解能力;(3)签署研究知情同意书。排除标准:(1)心、肝、肾等实质性脏器严重功能不全者;(2)合并其他类型恶性肿瘤者;(3)合并精神系统疾病,存在认知障碍者;(4)不愿参与本研究者。本次研究获得我院医学伦理委员会批准,观察组:年龄50~75岁,平均(62.46±4.75)岁;其中男性35例,女性25例;BMI(16.55~33.96),平均BMI(24.56±5.63);腰围(85.36±8.71)cm;FPG(5.44±1.45)mmol/L;TC(4.23±1.05)mmol/L;LDLC(2.49±0.67)mmol/L;HDLC(1.13±0.25)mmol/L;对照组:龄51~74岁,平均(62.50±4.70)岁;其中男性34例,女性26例。两组一般资料比较无显著差异(P>0.05),具有可比性。
1.2 方法
1.2.1 CT测量PAT体积:采用64排双源CT(德国西门子)测量PAT。设置管电压为120kV,电流为90-160mAs,层厚0.6-1.25 mm,重建层厚、间隔均为5mm。扫描完成后采用Volume测量。设定Lower和Upper选择-250、-30,层厚3mm,测出的脂肪体积单位cm3。使用切割法勾画出心周脂肪边界并用阈值法滤掉心脏周围脂肪密度差别大的结构,点击测量按钮得出PAT。测定3次取平均值后录入数据库。
1.2.2 血清HCY、UA水平:空腹采集5.0mL患者及健康者外周静脉血,注入装有枸橼酸钠的真空抗凝试管中混匀,经3000r/min速度离心10min,取血清,采用全自动生化分析仪对两组血清UA水平进行测定;采用免疫分析仪荧光偏振免疫法测定HCY水平。
1.3 观察指标 观察并记录两组年龄、性别、BMI、腰围、空腹血糖(FPG)、总胆固醇(TC)、低密度蛋白胆固醇(LDL-C)、高密度蛋白胆固醇(HDL-C)、血清HCY、UA水平及PAT体积。
1.4 统计学分析 采用SPSS 20.0统计软件进行数据收集和统计分析。统计学差异设为双侧P<0.05。连续性变量符合正态分布采用(±s)的形式表示,组间比较采用t检验;计数资料用χ2,多因素采用logistic回归分析,各变量间相关性采用Spearman相关分析、以相关系数r表示两资料间的相关性;当P值<0.05时被认为有统计学意义。
2 结 果
2.1 两组血清UA、HCY水平及PAT体积比较 观察组血清UA、HCY水平及均明显高于对照组,PAT体积大于对照组(P<0.05)。见表1。
2.2 血清UA、HCY水平及PAT体积与临床指标相关性分析 血清UA、HCY水平及PAT体积与年龄(r=0.356,P=0.025)、性别(r=0.344,P=0.030)、BMI(r=0.412,P=0.003)、腰围(r=0.375,P=0.01)、FPG(r=0.319,P=0.015)、TC(r=0.332,P=0.021)及LDLC(r=0.275,P=0.020)呈正相关,与HDL-C呈负相关(r=-0.201,P=0.040)。
2.3 Logistic回归分析与CHD发生相关临床指标 Logistic多因素回归分析结果显示,UA(OR=1.38,95%CI:1.01-1.88)、HCY(OR=1.39,95%CI:1.10-1.74)、PAT体积(OR=1.3,95%CI:1.09-1.69)、是影响CHD发生的独立危险因素(P<0.05);而年龄、性别、BMI、腰围、FPG、TC及LDL-C与CHD发生无统计学意义(P>0.05)。
2.4 UA、HCY水平及PAT体积单独及联合应用对CHD诊断结果UA对CHD的阳性诊断率为81.67,HCY对CHD的阳性诊断率为85.0,PAT体积对CHD的阳性诊断率为75.0,血清UA、HCY水平及PAT体积联合检测对CHD的阳性诊断率为93.33,显著高于单独检测阳性诊断率(P<0.05)。见表2。
2.5 UA、HCY及PAT各指标的ROC曲线及曲线下面积分析 血清UA、HCY水平及PAT体积联合检测CHD的曲线下面积高于单独检测,差异具有统计学意义(P<0.05)。见图1。
3 讨 论
CHD是一种威胁人类健康的慢性疾病,也是导致我国人口死亡的主要原因,因此,寻找预测和诊断CHD的指标是近年来研究的热点[5]。UA是人体内嘌呤物质的代谢终产物,主要由血管壁内皮细胞产生,研究证实[6],UA水平呈高表达,可增加血小板的黏附、聚集性,与动脉硬化发生发展关系密切,其原因为高表达的UA可促进LDL-C、脂质的氧化和过氧化,是氧自由基的数量并参与炎症反应,导致冠脉血管损伤,进一步增加了动脉粥样硬化。HCY是人体内含硫氨基酸代谢过程中的产物,其水平呈高表达首先可促进氧自由基形成,损伤血管内皮因子并激活单核巨噬细胞和中性粒细胞等炎性细胞,释放炎症因子;其次,还能够促进机体血小板凝聚,从而影响机体凝血功能,导致血管栓塞的风险。此外,HCY可促进脂质过氧化并加速LDL-C氧化,从而促进动脉粥样硬化的发生、发展[7]。研究表明[8],高血脂、高血压是CHD的危险因素,且HCY与高血脂、血压等基础代谢病情进展有关,因此对伴基础疾病的CHD诊断更有利。PAT可释放炎性因子、病理性脂肪及细胞因子,强化粥样硬化效应,促进冠状粥样硬化的发生。

表1 两组血清UA、HCY水平及PAT体积比较

表2 UA、HCY水平及PAT体积单独及联合应用对CHD诊断结果
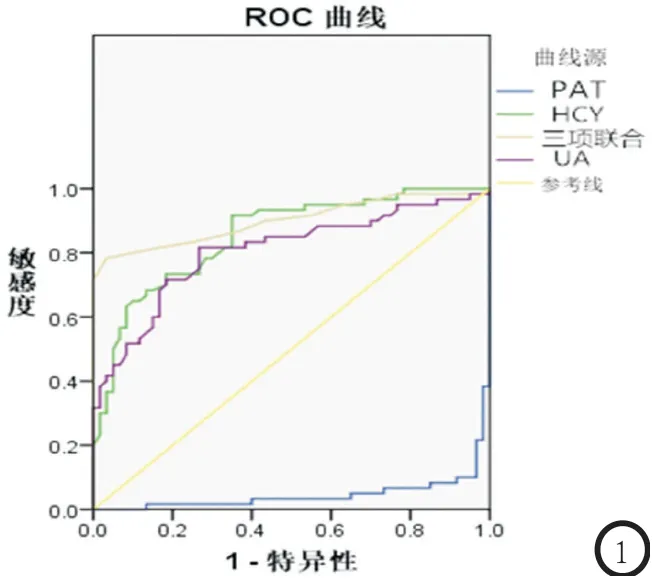
图1 UA、HCY及PAT相应ROC曲线
彭艳、郑浩研究证实[9],PAT体积与心血管危险因素数有关,本研究也证实了这一观点,结果显示,血清UA、HCY水平及PAT体积与年龄、性别、BMI、腰围、FPG、TC及LDL-C呈正相关,与HDL-C呈负相关,提示血清UA、HCY水平及PAT体积可反映危险因素的聚类效应,可作为预示危险较好的指标;刘思宏[10]研究表明,CHD患者PAT体积明显高于健康者,而本研究结果显示,观察组血清UA、HCY水平明显高于对照组,PAT体积大于对照组,这与本研究结果相符,与各病理生理因素导致氨基酸代谢和HCY降解异常有关,提示血清UA、HCY水平及PAT体积与CHD的发生、发展密切相关。Logistic多因素回归分析显示,UA、HCY、PAT体积是预测CHD发生的独立危险因素,提示血清UA、HCY水平升高及PAT体积增大是导致CHD发生的主要原因。通过ROC曲线分析显示,血清UA、HCY水平及PAT体积联合检测CHD的曲线下面积高于单独检测,提示血清UA、HCY水平联合双源CT测量PAT体积对CHD的诊断价值优于单独检测,具有较好的敏感度和特异度。
综上所述,血清UA、HCY水平及PAT体积可CHD的发生密切相关,可作为预测对CHD的早期诊断有效指标。窄的诊断价值[J].中国CT和MRI杂志,2019,17(5):68-71.

