AST参考方法的不同测定模式对测量结果精密度的影响
罗晓旭,秦大鹏,申 彬,梁转霞,杜怡青,杨泽华△
(1.山西医科大学,山西太原 030001;2.山西医科大学第六医院检验科,山西太原 030008)
精密度是指在规定条件下对同一或类似被测对象重复测量所得示值或测得值间的一致程度,是临床生物化学方法学性能评价的关键指标之一[1],可反映测定结果的离散程度。天门冬氨酸氨基转移酶(AST)作为临床酶学常测定的指标之一,对于心脏与肝脏等多种疾病的诊断具有重要的临床意义[2]。现在临床实验室在多数情况下为单次检测发出报告,因而提高实验室AST测量结果的精密度就尤为重要。国际临床化学标准协会已于2002年发布了关于酶学标准化程序的七部系列文件,其中第五部分即AST的参考方法[3],该方法对影响AST活性的因素进行了详细规定,如试剂的种类、缓冲液的性质、反应体系的温度、酸碱度、波长等[4-5],但其在读点时间周期方面仅表述为“检测时间180 s,读点≥6”、在混匀时间方面仅表述为“充分混匀”[5],并未作具体说明。AST参考测量过程分为3个阶段:温育期、延迟期、测定期。在温育期,由于还未加入启动试剂,酶促反应还未开始,此时的反应体系理论上不需要混匀。在测定期即在比色时进行混匀会使反应曲线有一定程度上的“漂移”,并对测定结果造成影响[7]。因此本实验将从延迟期的混匀时间及读点时间周期方面设计不同的AST测定模式,对AST参考方法的最佳测定模式进行探讨,优化参考方法的测定模式,提高AST测定结果的稳定性。
1 材料与方法
1.1样本 Randox质控血清,批号为1092UN;严格按照质控血清复溶说明溶解及混匀质控品。
1.2仪器与试剂 紫外分光光度计及其配套比色皿、比色杯恒温电子控制装置、电子天平均购自日本Shimadzu公司;恒温水浴箱、pH计、Finnpipette移液器、电子温度计、秒表、容量瓶及各种高精密度玻璃器皿等购自中国北京化工公司;按照国际临床化学与检验医学联合会(IFCC)推荐的AST参考测量程序配制试剂。还原型-β-烟酰胺腺嘌呤二核苷酸二钠盐(NADH)、乳酸脱氢酶(LDH)均购自美国Sigma公司;氯化钠(NaCl)、叠氮钠(NaN3)、氢氧化钠(NaOH)、盐酸(HCl)购自中国北京化工公司;三羟甲基氨基甲烷(Tris)、L-天门冬氨酸、α-酮戊二酸二钠盐、乳酸脱氢酶(LDH)、苹果酸脱氢酶(MDH)、丙酮酸钠、牛血清白蛋白均购自中国上海生工有限公司。配制成反应液R1,启动液R2。
1.3方法
1.3.1质控品的溶解方法 按照质控品复溶要求将Randox冻干粉质控品用5 mL去离子水在室温下溶解混匀呈均一态,以每0.5 mL分装于小型离心管中,-20 ℃保存;室温复溶且复溶1次;开启瓶塞时应严格避免冻干粉的丢失[8]。
1.3.2测定模式的设计 按照读点时间周期及混匀时间的不同将AST共设计为A~I共9种不同的测定模式。模式A:读点时间周期15 s,混匀时间30 s;模式B:读点时间周期15 s,混匀时间45 s;模式C:读点时间周期15 s,混匀时间60 s;模式D:读点时间周期30 s,混匀时间30 s;模式E:读点时间周期30 s,混匀时间45 s;模式F:读点时间周期30 s,混匀时间60 s;模式G:读点时间周期18 s,混匀时间30 s;模式H:读点时间周期18 s,混匀时间45 s;模式I:读点时间周期18 s,混匀时间60 s。
1.3.3样本检测方法 依照IFCC参考测量程序建立AST改良参考方法,为不加磷酸吡哆醛方法,依照上述测定模式对样本进行检测,每天对每种模式重复测定2次,间隔时间大于2 h,连续测定20 d[9]。样本在规定的反应条件下进行测定:温度(37.0±0.1)℃;波长340 nm;频带宽度≤2 nm;光路10.00 mm;孵育时间360 s;延迟时间90 s;检测时间180 s。
1.4统计学处理 汇总不同测定模式的全部数据,利用Excel软件计算在每种测定模式下的AST测定结果及总不精密度(CV总)并进行比较,判断测量结果精密度是否符合参考方法精密度要求[10]。
2 结 果

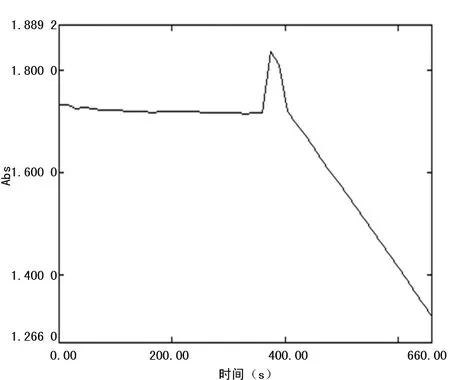
图1 AST 动力学反应曲线
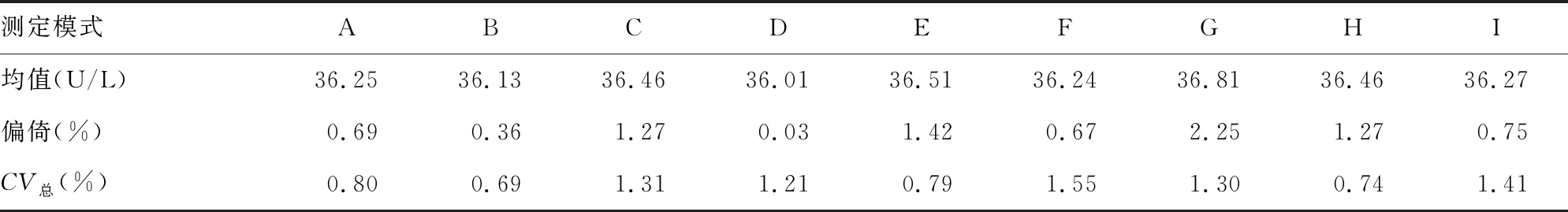
表1 不同测定模式下AST测量结果及其精密度
2.2不同条件下的AST测量结果及其精密度 结果发现:测定模式B即读点时间周期为15 s、混匀时间为45 s的测定模式的AST测量总不精密度最小,且小于1%,符合参考方法精密度要求;读数时间周期相同时,延迟期混匀时间为45 s的测定模式下测量总不精密度最小;延迟期混匀时间相同时,读数时间周期为15 s的测定模式下测量总不精密度最小。见表1~3。
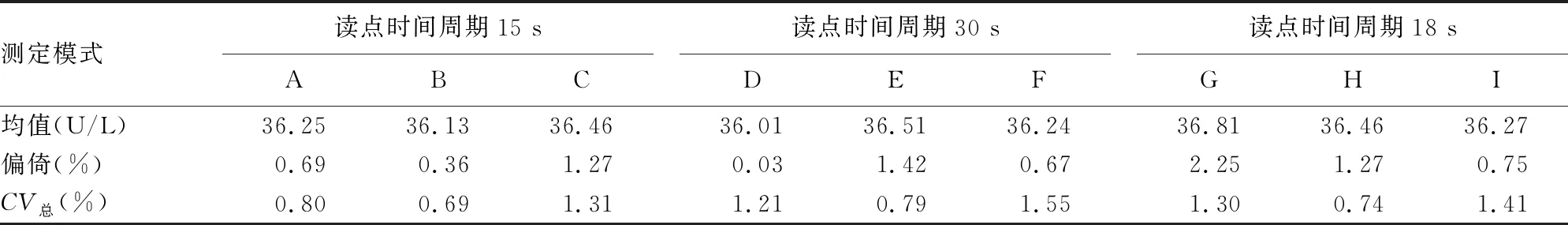
表2 不同读点时间周期的测定模式下AST测量结果及其精密度

表3 不同混匀时间的测定模式下AST测量结果及其精密度
注:偏倚指测定结果均值与质控品所示目标值的偏倚。
3 讨 论
临床生化检验为临床实验室工作的重要内容,其中临床酶学检验又为临床生化检验的重要组成部分。精密度是检验系统重要的分析指标,是检验结果准确度的前提[11-12],临床医师看重的是同一份标本在不同检测时间段的重复性,如果同一份标本在不同检测时间段的检测结果差异很大,临床医生及患者就会不相信实验室的检测结果[13],从而影响临床决策、患者安全及检验科自身的发展。因此,提高检测结果的精密度,保证分析性能满足临床检测要求是检验室日常工作的重要一部分。
本实验从AST的读点时间周期及延迟期的混匀时间着手,探讨不同测定模式对AST测量结果精密度的影响。从实验结果来看,在读点时间周期为15 s、延迟期混匀时间为45 s的测定模式B下,AST的测量结果不精密度最小,为0.69%,小于参考方法设定目标值。按照读点时间周期的不同将9种测定模式分为3组可以发现,每组中即读点时间周期相同的情况下,不精密度最小的为混匀时间为45 s的混匀模式,而混匀时间为30 s和60 s时精密度不好可能是因为混匀时间过短和混匀时间过长。混匀时间过短会造成反应体系混匀不充分,而混匀时间过长影响精密度可能有两方面原因:(1)检测时间段一致的情况下,混匀时间过长则反应体系静止时间缩短,即在反应体系还未稳定时即开始进行比色测定,直接影响测定结果的稳定性[5];(2)半自动生化分析仪加R2试剂时需开盖,这样室温就会影响比色杯内反应体系的温度[14],且混匀时间越长,对反应体系的影响就越大。按照延迟期混匀时间的不同将9种测定模式继续分为3组可以看出,每组中即在延迟期混匀时间相同的情况下,读数时间周期为15s的测定模式下AST测定不精密度最小,可能原因为读数时间周期越短,相同检测时间段内所读取的点越多,采用线性回归计算单位时间内吸光度变化所得值就越接近。另外,参考方法为纯手工操作,因此酶学测定结果还会受实验室环境、操作人员等的不同的影响[15-16],不同实验室的酶学最佳测定模式也可能有所不同。
从本实验结果来看,测定模式的差异对AST测量结果精密度有明显的影响,不同酶学指标的精密度最好的测定模式可能不同。实验室应探索适合自己的酶学测定模式,对每个酶学指标的测定模式进行具体探讨,完善参考测定程序中的测定条件,提高酶学测量结果的精密度。

