超高效液相色谱-质谱联用法监测人心房钠尿肽的化学合成
徐 坤, 金钰龙, 黄嫣嫣*, 赵 睿*
(1. 北京分子科学国家研究中心, 中国科学院活体分析化学重点实验室, 中国科学院分子科学科教融合 卓越创新中心, 中国科学院化学研究所, 北京 100190; 2. 中国科学院大学, 北京 100049)
多肽(peptide)是生命体中重要的基础物质之一,在生命体的生长、发育、代谢和衰老等过程中都发挥着不可替代的作用[1]。随着对多肽结构与功能的深入研究,人工合成生物活性多肽已经成为化学、生物学和医学领域共同关注的热点[2]。1963年,Merrifield[3]提出了固相多肽合成(solid phase peptide synthesis, SPPS)这一独创性的概念,是多肽化学领域的一个重大突破,并于1984年获得了诺贝尔化学奖。虽然SPPS操作简单、反应效率高、副反应干扰少,但是由于氨基酸及其衍生物的种类繁多、侧链基团结构与性质差异大,仍然存在部分氨基酸偶联时易消旋[4]、芳香胺偶联困难[5]以及长链肽偶联效率较低[6]等问题。因此,发展高效的分离分析方法对于多肽合成过程的监测、产物纯化和结构鉴定具有重要意义。
人心房钠尿肽(human atrial natriuretic peptide, ANP)是一种含有28个氨基酸的多肽类激素,由心房心肌细胞产生、储存和分泌,通过与位于细胞膜上的受体鸟苷酸环化酶相互作用,ANP主要发挥舒张血管、调节钠水平和维持血容量平衡的作用[7-9]。除了心房外,ANP还分布在中枢神经系统,也存在于血浆和脑脊液中[10]。已有研究表明,体内ANP的含量和代谢发生异常,往往与心血管疾病、癌症等密切相关[11,12]。利用化学方法合成ANP对于研究其生理功能、作用机制以及疾病的干预和治疗具有重要意义。然而,由于ANP肽链较长,且含有二硫键桥连的环状结构,使其高效化学合成具有一定困难。
高效液相色谱-质谱联用技术结合了液相色谱的高效分离和质谱强大的结构鉴定能力,具有高分离度、高灵敏度以及可获得丰富结构信息等特点,在合成反应的进程监测中发挥了重要作用,极大地提高了对未知物的分离分析能力[13-21]。针对ANP重要的生理功能,本文开展了ANP化学合成及其过程的监测与优化,设计了固相多肽合成与液相氧化相结合的策略,建立了超高效液相色谱-串联质谱(UHPLC-MS/MS)分析新方法,对固相合成产物进行了分离分析,并对液相氧化方法进行了筛选和优化,最终分离纯化得到了目标多肽。该研究为长链/环状多肽的高效化学合成及其液相色谱-质谱分离鉴定提供了方法借鉴。
1 实验部分
1.1 仪器、试剂与材料
超高效液相色谱-紫外-电喷雾离子源-离子阱串联质谱(UHPLC-UV-ESI-IT MS/MS)分析系统由Ultimate 3000 UHPLC、DAD-3000RS二极管阵列检测器和LCQ Fleet离子阱质谱仪组成(Thermo Fisher,美国)。LC-20AD HPLC高效液相色谱系统配备二极管阵列检测器(Shimadzu,日本)。半制备高效液相色谱系统包括LC-20AR色谱泵,SPD-20A二极管阵列检测器,FRC-10A自动收集器(Shimadzu,日本)。9.4T Solarix型傅里叶变换离子回旋共振质谱仪(FT-ICR-MS, Bruker,美国),配备基质辅助激光解吸(MALDI)离子源。色谱柱包括Welch Ultimate UHPLC XB-C18(100 mm×2.1 mm, 1.8 μm)(上海月旭科技股份有限公司)、Diamonsil C18(250 mm×4.6 mm, 5 μm)(北京迪马科技有限公司)和Diamonsil C18(250 mm×10 mm, 5 μm)(北京迪马科技有限公司)。
2-(7-偶氮苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU,纯度为99%)购自吉尔生化(上海)有限公司(中国); 1-羟基苯并三氮唑水合物(HOBt·H2O)、Fmoc-Arg(2,2,4,6,7-pentamethyldihydrobenzofuran-5-sulphonyl, Pbf)-OH、Fmoc-Phe-OH、Fmoc-Ser(tert-butyl, tBu)-OH、Fmoc-Asn(trityl, Trt)-OH、Fmoc-Cys(Trt)-OH、Fmoc-Gly-OH、Fmoc-Leu-OH、Fmoc-Gln(Trt)-OH、Fmoc-Ala-OH、Fmoc-Ile-OH、Fmoc-Asp(tBu)-OH、Fmoc-Met-OH和Fmoc-Tyr(tBu)-Wang树脂均购自Advanced ChemTech公司(美国);乙腈(色谱纯)购自Thermo Fisher Scientific公司(美国);三氟乙酸(TFA,纯度为99.9%)、1,2-乙二硫醇(EDT,纯度为90%)购自Sigma-Aldrich公司(美国);三异丙基硅烷(TIS,纯度为98%)、N-甲基吗啡啉(NMM,纯度为99.5%)购自百灵威科技有限公司;N,N-二甲基甲酰胺(DMF,纯度为99.9%)、二氯甲烷(纯度为99.8%)、六氢吡啶(piperidine,纯度为97.5%)、二甲基亚砜(DMSO,纯度为99.5%)均购自北京化工厂,溶剂DMF和二氯甲烷均加入分子筛(有效孔径为0.4 nm)干燥除水;N,N′-二异丙基碳二亚胺(DIC,纯度为98%)购自阿拉丁公司。实验所用超纯水由Milli Q纯水仪产生(Millipore公司,美国)。
1.2 ANP的化学合成
1.2.1ANP直链多肽的Fmoc固相合成
采用Fmoc固相合成策略对ANP直链进行合成,其过程如下:将Fmoc-Tyr(tBu)-Wang树脂装入多肽合成管中,加入DMF溶胀树脂。待树脂充分溶胀后,抽滤除去DMF,并用新的DMF清洗3次,然后,加入20%(体积分数)的六氢吡啶/DMF溶液脱除Fmoc保护基,用DMF清洗树脂3次。称取侧链保护的Fmoc-氨基酸及缩合剂,加入DMF使其溶解并活化,将活化后的氨基酸溶液与树脂混合,进行偶联反应。循环上述脱保护、清洗、偶联、清洗等步骤,逐步延长肽链,直至28个氨基酸连接完毕。
完成多肽链的延长之后,脱除末端Fmoc保护基,清洗树脂后,用二氯甲烷和甲醇进行树脂收缩。收缩完成后,将树脂进行真空干燥。取干燥后的树脂,加入裂解液(TFA∶EDT∶TIS∶H2O的体积比为94∶2.5∶1∶2.5),在冰浴中缓慢搅拌15 min,室温下继续裂解3 h。反应结束后将收集到的滤液在35 ℃下减压旋蒸浓缩,随后加入预冷过的乙醚,使多肽沉淀,将所获得的多肽离心、洗涤、干燥,得到粗品ANP直链多肽。
ANP多肽的氨基酸序列为NH2-Ser-Leu-Arg-Arg-Ser-Ser-Cys-Phe-Gly-Gly-Arg-Met-Asp-Arg-Ile-Gly-Ala-Gln-Ser-Gly-Leu-Gly-Cys-Asn-Ser-Phe-Arg-Tyr-COOH(SLRRSSCFGGRMDRIGAQSGLGCNSFRY),第7位和第23位的半胱氨酸通过二硫键成环。
1.2.2二硫键形成及其反应监测
采用两种策略对巯基进行氧化以形成二硫键:(1)碘氧化法:以乙腈-水(1∶4, v/v)为溶剂溶解多肽,以多肽与碘物质的量之比为2∶1加入碘单质,多肽的浓度为0.5 mmol/L,室温下进行氧化。(2)DMSO氧化法:以pH=5.6的醋酸水溶液为溶剂溶解多肽,加入DMSO,使DMSO体积比为20%,多肽的浓度为0.5 mmol/L,室温下进行氧化。
利用UHPLC-UV-ESI-IT MS系统监测反应进程,所用色谱柱为Welch Ultimate UHPLC XB-C18(100 mm×2.1 mm, 1.8 μm),流动相A为含0.1%(体积分数)甲酸的水溶液,流动相B为含0.1%(体积分数)甲酸的乙腈溶液,流速为0.2 mL/min,检测波长为220 nm。洗脱梯度为0~10 min, 5%B~50%B。
1.3 ANP的分离纯化与结构鉴定
1.3.1ANP的分离纯化
取部分ANP粗品溶于水中,采用Shimadzu LC-20AD HPLC系统对样品进行分析,色谱柱为Diamonsil C18(250 mm×4.6 mm, 5 μm),流动相A为含0.1%(体积分数)TFA的水溶液,流动相B为含0.1%(体积分数)TFA的乙腈溶液,流速为1.0 mL/min,检测波长为220 nm。洗脱梯度为0~15 min, 20%B~35%B。
进一步采用Shimadzu LC-20AR半制备高效液相色谱仪对所合成的多肽进行纯化。将待纯化的ANP溶于起始流动相(含0.1%(体积分数)TFA的20%(体积分数)乙腈水溶液),色谱柱为Diamonsil C18(250 mm×10.0 mm, 5 μm),流动相A为含0.1%(体积分数)TFA的水溶液,流动相B为含0.1%(体积分数)TFA的乙腈溶液,流速为3.0 mL/min,检测波长为220 nm。纯化梯度为0~15 min, 20%B~35%B。
1.3.2ANP的结构鉴定
采用UHPLC-UV-ESI-IT MS/MS及MALDI-FT-ICR MS对合成的ANP多肽进行结构鉴定。色谱柱为Welch Ultimate UHPLC XB-C18(100 mm×2.1 mm, 1.8 μm),流动相A为含0.1%(体积分数)甲酸的水溶液,流动相B为含0.1%(体积分数)甲酸的乙腈溶液,流速为0.2 mL/min,洗脱梯度为0~10 min, 5%B~50%B。质谱离子源喷雾电压为4.5 kV(正离子模式),毛细管温度为300 ℃。通过MALDI-FT-ICR MS获得ANP的准确分子量,通过UHPLC-UV-ESI-IT MS/MS的一级质谱信号以及二级质谱的碎片离子信号,确定ANP的结构。
2 结果与讨论
2.1 ANP直链多肽的Fmoc固相合成
ANP作为一种多肽类激素,对血液中的钠水平调节和稳态平衡具有重要作用[22]。ANP含有28个氨基酸,其中第7和23位为两个半胱氨酸(Cys),通过两个半胱氨酸的侧链巯基形成二硫键,使其具有环状结构[23]。由于ANP在体内含量很低,要进行ANP结构、功能等研究,就需要采用化学合成的方法进行制备。固相多肽合成具有操作便利、反应效率高、副反应少等优势,过量氨基酸与试剂的加入,可以使反应更加完全,并且在反应结束后,通过简单的过滤除去过量的反应物,因此采用Fmoc固相多肽合成法进行ANP多肽的制备。由于ANP的肽链相对较长,并且需要形成链内二硫键,为了获得更高的合成效率,拟采取固相方法合成ANP直链与液相氧化形成二硫键相结合的策略,进行ANP的化学合成,合成流程如图1所示。相比于固相氧化成环,液相氧化具有位阻小、氧化效率高且易于监测氧化进程等优势,因此首先对ANP直链28肽进行固相合成,然后进行液相成环反应,最终获得ANP多肽。
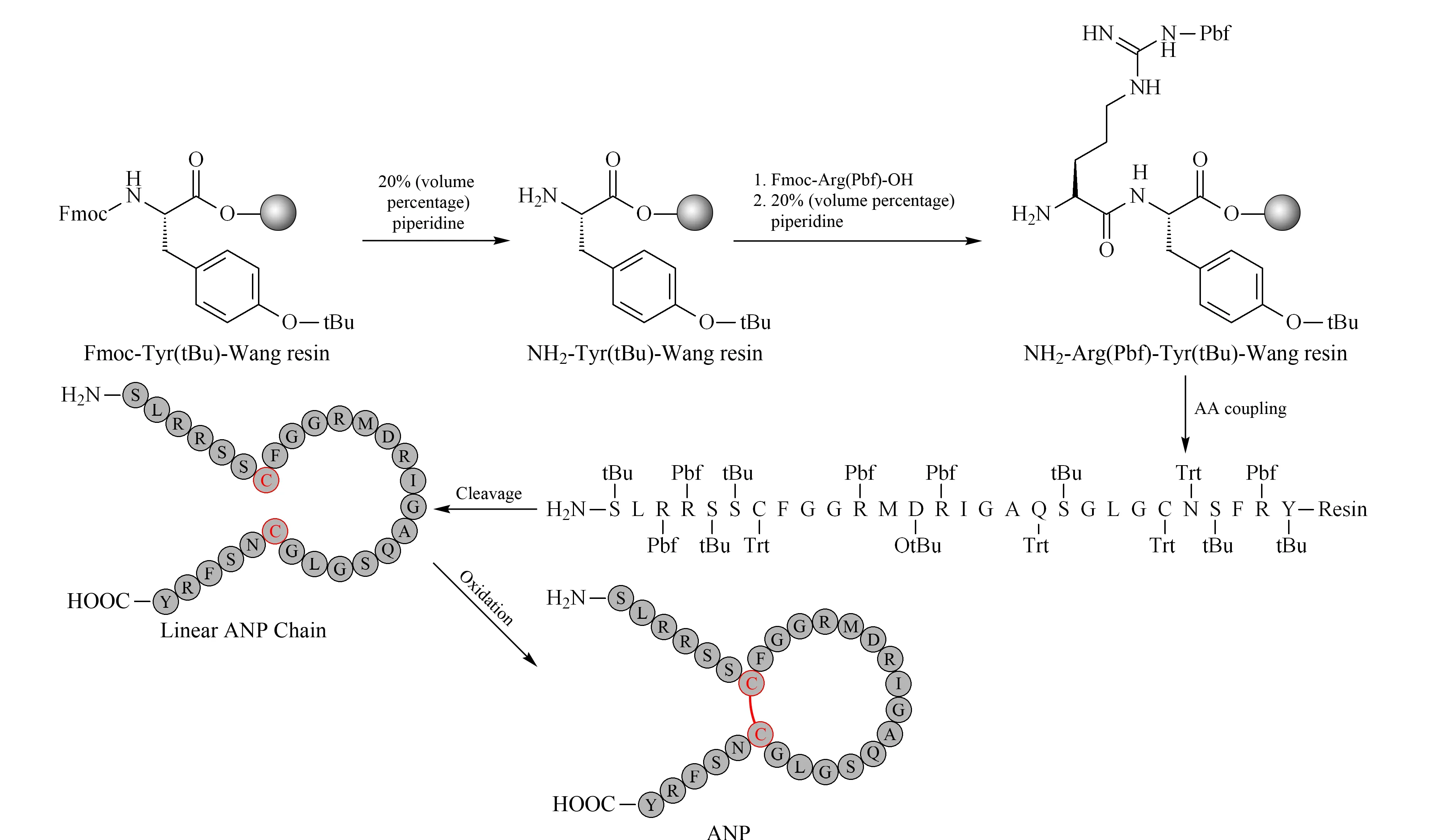
图 1 ANP合成流程图Fig. 1 Scheme of human atrial natriuretic peptide (ANP) synthesisAA: amino acid; tBU: tert-butyl; Pbf: 2,2,4,6,7-pentamethyldihydrobenzofuran-5-sulphonyl; Trt: trityl.
在ANP直链合成过程中,为了提高氨基酸偶联反应的效率,选用HATU作为缩合剂,添加有机碱NMM以辅助活化羧基。HATU是一种胍正离子缩合剂,具有反应活性高、偶联速率快,适合于长链肽中氨基酸的偶联。考虑到ANP序列中含有半胱氨酸,采用常规HATU法偶联易发生消旋,故在进行半胱氨酸偶联过程中改用DIC作为缩合剂,以二氯甲烷-DMF(1∶1, v/v)作为溶剂,以抑制半胱氨酸消旋的发生[4,24]。此外,在肽链延长后期,由于反应位阻增大等因素,偶联反应较为困难,故引入了微波辅助合成,以提高偶联反应效率。
2.2 ANP直链多肽的分离分析
采用RP-HPLC方法对所制备的ANP直链多肽进行了分离分析,分离条件如1.3.1节所述。色谱分离图(见图2a)显示,ANP直链粗品中有两个信号较强的主色谱峰。利用MALDI-FT-ICR MS对这两个峰进行了鉴定,结果显示,峰2的准分子离子峰[M+H]+为3 081.4 797(见图3b),与目标物直链的精确分子质量3 080.4 603相对应,因此峰2为目标物ANP直链28肽。峰1的准分子离子峰[M+H]+为2 978.4 679(见图3a),与目标ANP直链28肽相差103 Da,通过检索发现103 Da归属于半胱氨酸残基,而丢失一个Cys的27肽的精确分子质量为2 977.4 512,与峰1的质谱测定值一致。因此可以断定,峰1为丢失一个Cys的27肽。由于减少了1个氨基酸,其疏水性减小,亲水性增加,导致保留时间减小,比目标ANP直链28肽先出峰(见图2a)。分析缺失的原因可能是随着多肽链长度的增加,位阻不断增加,导致Cys偶联不充分。
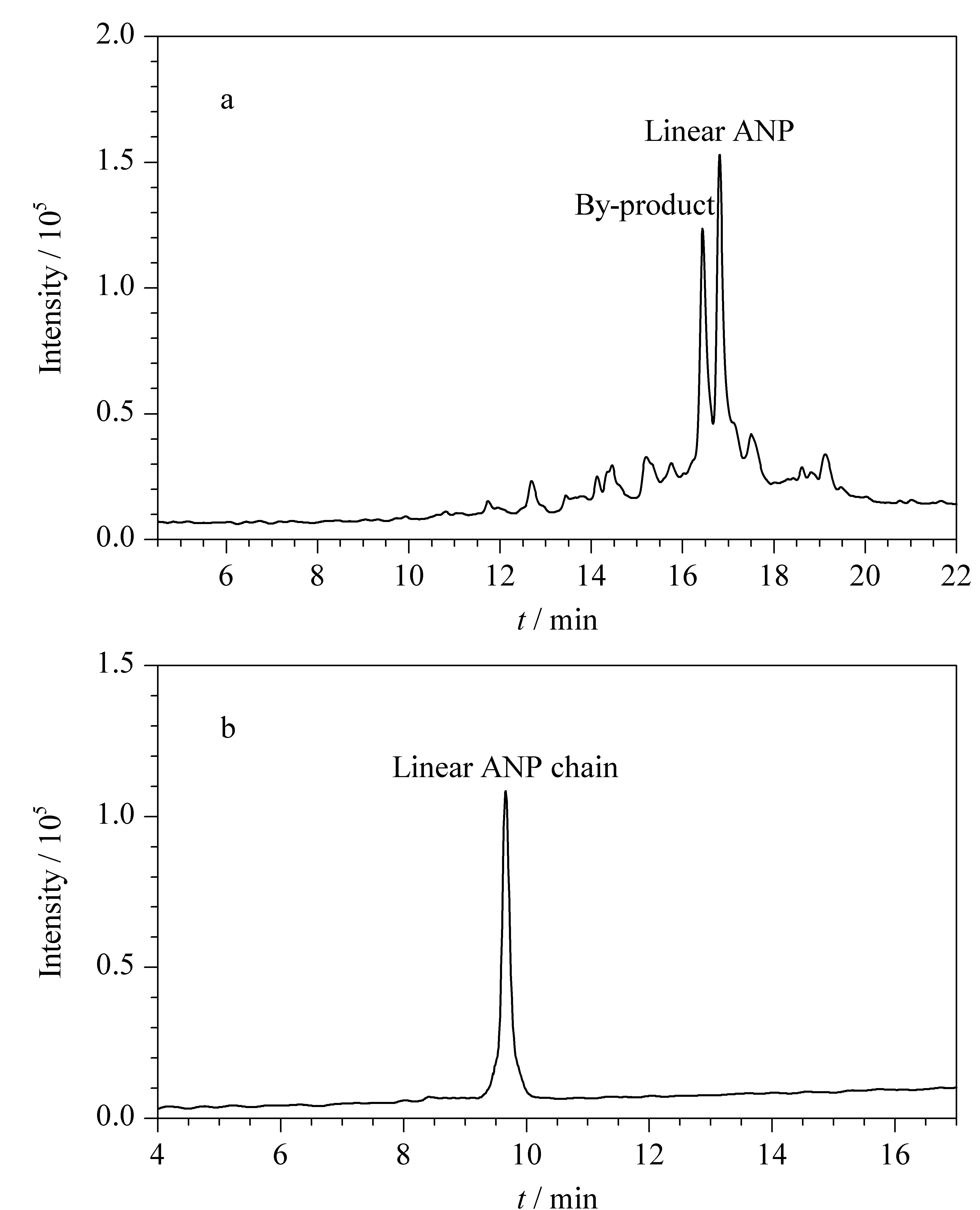
图 2 (a)ANP直链粗品和(b)纯化后ANP直链的 RP-HPLC图Fig. 2 RP-HPLC chromatograms of (a) crude linear ANP and (b) purified linear ANP

图 3 (a)副产物27肽和(b)ANP直链多肽的 MALDI-FT-ICR质谱图Fig. 3 MALDI-FT-ICR (ion cyclotron resonance) mass spectra of (a) by-product and (b) linear ANP
由于副产物结构中含有半胱氨酸,其存在对后续液相氧化存在干扰,因此利用半制备高效液相色谱对ANP直链粗品进行了分离纯化,色谱条件如1.3.1节所述。RP-HPLC和高分辨质谱分析结果表明,纯化后的直链纯度高、结构正确(见图2b和3b),经过计算含有28个氨基酸的ANP直链多肽的产率为19.1%。
2.3 ANP直链多肽氧化成环反应的监测和优化
在获得ANP直链多肽纯品后,利用液相合成的方法对其进行氧化成环,巯基氧化反应的位点为第7位和第23位的半胱氨酸。目前形成二硫键的方法通常为加入氧化剂,常用的氧化试剂包括I2[25]、O2[26]、H2O2[27,28]和DMSO[29]等。其中,单质碘氧化法具有反应速度快的特点,因此首先尝试将其用于ANP直链多肽的氧化。反应以乙腈-水(1∶4, v/v)作为溶剂,在室温下进行。由于I2氧化性强,反应速率快,因此在反应10 min后,即利用HPLC对反应体系进行了分离分析(见图4)。RP-HPLC分析结果显示,反应体系主要分离出3个色谱峰,利用ESI-IT MS和高分辨MALDI-FT-ICR MS对3种物质进行了鉴定,其中峰2为氧化成环的目标ANP,其一级质谱信号[M+5H]5+(m/z=617.3)、[M+4H]4+(m/z=771.3)和[M+3H]3+(m/z=1 027.9)与ANP理论多电荷峰[M+5H]5+(m/z=617.1)、[M+4H]4+(m/z=771.1)和[M+3H]3+(m/z=1 027.8)相对应。高分辨质谱测得准分子离子峰[M+H]+为m/z3 079.4 679,与ANP精确相对分子质量3 078.4 447相一致。峰1和峰3的准分子离子峰[M+H]+分别为m/z3 095.4 646和3 221.3 571,与目标物不符,为反应副产物。根据氧化产物目标峰2的比例,虽然单质碘氧化巯基的反应速率快,几分钟内即可完成,但是副产物较多,产率低,不是理想的氧化成环方法。
DMSO作为合成反应中一种常用的氧化剂,其氧化条件温和,可以通过调控DMSO体积分数控制氧化速率[30]。利用DMSO氧化巯基的过程中,伯醇、羧酸、酯、氨基等官能团均不受影响,因此在二硫键的形成中得到了广泛的应用[31]。以pH=5.6、DMSO体积分数为20%的醋酸水溶液对ANP直链多肽进行了氧化,为了优化反应条件,利用1.2.2节所建立的UHPLC-UV-ESI-IT MS方法对氧化反应的进程进行了监测(见图5)。随着氧化反应的进行,出现了一个新的色谱峰,表明有新物质的生成。ESI-IT MS表征数据显示,其多电荷峰([M+5H]5+(m/z=617.0)、[M+4H]4+(m/z=771.1)、[M+3H]3+(m/z=1 027.9))与成环后ANP的理论多电荷峰一致(见图5c)。随着反应时间的延长,直链ANP所对应的峰1强度逐渐下降,成环后ANP所对应的峰2的强度明显上升,表明氧化反应顺利进行。当反应时间为8 h时,直链在光谱检测器上基本消失,表明反应结束。在反应过程中,除了反应物和产物,未见明显干扰物质,表明该反应体系副产物较少,氧化结果令人满意。
2.4 ANP的分离纯化与结构鉴定
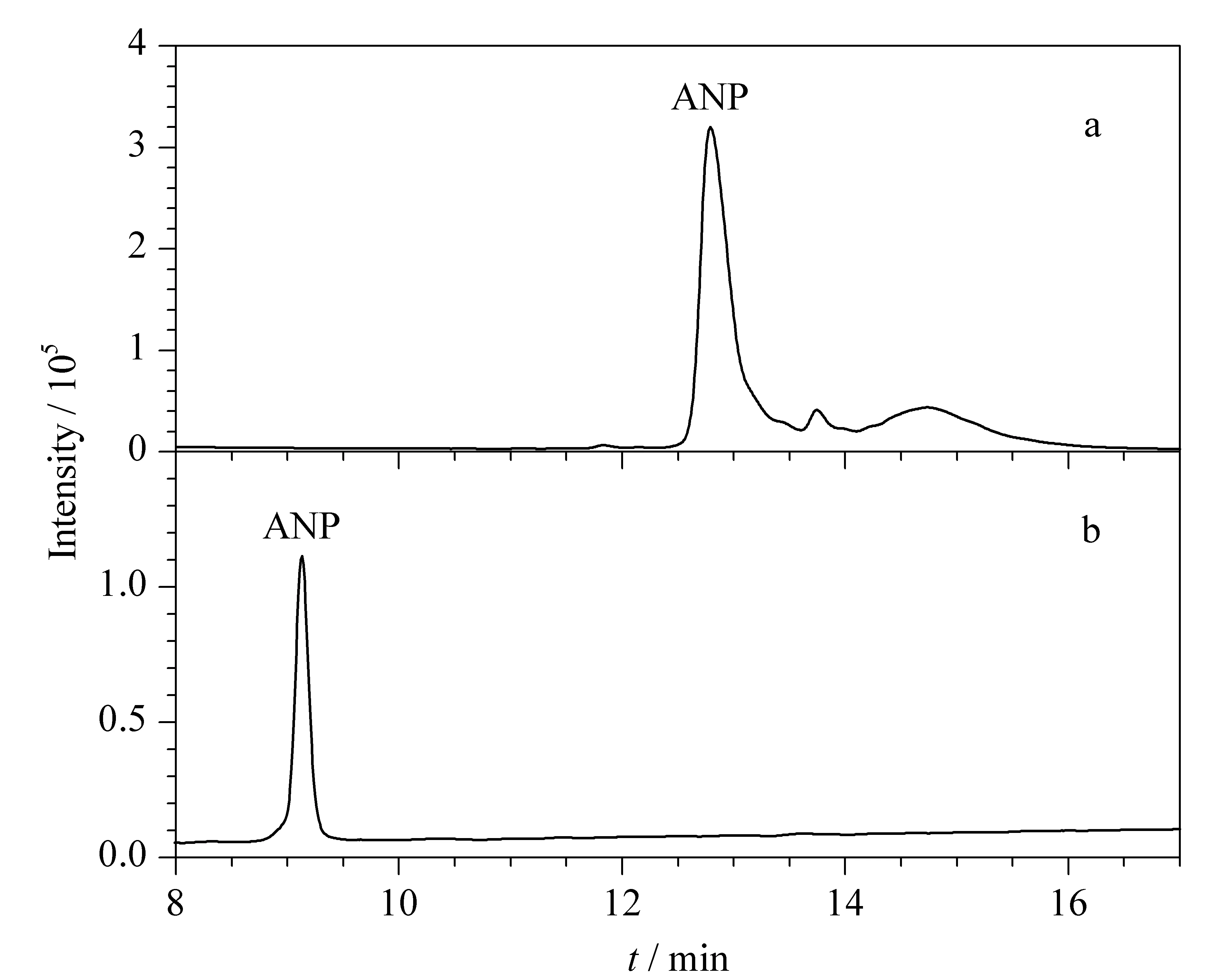
图 6 (a)纯化前ANP粗品和(b)纯化后ANP的RP-HPLC图Fig. 6 RP-HPLC chromatograms of (a) the crude ANP and (b) the purified ANP
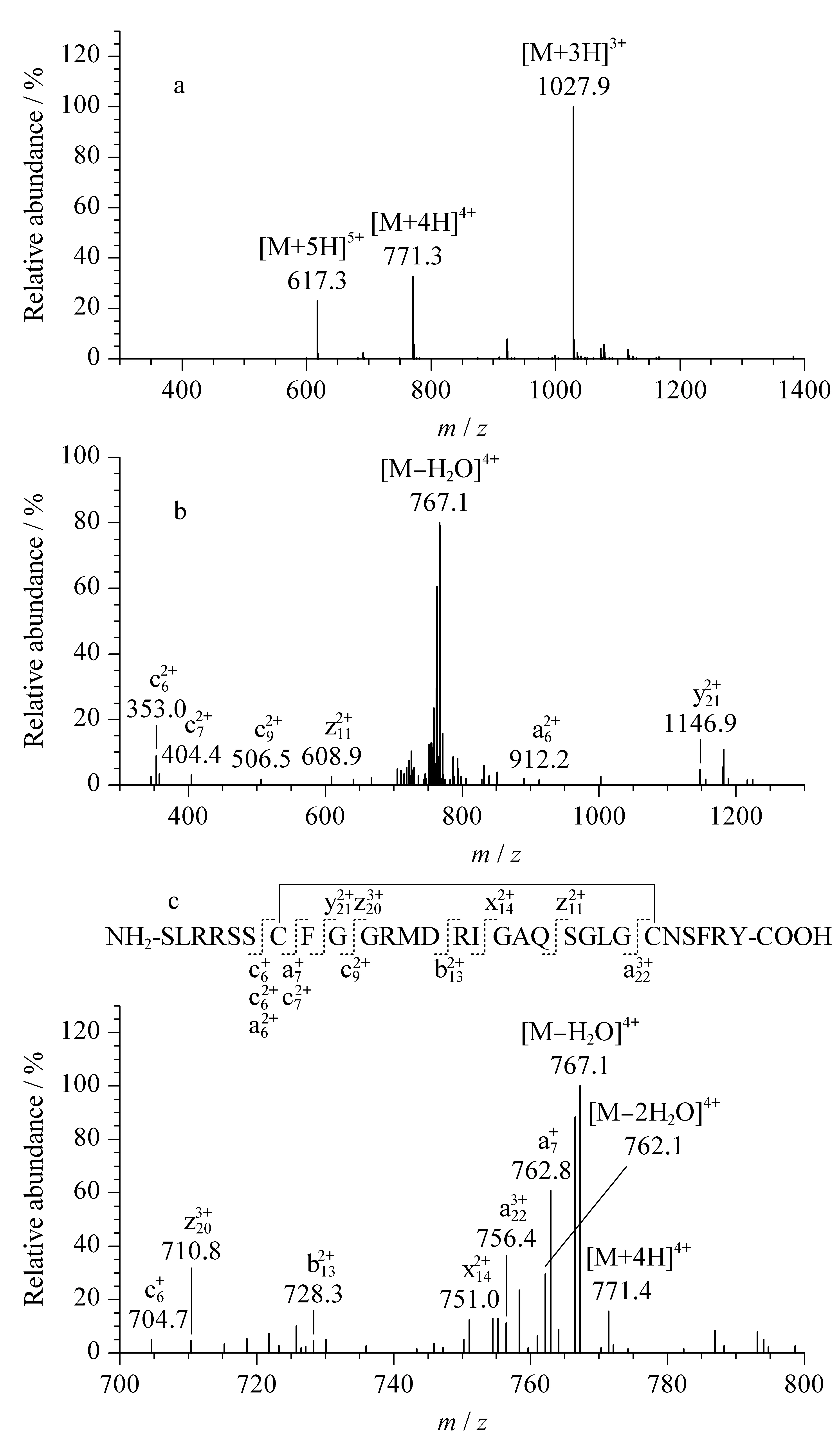
图 7 ANP的(a) ESI-IT质谱图和(b和c)ESI-IT MS/MS碎片离子图Fig. 7 (a) ESI-IT mass spectrum and (b and c) ESI-IT- MS/MS spectra of purified ANP
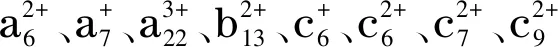
3 结论
本文采用固相合成与液相氧化相结合的策略对人心房钠尿肽进行了化学合成,建立了HPLC-MS/MS法对合成反应进行了监测。基于其分离和鉴定数据,选择了条件温和的DMSO氧化法对ANP直链多肽进行了成环反应,最终得到了纯度高、结构正确的ANP产物。该研究为人心房钠尿肽的高效制备及分离鉴定提供了方法借鉴。

