食品中真菌毒素样品前处理方法的研究进展
胡文尧, 龙美名, 胡玉斐, 李攻科
(中山大学化学学院, 广东 广州 510275)
真菌毒素是由真菌在一定环境条件下产生的一类具有毒性的小分子次级代谢产物[1,2],不仅可以通过抑制人体细胞内相关蛋白质和酶的合成来损害神经系统、免疫系统,以及肝脏、肾脏、肠胃等组织器官,而且还具有致癌、致畸、致突变等作用,当摄入量超过一定限量时,直接危及生命[3-6]。真菌种类繁多,由它们产生的毒素类型也较多,截至目前,已发现500多种化学结构各异的真菌毒素[7,8],其中黄曲霉毒素(aflatoxins, AFs)、赭曲霉毒素(ochratoxins, OTs)、脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)、玉米赤霉烯酮(zearalenone, ZEN)、伏马菌毒素(fumonisins, FBs)、展青霉毒素(patulin, PAT)等因其毒性强、污染频率高,受到广泛关注[9-11]。根据化学结构的不同,真菌毒素主要可以分为刚性共面苯环结构(如AFs)、部分共面结构(如赭曲霉毒素A(OTA))和非共面倍半萜烯结构(如单端孢霉烯族镰刀菌毒素(T-2毒素))3大类[12]。
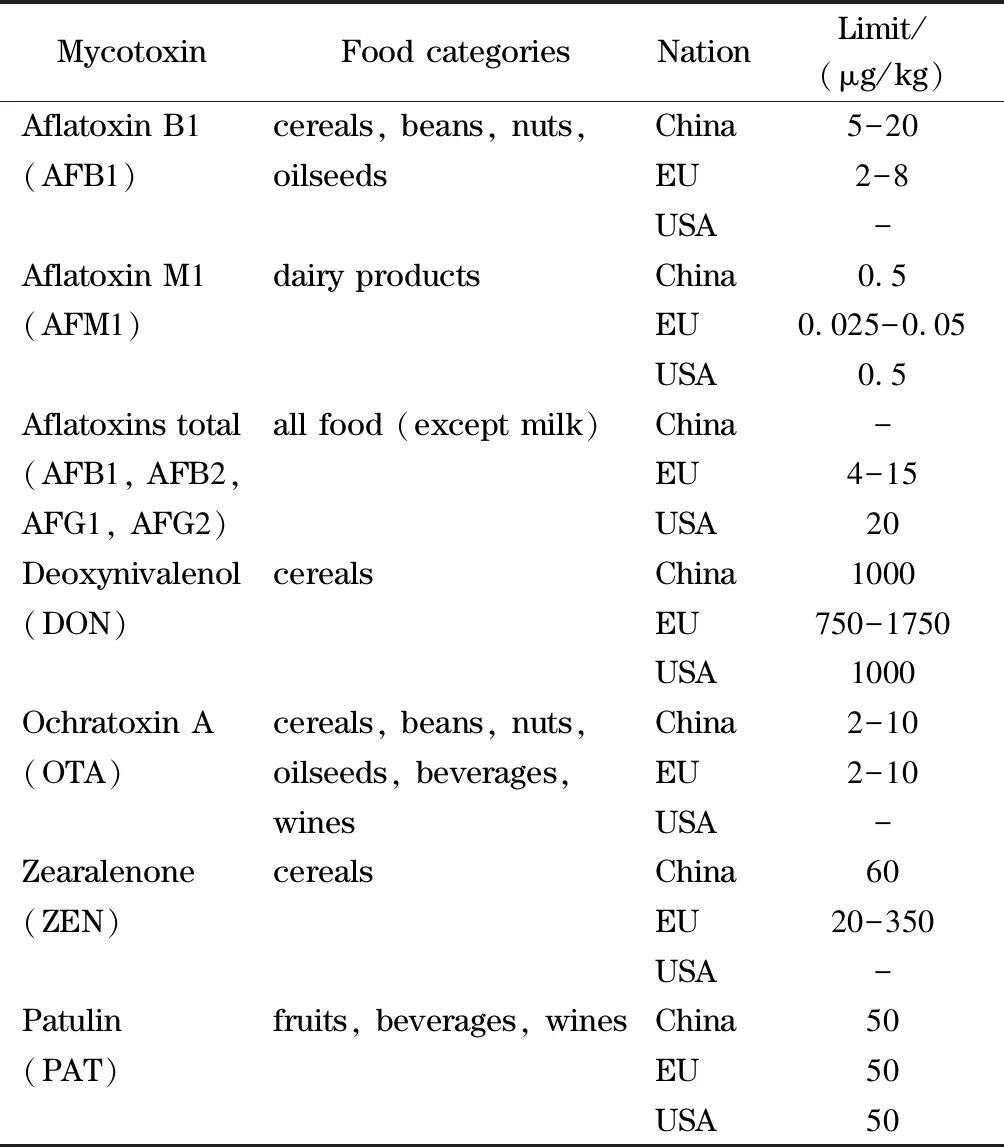
表 1 中国、欧盟和美国关于常见真菌毒素的限量标准Table 1 Limit standards for mycotoxins in China, European Union (EU) and the United States of America (USA)
真菌毒素污染范围广,易污染粮食作物及其制品、油料作物及其制品、坚果产品、蔬菜、水果和乳类制品等多种食物,以及在这些食物的种植、采收、运输、加工和存储等过程中均有可能受到真菌毒素的污染[13-15]。而大部分真菌毒素在常规的食品加工和烹饪过程中均无法将其消除[16,17],一旦食用含有这些真菌毒素的食品,可导致人体中毒,从而引发严重的后果[18]。因此,包括我国在内的许多国家都制定了针对真菌毒素的严格限量标准[19,20],以保障食品安全和消费者生命健康安全。我国于2017年实施了最新的食品中真菌毒素限量标准《食品安全国家标准食品中真菌毒素限量》[21],对黄曲霉毒素、赭曲霉毒素等常见真菌毒素进行了限量规定。表1为中国、欧盟及美国规定的常见真菌毒素在不同类食品中的限量标准。
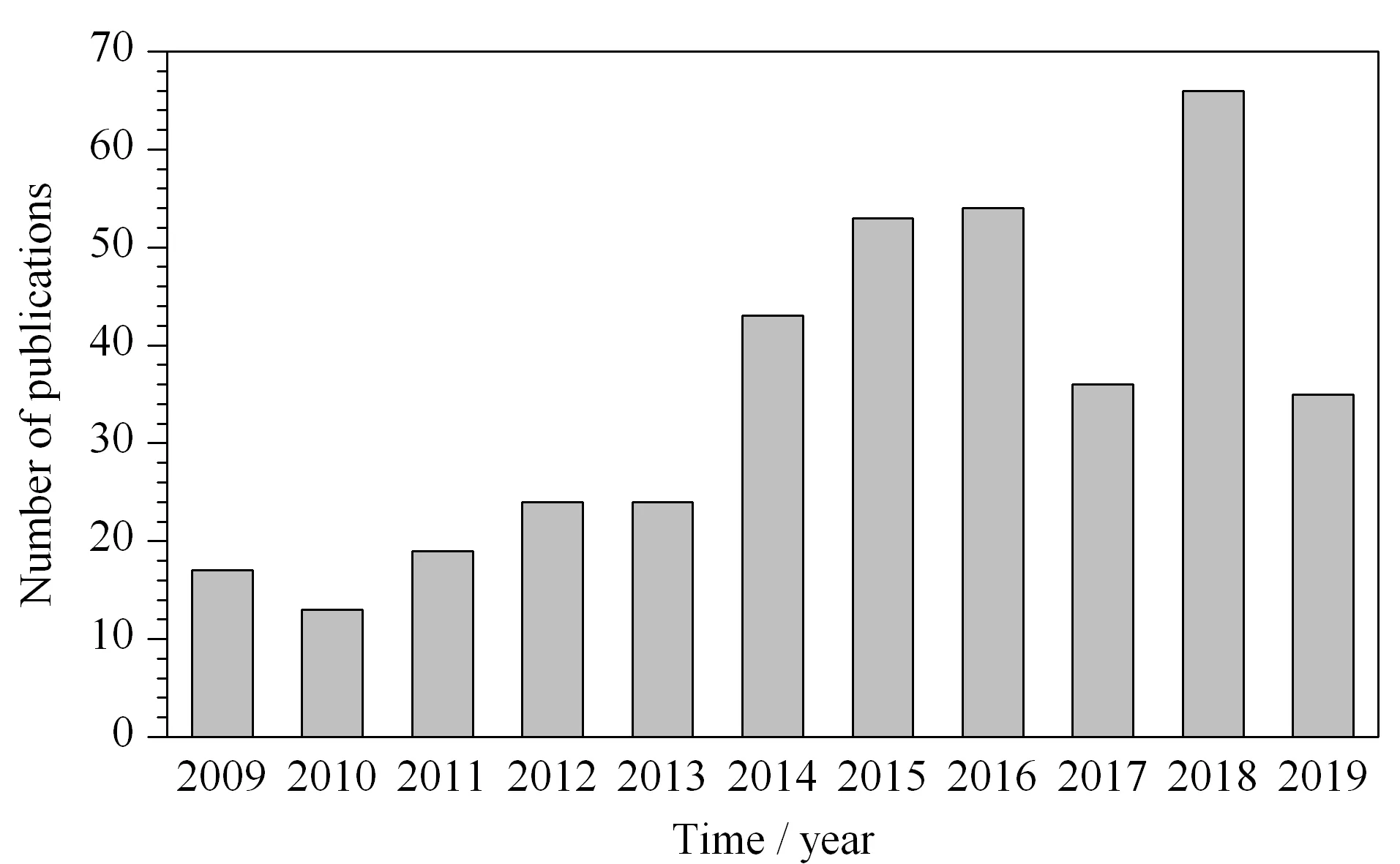
图 1 2009~2019年发表的关于食品中真菌毒素样品 前处理文献的数量Fig. 1 Number of publications on preparation methods for mycotoxins in food samples during 2009-2019 Source: Web of Science and CNKI; keywords: mycotoxins, sample pretreatment or sample preparation.
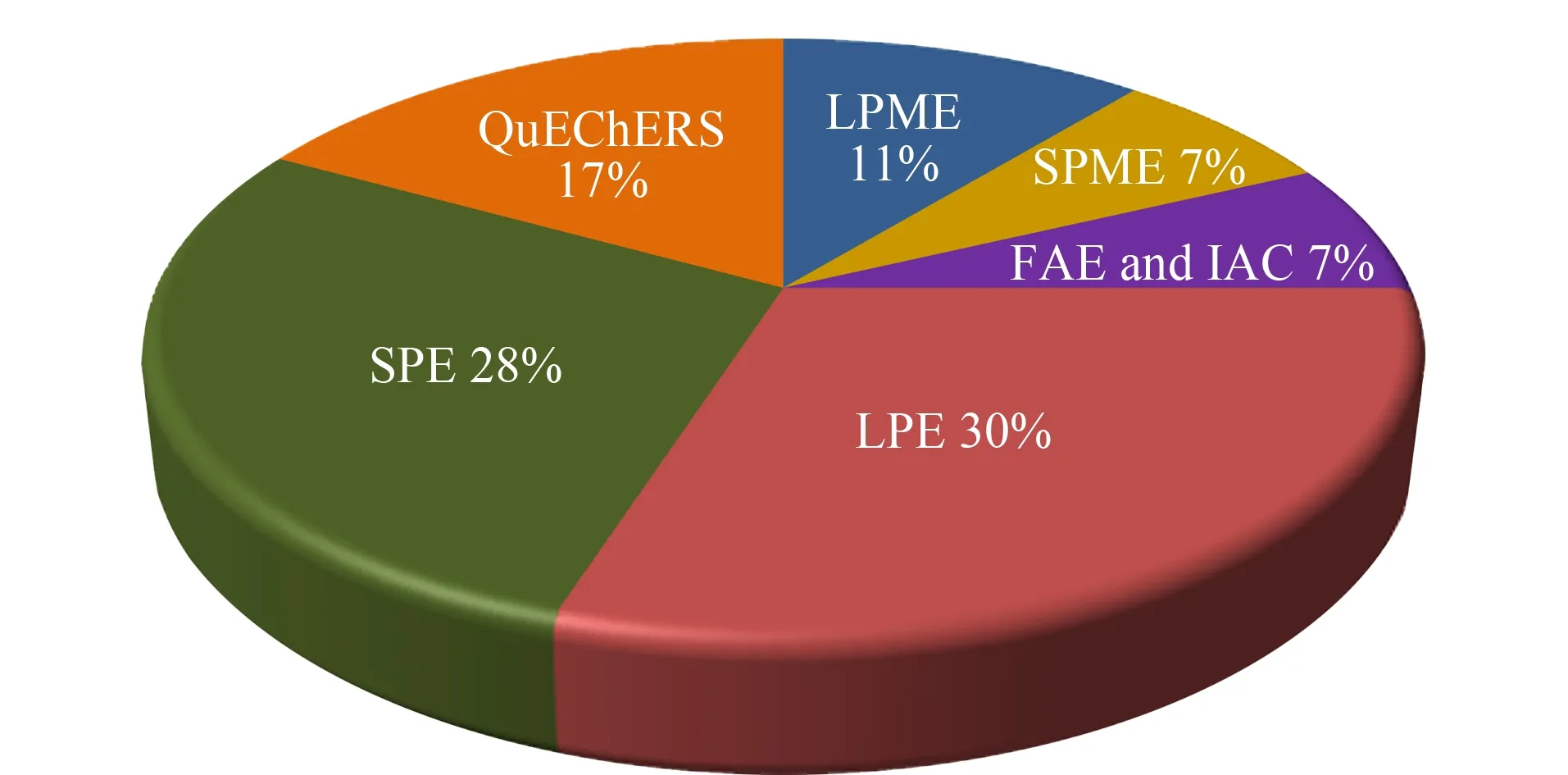
图 2 2009~2019年发表的关于食品中真菌毒素常用 样品前处理方法的文献分布Fig. 2 Distribution of literatures of different preparation methods for mycotoxins in food samples published during 2009-2019 LPE: liquid phase extraction; LPME: liquid phase microextraction; SPME: solid phase microextraction; FAE: field assist extraction; IAC: immunoaffinity chromatography.
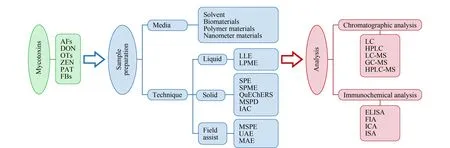
图 3 食品中主要真菌毒素的样品前处理和分析检测方法Fig. 3 Preparation methods and analytical methods for mycotoxins in foods AFs: aflatoxins; OTs: ochratoxins; FBs: fumonisins; LLE: liquid liquid extraction; MSPD: matrix solid phase dispersion; UAE: ultrasound-assisted extraction; MAE: microwave-assisted extraction; ELISA: enzyme-linked immunosorbent assay; FIA: fluorescence immuno assays; ICA: immuno chromatography assay; ISA: immunosensor assay.
目前,食品中真菌毒素的检测方法主要可以分为两大类,一类是以色谱法、色谱-质谱法为代表的分析方法,这类方法灵敏度高,准确性好,能够对真菌毒素精确定量,但样品前处理过程复杂,耗时较长,如高效液相色谱法(HPLC)、液相色谱-质谱法(LC-MS)、气相色谱-质谱法(GC-MS)等;一类是以免疫学分析方法为基础的快速分析技术,如酶联免疫分析法(ELISA)、免疫层析分析(ICA)、荧光免疫分析法(FFIA)、免疫传感分析(ISA)等,具有耗时短、检出限低等优点,但存在假阳性较高、重复性较差等缺点[22,23]。真菌毒素种类繁多,结构差异较大,含量跨度范围广,样品基质形态多样且干扰物多,这些因素制约着样品中真菌毒素的直接分析[24,25]。因此,针对不同目标、不同基质的真菌毒素,选择合适的样品前处理技术,达到分离富集待测物,消除基质干扰的目标,已成为近年来食品中真菌毒素分析的研究热点。如图1所示,2009~2019年10年间食品中真菌毒素样品前处理相关文献发表数量总体呈上升趋势,从2014年开始增长速度明显加快。目前,基于磁性纳米材料(MNPs)、分子印迹聚合物(MIPs)、石墨烯类材料(GR)、免疫亲和材料、适配体功能材料等新型分离介质而发展起来的高效样品前处理技术如固相萃取、固相微萃取、磁性固相萃取、超声辅助提取、免疫亲和层析和QuEChERS法等在食品真菌毒素样品前处理中的应用越来越多[15,26]。图2为2009~2019年间食品中真菌毒素不同样品前处理技术相关文献的发表情况。从图2中可以看出,固相萃取技术和液相萃取技术在食品真菌毒素样品前处理中应用较多,发展也较为成熟,能够适用于多种食品基质的前处理。图3简要描述了食品中主要真菌毒素的种类、常用样品前处理介质和技术,以及分析检测方法。本文对此详细综述了近几年来国内外食品中真菌毒素样品前处理方法的研究进展,以期为该领域的进一步研究提供参考。
1 样品前处理介质
在样品前处理过程中,介质通常可实现对目标物的富集提取,比如液体溶剂和固体材料,液体溶剂中水和有机溶剂应用较多,也较为传统,而固体介质种类较多,通常具有较大比表面积、多孔结构、超顺磁性、特异性识别等特点,其在食品样品前处理过程中发挥着重要作用。目前在食品真菌毒素样品前处理过程中常用的固体介质主要有纳米材料(如磁性纳米材料和石墨烯类材料等)、聚合物材料(如分子印迹聚合物材料等)和生物材料(如适配体功能化材料、免疫亲和材料等)。
1.1 纳米材料
纳米材料以其独特的物理化学性能,在很多领域都有着广泛应用,在食品真菌毒素样品前处理领域应用较多的纳米材料主要有磁性纳米材料、石墨烯材料、碳纳米管等。磁性纳米材料以其较大的吸附容量、较好的超顺磁性、较强的稳定性、易于分离、可以重复使用等优点,已逐渐应用于食品真菌毒素样品前处理过程中[27,28],而常用的磁性基础介质主要为铁的氧化物(Fe3O4)、铁合金(Fe-Co)、铁氧体(CoFe2O4)等铁磁性化合物[29]。Hu等[30]制备了一种氯化十六烷基吡啶(CPC)修饰的Fe3O4磁性纳米微球Fe3O4-SiO2NPs@CPC,用于水样中赭曲霉毒素A的分离富集,对赭曲霉毒素A的吸附能力可达5.95 mg/g,优于传统的固相萃取吸附材料。Manafi等[31]制备了一种乙二醇双巯基乙酸酯-正硅酸乙酯-四氧化三铁复合磁性纳米粒(EGBMA-TEOS-MNPs),对小麦样品中黄曲霉毒素进行萃取富集,富集因子为97,对黄曲霉毒素具有较好的富集效果。Qian等[32]开发了3种磁性纳米复合材料,磁性N-乙烯基吡咯烷酮纳米粒(MDN@Fe3O4)、3-N,N-二乙氨基修饰磁性纳米粒(PSA@Fe3O4)和二氧化锆修饰磁性纳米粒ZrO2@Fe3O4,用于分散固相萃取饲料中黄曲霉毒素、赭曲霉毒素A等13种真菌毒素,重复使用5次,回收率依然能保持80%以上。石墨烯材料、碳纳米管等新型碳纳米材料具有较大比表面积、较强吸附能力、易于功能化修饰和可重复使用等特点,在食品真菌毒素样品前处理中已有部分应用。Yu等[33]直接采用石墨烯氧化物对花生中黄曲霉毒素进行分离富集,与十八烷基硅烷键合硅胶(C18)等传统固相萃取剂相比,吸附剂使用量更少,且重复使用10次,依然具有较好的吸附效果。Jiang等[34]设计并制备了一种还原氧化石墨烯/金纳米复合物,通过引入金纳米颗粒,可以增加石墨烯层间间距,降低团聚效应,能够有效萃取牛奶中黄曲霉毒素、赭曲霉毒素A、玉米赤霉烯酮等9种真菌毒素。Moreno等[35]将多壁碳纳米管负载到C18修饰的磁性纳米粒上得到磁性多壁碳纳米管纳米复合物,用于玉米中玉米赤霉烯酮及其次级代谢产物的萃取富集,其富集因子为25,重复使用6次,仍能保持较好的提取效率。Ma等[36]以磁性多壁碳纳米管(Fe3O4-MWCNTs)作为吸附剂,能够对谷物中黄曲霉毒素、玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、T-2毒素、展青霉素等20种真菌毒素分散固相萃取,利用Fe3O4固有磁性可实现前处理中固液两相的快速分离,比C18、N-丙基乙二胺等传统固相吸附剂具有更高的富集效率和更短的前处理时间。
1.2 聚合物材料
聚合物材料在食品真菌毒素样品前处理中的应用较早,始于聚合物分离柱,近年来多集中于功能聚合物的开发及应用,其中分子印迹聚合物应用最为广泛。分子印迹聚合物材料通过引入目标物模板分子进行聚合,再对模板分子进行洗脱,并在聚合物中留下模板分子空穴结构和大小的“印迹”,这种“印迹”结构能够特异性识别目标分子及其结构类似物。因此,分子印迹聚合物具有较好的构效预定性和选择性,且耐高温,耐酸碱和有机溶剂,常用作固相萃取技术和固相微萃取技术的吸附剂[37,38]。Wei等[39]直接采用黄曲霉毒素AFB1为模板分子乳液聚合制备分子印迹聚合物,其AFB1吸附量接近非印迹聚合物的2倍,将其用于大麦、花生油、啤酒和饲料中AFB1的选择性富集,经HPLC检测,与商品化免疫亲和柱具有同样的回收效果。Szumski等[40]采用黄曲霉毒素结构类似物5,7-二甲氧基香豆素作为模板分子来代替黄曲霉毒素分子制备分子印迹聚合物,对水样中黄曲霉毒素固相萃取分离,依然具有选择性富集效果,并且结构类似物具有较低成本优势。Huang等[41]制备了一种能够选择性识别玉米赤霉烯酮的金属有机骨架-分子印迹复合物MIL-101@MIPs,对玉米赤霉烯酮的吸附量接近非印迹聚合物的2倍,可以实现谷物中玉米赤霉烯酮的萃取分离,循环使用7次,回收率仍能保持70%以上。相比传统的分子印迹聚合物,表面分子印迹具有更明显的目标分子空穴位,吸附速度也更快,Huang等[42]将分子印迹聚合物复合在埃洛石修饰的Fe3O4磁性纳米粒表面,制得具有核-壳结构的磁性分子印迹复合物SPMIPs,用于小麦样品中分散固相萃取玉米赤霉烯酮,印迹因子为2.97,同时利用磁性纳米材料易分离特性,进一步缩短了前处理时间。此外,其他一些新型功能聚合物也有用于食品基质真菌毒素样品前处理的报道,如具有高孔隙率的电纺纤维聚合物用于富集大豆中的黄曲霉毒素[43],多孔结构的笼型倍半硅氧烷聚合物辅助提取啤酒中的赭曲霉毒素A[44],这些介质的开发,进一步扩展了聚合物在食品真菌毒素样品前处理中的应用范围。
1.3 生物材料
生物类材料在食品真菌毒素样品前处理中的应用目前主要以免疫亲和材料和适配体功能化材料为主。免疫亲和材料是利用抗体和抗原之间高度特异性的亲和力以实现目标物的分离与纯化,如免疫亲和柱,具有特异性强、选择性好、富集效率高等特点[45]。Zhao等[46]在采用免疫亲和柱对食品用香料中赭曲霉毒素A选择性分离净化后,可直接采用HPLC技术检测,回收率范围为75%~102%。Vaclavikova等[47]将多毒素抗体免疫亲和柱用于样品前处理,能够实现对花生、大麦、玉米食物中黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮、T-2毒素等12种真菌毒素的同时分离纯化。Wilcox等[48]采用两组串列多毒素免疫亲和柱,提取麦片、乳清粉等多种食品基质中黄曲霉毒素、赭曲霉毒素A、伏马菌毒素、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮和T-2毒素,同样能实现多真菌毒素的同时富集。Zhang等[49]将玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、T-2毒素、HT-2毒素的单克隆抗体结合在聚苯乙烯-二乙烯基苯(PS-DVB)柱上制得多毒素抗体免疫亲和柱,并应用于面粉实际样品分析,结果表明该亲和柱可以同时提取样品中这4种真菌毒素,富集效率明显高于纯PS-DVB柱。
适配体功能化材料是利用适配体能够高特异性识别和结合靶标分子从而进行分离纯化的新型材料,具有特异性强、亲和力高、灵敏度高、靶标分子范围广和易于修饰等特点,在食品真菌毒素样品前处理中已有较多应用。如Girolamo等[50]将赭曲霉毒素A的DNA适配体与凝胶偶联制得OTA适配体固相萃取柱,用于提取小麦中赭曲霉毒素A,结果表明该适配体固相萃取柱能特异性识别与亲和小麦样液中的赭曲霉毒素A,重复使用5次,依然具有较好的特异性识别能力。Brothier等[51]制备了一种基于DNA适配体识别的赭曲霉毒素A微型毛细管提取柱,能够有效亲和啤酒基质中的赭曲霉毒素A,含量可低至纳克数量级。由于适配体较强的靶标特异性,通过适配体和其他功能材料结合,可以进一步提高分离纯化效率[52]。如Wu等[53]将赭曲霉毒素A的DNA适配体修饰在磁性纳米粒上得到适配体-磁性纳米微球吸附剂,能够对小麦粉等谷物制品中OTA选择性富集,比C18柱具有更好的萃取效果。Khodadadi等[54]将黄曲霉毒素AFM1的DNA适配体修饰在Fe3O4磁性纳米载体表面得到适配体-磁性纳米复合物(AMNPs),可以选择性富集乳制品中黄曲霉毒素AFM1,结合HPLC分析,检出限可低至0.2 ng/L,但该适配体磁性纳米复合物在目标物解吸过程中存在适配体流失,限制了其使用重复性。总之,不同的介质材料,其结构特点各有差异,具有不同的分离富集效果。表2简要总结了主要纳米材料,聚合物材料和生物材料的结构特点以及它们的主要应用食品基质。

表 2 食品真菌毒素样品前处理常用介质及其主要适用基质Table 2 Main preparation medium for mycotoxins in food samples and their applicable substrates
2 样品前处理方法
食品样品基质种类繁多,成分复杂,而样品中真菌毒素含量通常低至μg/kg数量级,甚至ng/kg数量级,直接使用分析仪器定量检测,往往无法得出准确结果。因此,在样品的分析过程中,对样品进行前处理十分必要。前处理过程可实现对目标物的提取、富集和纯化,减少杂质干扰和提高检测灵敏度。
2.1 液相萃取法
液相萃取技术利用相似相溶原理,将目标分子萃取到一种溶剂中,进而实现目标物和杂质的分离。常用的溶剂主要有甲醇、乙腈、甲苯、二氯甲烷、三氯甲烷、正己烷等有机溶剂或者由几种溶剂组合而成的复合溶剂。其中,液液萃取法是最为常用的传统液相萃取方法,具有操作简单、设备简单、广谱性好、价格低廉等优点,在真菌毒素样品前处理中应用较早,技术也较成熟。Soleimany等[55]以乙腈-乙酸-水混合液为萃取剂,一步法直接提取谷物中的黄曲霉毒素、脱氧雪腐镰刀菌烯醇、赭曲霉毒素A和玉米赤霉烯酮,然后采用LC-MS定量分析,检出限为0.01~20 ng/g,回收率为76.8%~108.4%, RSD小于12.7%。该方法能够同时提取分析多种真菌毒素,并用于大米、玉米等谷物实际样品分析。吴宇等[56]同样也以乙腈-乙酸-水混合液为萃取剂,提取植物油中的黄曲霉毒素、伏马菌毒素、脱氧雪腐镰刀菌烯醇等16种真菌毒素,然后采用低温高速离心去除提取液中的油脂,结合UPLC-MS对其检测,检出限为0.1~66.7 μg/kg,回收率为74.2%~105.6%, RSD为0.3%~13.9%,并发现低温高速离心法可以有效避免传统净化填料去除脂质过程中吸附真菌毒素而导致准确性下降的问题。
虽然液液萃取法操作简单,但过程中有机溶剂消耗量较大,容易造成目标物流失,也不利于环境保护。Jeannot等[57]对液液萃取技术进行了改进,建立了液相微萃取技术。液相微萃取技术集萃取和浓缩过程于一体,具有溶剂消耗少、富集效率高、环境友好、节约成本等优点。Somsubsin等[58]以正辛醇-甲苯混合液作为萃取剂,Na2SO4为破乳剂,采用涡旋辅助液液微萃取技术,提取大米中黄曲霉毒素,结合HPLC分析检测,检出限为0.001 1~0.17 μg/kg,回收率为70%~104%, RSD低于6.2%,同时破乳剂的加入促进了相分离,无需进一步离心分离,缩短了前处理时间。近年来,分散液液微萃取(DLLME)是一种应用广泛的液液微萃取技术,它采用喷射技术将萃取剂和分散剂快速注入样品水液中,在分散剂作用下,形成水-分散剂-萃取剂乳浊液微珠,增大了萃取剂与样液的接触面积,进而提高萃取效率。Campone等[59]以氯仿为萃取剂,甲醇为分散剂,采用涡流混合分散形成氯仿-甲醇-水萃取乳浊液微珠,分散液液微萃取玉米、小麦、大米中的黄曲霉毒素,结合HPLC检测,检出限为0.01~0.17 μg/kg,回收率为67%~92%, RSD低于10%,与标准的免疫亲和提取技术相比,具有富集倍数更高,前处理耗时更短和成本更低等优势。Sun等[60]采用压力喷射装置将乙腈-水混合萃取剂注入样液中直接形成分散性乳浊液萃取微珠,建立了一种小麦中黄曲霉毒素的DLLME-UPLC-MS分析检测方法,回收率为83.2%~93.0%, RSD低于4.6%,定量限为0.06 μg/kg,低于欧盟限量标准。此外,压力喷射直接形成分散萃取微珠,无需额外设备混合,进一步简化了前处理步骤。Wang等[61]以二氯甲烷为萃取剂,三氟乙酸为衍生化试剂,分散液液微萃取植物油中黄曲霉毒素并对其衍生化,结合HPLC分析,检出限为0.005~0.03 ng/mL,回收率为90.7%~121.5%, RSD低于11.6%,该方法集萃取与衍生于一体,节省了前处理时间。离子液体作为一种新型绿色溶剂,具有良好的化学稳定性、热稳定性以及高溶解性等特点,可代替传统有机溶剂作为萃取剂。Wang等[62]以1-丁基-3-甲基咪唑六氟磷酸盐离子液体为萃取剂,涡旋辅助分散液液微萃取玉米食品中玉米赤霉烯酮,采用HPLC检测,检出限为0.3 μg/kg,回收率为83.5%~94.9%, RSD低于5%。Lai等[63]以1-己基-3-甲基咪唑六氟磷酸盐离子液体为萃取剂,采用分散液液微萃取技术提取米酒中赭曲霉毒素A,富集因子接近30,结合HPLC检测,检出限为0.04 μg/L, RSD低于10.4%。这些应用均表明离子液体在样品前处理中具有替代部分有机萃取剂的潜力,应进一步加强研究与应用。
2.2 固相萃取法
固相萃取技术以色谱分离原理为基础,采用合适的固体吸附材料吸附样品中的目标分子,使其与其他干扰分离,然后再使目标分子从固体吸附剂中分离出来。固相萃取技术可以针对目标分子的结构和性质以及基质特点来选择合适的固体吸附剂,因而具有富集效率高、选择性较好、溶剂用量少等优点,是食品真菌毒素分析常用的样品前处理方法。Liu等[64]设计并合成了一种超支化聚合物材料用于萃取谷物中的黄曲霉毒素,结合HPLC检测,检出限为0.012~0.12 ng/g,回收率为82.7%~103%, RSD低于10%,聚合物中大量的氢键供体基团和丰富的π电子基团结构能有效键和黄曲霉毒素分子,比传统C18吸附剂具有更高的富集效率。利用石墨烯、碳纳米管等碳材料较大比表面积和良好吸附性能,可以有效富集真菌毒素,Jiang等[34]采用还原氧化石墨烯-金纳米复合物作为固相萃取吸附剂,建立了一种牛奶中黄曲霉毒素、赭曲霉毒素A、玉米赤霉烯酮等9种真菌毒素的SPE-UPLC-MS分析检测方法,定量限可低至0.02 ng/mL,回收率为70.2%~111.2%, RSD低于14.9%,该方法能同时萃取分析多种真菌毒素,并已用于60种牛奶实际样品的分析。基于分子印迹技术制备的聚合物,可以进一步提高固相萃取的选择性[65],如Rui等[66]将黄曲霉毒素分子印迹聚合物负载在介孔二氧化硅FDU-12上,得到一种介孔二氧化硅-分子印迹复合物FDU-12@MIPs,用于大米、玉米、小麦、花生和大豆中黄曲霉毒素的萃取分离,结合HPLC检测,检出限为0.05 μg/kg, RSD为2.73%~4.21%,该复合物AFs最大吸附量是非印迹聚合物的2倍多,表现出较好的选择性富集。此外,固相萃取技术还可以和液相色谱等检测仪器在线联用,如Campone等[67]以C18材料作为预柱中的固相萃取吸附剂,并和超高效液相色谱及质谱联用,建立了一种奶制品中黄曲霉毒素AFM1的在线SPE-UPLC/MS分析方法,回收率为86%~102%, RSD低于3%,定量限可低至0.5 ng/kg,远低于欧盟限量标准。Campone等[68]又建立了酒类中赭曲霉毒素A的在线SPE-HPLC-MS/MS分析方法,检出限为0.01 ng/mL, RSD低于7%,固相萃取-色谱检测在线联用技术可以减少前处理过程中目标物的流失,具有更高的检测灵敏度。
固相微萃取技术是在固相萃取技术基础上发展而来的一种新型非溶剂型固相萃取方法。Lee等[69]将聚丙烯孔膜封装在内含赭曲霉毒素A分子印迹聚合物的微萃取柱中,选择性固相微萃取咖啡和葡萄汁中的赭曲霉毒素A,甲醇-乙酸混合液超声解吸后,采用HPLC检测,检出限分别为0.06 ng/g和0.02 ng/mL,回收率为90.6%~101.5%, RSD低于2.3%,并可循环使用15次。Andrade等[70]将十八烷基硅烷颗粒内置在毛细管内作为预处理柱,建立了一种酒样中赭曲霉毒素A的在线SPME-UPLC/MS分析方法,定量限为0.02 μg/L, RSD低于6%,分析速度较快,整个分析时间仅为24 min。固相微萃取技术兼具了固相萃取技术操作简单、溶剂消耗少等优点,并进一步提高了富集效率,且体积较小,易于和液相色谱、质谱等仪器自动化联用,具有广阔的应用潜力。
2.3 场辅助提取法
场辅助提取法通过在声、磁、微波等外场的作用下,加快目标分子在样品基质和提取剂之间的传质速率,促使目标分子更快、更有效地从样品基质转移至提取剂中,进而提高提取速度,缩短前处理时间,常用的场辅助提取技术主要包括磁性固相萃取、超声辅助提取和微波辅助提取等。
磁性固相萃取是以磁性或磁化的材料作为吸附介质吸附目标分子,再在外加磁场的作用下,使目标分子与其他基质发生强化分离。相比于传统的固相萃取材料,磁性材料具有更大的表面积,更容易分离,重复使用性好和易功能化修饰等优势。Taherimaslak等[71]将3-(三甲氧基硅基)-1-丙硫醇和乙二醇双巯基乙酸酯修饰在磁性Fe3O4纳米粒上,以增大表面积,其富集因子可达57,用于萃取牛奶中黄曲霉毒素AFM1,吸附及解吸时间不到15 min,比传统的固相萃取技术耗时更短。Hu等[72]以磁性氧化物Fe3O4/NPs为核,结合分子印迹技术,制备了一种专一性的分子印迹磁性纳米复合材料OTA-Fe3O4@PDA-MIPs,能选择性萃取大米和葡萄酒中的赭曲霉毒素A,结合HPLC检测,检出限可分别低至0.001 8 μg/kg和1.8 pg/mL,回收率为71.0%~88.5%, RSD低于3.8%,并可循环使用7次。将抗体等生物识别分子修饰在磁性纳米粒上可以进一步提高选择性和富集效率,如Yu等[73]将黄曲霉毒素AFB1抗体修饰在Fe3O4纳米粒表面制得一种免疫磁性纳米粒,固相萃取植物油中的黄曲霉毒素AFB1,同时结合低温脱脂技术,有效去除植物油基体油脂杂质,荧光光谱检测,检出限低至4.8 pg/mL,回收率范围为79.6%~117.9%, RSD低于11.48%。Ye等[74]采用自制的免疫亲和磁性纳米微球IMB作为吸附剂,能够特异性亲和赭曲霉毒素A,建立了一种谷物中赭曲霉毒素A的UPLC分析方法,检出限为0.24 μg/kg,回收率为86.3%~95.4%, RSD低于7.9%,结果与标准的免疫亲和柱法具有较好的一致性,且分析速度更快。
超声辅助提取是利用超声波产生的强烈振荡和空化效应来促使目标分子不断向溶剂中迁移,进而达到目标物和杂质分离的效果。实际应用中,超声辅助提取通常与液液萃取、液液微萃取、固相萃取、固相微萃取、QuEChERS等方法联合使用。因此,相比原来单一的提取方法,超声辅助提取具有提取时间短、富集效率高和溶剂消耗少等优势。Ruan等[75]采用超声辅助-分散液液微萃取技术分离提取水果中赭曲霉毒素A和桔霉素,结合HPLC定量检测,检出限为0.06~0.16 μg/kg,回收率为75%~103%, RSD低于5.3%。与液液萃取、固相微萃取技术相比,该方法溶剂消耗更少,所需样品量更少,提取时间也更短。Porto-Figueira等[76]采用超声辅助-QuEChERS提取技术对谷物中玉米赤霉烯酮萃取富集,比单独QuEChERS技术,超声辅助提取所需溶剂和层析盐均更少。Amirkhizi等[77]同样采用超声辅助-分散液液微萃取技术,建立了一种鸡蛋中黄曲霉毒素AFB1的HPLC分析方法,检出限为0.12 μg/kg,回收率为91%~94%, RSD低于8.3%。与标准的免疫亲和柱提取法相比,该方法富集效率更高,提取速度更快,成本更低。
微波辅助提取是一种通过微波能对提取溶剂进行加热,促使目标分子从样品基质中迁移出来并进入溶剂中的萃取方法,具有加热均匀、提取速度快等特点。Chen等[78]以乙腈为提取溶剂,采用微波辅助-固相萃取技术提取玉米和大麦中的黄曲霉毒素,采用LC检测,检出限为0.04~0.08 μg/kg,回收率为88.1%~105.7%, RSD低于8.7%,并用于当地市场上36种玉米和小麦的分析。Du等[79]采用微波辅助-固相微萃取技术,富集桃仁、奶粉、玉米粉和啤酒中的黄曲霉毒素AFB1、伏马菌毒素、赭曲霉毒素B、T-2毒素和玉米赤霉烯酮6种真菌毒素,三氯甲烷解吸后,采用超高效液相色谱-四极杆飞行时间质谱(UHPLC-Q-TOF/MS)检测,固体样品中真菌毒素检出限为0.003 6~0.033 μg/kg,啤酒中真菌毒素检出限为0.002 2~0.017 ng/mL,回收率为84.27%~104.96%, RSD低于2.76%。与SPE-UPLC-MS、DLLME-HPLC分析方法相比,该方法萃取时间更短,溶剂消耗更少,检出限更低。
2.4 其他样品前处理方法
除上述样品前处理技术以外,还有部分新发展的技术,如QuEChERS法、免疫亲和柱法和基质固相分散技术等。QuEChERS法最早由Anastassiades在2003年提出,通过利用吸附剂填料与样品基质中的杂质相互作用来吸附杂质,进而达到除杂净化的目的。QuEChERS技术主要包括乙腈提取、盐析分层、吸附除杂3个过程,是一种集快速、简单、便宜、有效、可靠、安全于一体的样品前处理技术[80]。Pereira等[81]以乙腈水溶液为提取剂,硫酸镁和氯化钠为盐析剂,N-丙基乙二胺为固相吸附剂,采用QuEChERS技术,提取麦粉等婴儿食品中12种单端孢霉烯族毒素,比免疫亲和柱提取速度更快,成本更低。Rodriguez-Carrasco等[82]采用乙腈水溶液对样液进行提取,硫酸镁和氯化钠盐析后,再用C18吸附净化,采用气相色谱-三重四极杆质谱(GC-QqQ-MS)检测,建立了一种小麦粉中玉米赤霉烯酮、展青霉毒素、单端孢霉烯族毒素等10种真菌毒素的QuEChERS-GC-QqQ-MS分析方法,回收率为74%~124%, RSD低于17%,定量限为1.25 μg/kg,低于欧盟规定的最大残留量,并用于15种实际样品的分析检测。此外,由于QuEChERS技术较强的通用性,还可以应用于咖啡、酒、植物油等多种食品基质中真菌毒素的提取[83-86]。将QuEChERS技术与其他前处理技术结合使用,能进一步提高富集效率和检测灵敏度,如Arroyo-Manzanares等[87]先采用QuEChERS技术对样品液预处理,再用分散液液微萃取技术进一步富集,建立了一种牛奶蓟中黄曲霉毒素、赭曲霉毒素、脱氧雪腐镰刀菌烯醇等14种真菌毒素的UPLC-MS分析方法,检出限为0.56 μg/kg, RSD低于10%。两种前处理技术的结合使用,实现了食品中更多种类的真菌毒素提取与分析。Gonzalez-Jartin等[88]将QuEChERS技术和分散固相提取技术结合使用,建立了一种啤酒中黄曲霉毒素、赭曲霉毒素、脱氧雪腐镰刀菌烯醇等23种真菌毒素的UPLC-MS分析方法,回收率为70%~110%, RSD低于5.5%,定量限为0.038 μg/L,具有较好的灵敏度和精密度。总之,QuEChERS技术不受样品基质状态的限制,能够对多种目标物同时提取分析,还可以和液相萃取、固相萃取、固相微萃取等技术联合使用,纯化速度快,兼容对象多,灵活性强,在食品真菌毒素样品前处理领域应用越来越广。
免疫亲和柱法是一种以抗体与抗原特异性结合为基础的新型固相萃取技术,其过程一般包括溶解、捕获、洗脱与纯化3个步骤,具有特异性强、选择性好、富集效率高等特点,且部分真菌毒素的免疫亲和柱已实现商品化。如Ossa等[89]先对雪糕样液低温离心脱脂后,采用商品化的免疫亲和柱选择性富集雪糕中的黄曲霉毒素AFM1,再用甲醇-乙腈混合液洗脱,结合UPLC-MS检测,检出限可低至0.4 ng/kg。Shuib等[90]对牛奶样液离心脱脂后,采用AFLATEST免疫亲和柱选择性提取、甲醇洗脱的前处理方法,建立了一种乳制品中黄曲霉毒素AFM1的柱后光化学衍生-HPLC分析方法,回收率为85.2%~107.0%, RSD低于7%,定量限为0.004 μg/L,远低于0.025 μg/L的欧盟限量标准,同时在线紫外光衍生技术的使用,进一步提高了检测灵敏度,并已用于牛奶、羊乳、婴儿奶粉等20种实际样品的分析。将多种真菌毒素抗体修饰在免疫亲和柱上可实现黄曲霉毒素、赭曲霉毒素、伏马菌毒素等多种真菌毒素的同时富集[46,91],如Zhang等[92]将黄曲霉毒素、赭曲霉毒素A、玉米赤霉烯酮、T-2毒素的单克隆抗体结合在琼脂凝胶上制得多毒素抗体复合免疫亲和柱mIAC,用于富集花生、玉米、小麦农产品中的真菌毒素,整个过程仅用2 min,提取速度快,结合HPLC-MS检测,检出限为0.04~0.4 μg/kg,回收率为98.8%~102.3%, RSD低于3.95%,灵敏度较高,重现性也较好。Hu等[93]采用自制的黄曲霉毒素、玉米赤霉烯酮、赭曲霉毒素A、杂色曲霉素等8种真菌毒素的单克隆抗体复合免疫亲和柱,建立了一种饲料中8种真菌毒素的UPLC-MS分析方法,检出限为0.006~0.12 ng/mL,回收率为91.2%~104.1%, RSD低于10%,比商品化免疫亲和柱富集真菌毒素种类更多,灵敏度更高,该方法已用于当地市场80种实际饲料样品的分析。尽管IAC相比SPE具有更好的选择性,更高的富集效率,但存在稳定性较差、价格昂贵、重复利用率低等问题,这些也制约着免疫亲和柱法在实际中更为广泛的应用。
基质固相分散提取技术通过将固态或黏稠态样品与固相分散剂一起研磨粉碎,使样品基质分散在固体分散剂的表面,然后将混合物转移到固相萃取柱中,最后选择合适的溶剂将目标物洗脱下来。Oliveira等[94]以硅胶作为固相分散剂,甲酸铵缓冲液为洗脱剂,采用基质固相分散萃取技术,提取玉米、玉米爆米花及玉米燕麦粉中伏马菌毒素B1和B2,整个过程操作简单,溶剂消耗也较少。Rubert等[95]以十八烷基硅烷作为固相分散剂,甲醇-乙腈混合液为洗脱剂,建立了一种谷物中黄曲霉毒素、赭曲霉毒素A、白僵菌毒素等真菌毒素的MSPD-LC-MS分析方法,回收率为68.7%~89.6%, RSD低于14%,检出限可低至0.1 ng/g,远低于欧盟限量标准,并用于大米、小麦、玉米等49种实际样品的分析。Wu等[96]以硅胶和硅藻土作为固体分散剂,四丁基氯化铵-乙醇混合液为低共熔溶剂,开发了一种低共熔溶剂介入-基质固相分散提取(DES-MSPD)技术,用于提取花生、小米、火麻仁中的黄曲霉毒素,结合HPLC检测,检出限为0.03~0.1 μg/kg,回收率为90%~105%, RSD低于7.5%,低共溶剂的介入进一步拓展了其分散性,比C18和N-丙基乙二胺固相分散剂具有更好的富集效果。基质固相分散提取技术将提取和纯化浓缩于一体,无需样品溶解和匀化,可以减少溶剂消耗和简化前处理过程,特别适合固态和黏稠态样品待测物提取净化。
3 结论与展望
真菌毒素作为一种高毒性物质,因其存在范围广、污染频率高,可以通过多种渠道多种方式进入各类食品当中,对人类健康安全构成严重隐患而受到广泛关注。由于食品基质种类繁多、基质构成组分复杂、真菌毒素含量低、多种真菌毒素同时共存等诸多问题,食品样品中真菌毒素的直接分析检测面临挑战。虽然已开发多种分离富集技术应用于复杂食品样品的前处理,但依然面临很多限制,如液相萃取技术的溶剂消耗量大,富集效率较低,固相萃取技术耗时较长,吸附剂制备繁琐,而免疫亲和技术成本较高,通量较低。因此,开发高选择性、高通量、高效环保、低成本的前处理技术依然是食品真菌毒素分析的重要研究内容,同时发展结合高效样品前处理-灵敏检测技术于一体的联用技术也是未来的重要研究方向。

