联合检测肿瘤标志物与炎症指标对结直肠癌的诊断价值*
吕智豪,刘华熙,郭昌,梁裕琪,李慧璇,文彬,胡丰良
(1.广州中医药大学第一临床医学院,广东 广州 510405;2.南方医科大学中医药学院,广东 广州 510515;3.广州中医药大学 科技创新中心,广东 广州 510405;4.广州中医药大学第一附属医院,广东 广州 510405)
结直肠癌是人类最常见的恶性肿瘤之一,发病率及病死率均居消化道恶性肿瘤第1 位[1-2]。由于早期起病隐匿且无明显特异性临床表现,相当数量的患者确诊时已处于疾病中晚期。因此,寻找安全、便捷、经济的早期筛查项目,对提高结直肠癌患者早期检出率,具有十分重要的临床意义。
目前,血清肿瘤标志物如癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)为最常见的实验室检查手段,已被广泛运用于结直肠癌的早期诊断和预后评估[3-5],中国结直肠癌诊疗规范(2017 版)明确指出结直肠癌患者在诊断及治疗前必须检查血清CEA 和CA19-9含量[6]。外周血中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、血小板/ 淋巴细胞比值(platelet to lymphocyte ratio, PLR)作为评价全身免疫与炎症反应的重要指标,被认为在肿瘤患者的诊断和预后上存在一定价值[7-10]。
本研究对比分析肿瘤标志物及炎症指标的临床病理特征,且通过分析CEA、CA19-9 用于诊断结直肠癌的假阴性率(即漏诊率),高低不同组别NLR 及PLR 的临床病理因素,确定联合检测指标并探讨联合检测对预测结直肠癌患者术后远处转移的临床价值,以期为结直肠癌的早期诊断、预测结直肠癌患者的TNM 分期及制定个体化治疗方案提供临床依据。
1 资料与方法
1.1 一般资料
本研究纳入的资料包括两部分:①2016年1月—2018年11月在广州中医药大学第一附属医院肛肠科住院行手术治疗的158 例结直肠癌患者的回顾性临床资料;②从癌症基因组图谱数据库(The Cancer Genome Atlas, TCGA)中按照纳入与排除标准匹配出的316 例结直肠癌患者的临床资料,包括其基本信息、病理特征、CEA 结果等。纳入研究的158 例患者资料均通过医院电子病历系统收集,包括术前CEA、CA19-9、中性粒细胞、血小板及淋巴细胞结果。通过术前全腹增强CT、盆腔增强MRI 等影像学结果判断有无原发肿瘤远处转移。按照美国癌症联合会/国际抗癌联盟中结直肠癌TNM 分期系统(2017)对术后结直肠癌组织病理结果进行TNM 分期[11]。纳入标准:①术前行结肠镜检查并经肠镜病理证实为结直肠癌;②行腹腔镜下结直肠癌根治性手术;③术前未行任何放化疗;④淋巴结清扫数目≥12 枚;⑤术后组织病理结果证实为结直肠中分化腺癌。排除标准:①非初次诊断结直肠癌;②术前3 周内患感染性疾病或有发热等体征;③术前有心力衰竭、肾衰竭或呼吸衰竭等重大内科疾病;④临床资料不完整。
1.2 研究方法
患者均于入院第2 天晨起空腹抽取静脉血并送本院检验科分析,中性粒细胞、淋巴细胞及血小板检测均采用全自动血细胞分析仪(CAL 8000 系列,深圳迈瑞生物医疗电子股份有限公司),根据以上结果计算出NLR 及PLR;CEA 及CA19-9 检测均采用电化学发光自动分析仪(Cobase 601 型,上海罗氏制药有限公司),CEA<5 ng/ml 及CA19-9<27 u/ml 视为正常范围。所有患者入院1 周内完善心脏彩超与肺通气功能检查评估心肺功能,结肠镜、全腹增强CT 及盆腔增强MRI 检查评估是否伴有肿瘤远处脏器转移,并由同一手术团队行腹腔镜下结直肠癌根治性手术。
1.3 统计学方法
数据分析采用SPSS 25.0 统计软件,计量资料以中位数和四分位数[M(P25,P75)]表示,比较采用Kruskal-Wallis 检验;计数资料以例(%)表示,比较采用χ2检验;各肿瘤标志物和炎症指标与TNM 分期的相关性采用Spearman 秩相关检验;运用受试者工作特征(receiver operating characteristic, ROC)曲线对预测TNM 分期有意义的实验室指标进一步进行联合诊断效能分析[12-13],P<0.05 为差异有统计学意义。
2 结果
2.1 结直肠癌临床分期与肿瘤标志物及炎症指标的关系
依据临床分期将158 例结直肠癌患者分组。不同分期患者CEA 和NLR 值比较,差异有统计学意义(P<0.05),随着临床分期的增加,CEA 和NLR 值呈上升趋势;而CA19-9 及PLR 值与结直肠癌临床分期间差异无统计学意义(P>0.05)(见表1)。Spearman 秩相关检验结果显示,CEA 与结直肠癌临床分期具有相关性(P<0.05)。见表2。
2.2 影响CEA 及CA19-9 假阴性率的临床病理因素
CEA 在回顾性研究及TCGA 数据库中的假阴性率分别为51.90%和48.42%,两者综合假阴性率为49.58%。不同年龄及性别结直肠癌患者的CEA 假阴性率比较,差异无统计学意义(P>0.05)。回顾性研究及TCGA 两组数据中,肿瘤浸润深度、淋巴结转移、远处转移、临床分期都影响CEA 的假阴性率(P<0.05),随着肿瘤进展,浸润较深、淋巴结转移、远处转移及临床分期较晚的患者CEA 假阴性率均降低。见表3。

表1 结直肠癌临床分期与肿瘤标志物及炎症指标的关系 [M(P25,P75)]

表2 肿瘤标志物及炎症指标与结直肠癌临床分期的Spearman 秩相关检验
CA19-9 假阴性率为72.78%。不同年龄及性别结直肠癌患者的CA19-9 假阴性率比较,差异无统计学意义(P>0.05),且肿瘤浸润深度、淋巴结转移、临床分期的CA19-9 假阴性率比较,差异无统计学意义(P>0.05),而具有肿瘤远处转移者的CA19-9 假阴性率低于无肿瘤远处转移者(P<0.05)(见表3)。TCGA 数据库无CA19-9 这一指标,因此本研究未对该指标作比较。
2.3 NLR 及PLR 与临床病理因素的关系
2.3.1 NLR 及PLR 最佳截断值及分组依据 NLR及PLR 的最佳截断值运用ROC 曲线确定,当NLR 及PLR 分别为2.60 及63.33 时,得到约登指数最大值分别为0.272 及0.231,故取2.60 为NLR 最佳截断值(敏感性为0.593,特异性为0.679,取63.33 为PLR 最佳截断值(敏感性为0.527,特异性为0.704),根据上述截断值,将患者分为低NLR 组(NLR<2.60)与高NLR 组(NLR ≥2.60),低PLR 组(PLR<63.33)与高PLR 组(PLR ≥63.33)。见图1、2。
2.3.2 影响NLR 及PLR 的临床病理因素 对比不同NLR 及PLR 分组与结直肠癌患者临床病理因素之间的关系,结果显示:低NLR 组患者性别及年龄与高NLR 组比较,差异无统计学意义(P>0.05);低NLR组肿瘤浸润深度、淋巴结转移、远处转移、临床分期与高NLR 组比较,差异有统计学意义(P<0.05)。低PLR 组年龄、肿瘤浸润深度、淋巴结转移、临床分期与高PLR 组比较,差异无统计学意义(P>0.05);低PLR 组性别及远处转移与高PLR 组比较,差异有统计学意义(P<0.05)。见表4。

表3 结直肠癌患者临床病理特征对CEA 及CA19-9 假阴性率的影响
2.4 CEA 与NLR 联合检测结直肠癌远处转移的效能分析
根据上述研究结果,选取肿瘤标志物中的CEA 与炎症指标中的NLR,运用ROC 曲线分析两者联合用于预测结直肠癌远处转移的效能。结果显示,CEA 与NLR 预测结直肠癌远处转移的曲线下面积(area under curve, AUC)分别为0.731 和0.635;依据此ROC曲线按照约登指数确定CEA 与NLR 的最大值分别为7.76 和2.60。
将CEA ≥7.76 及NLR ≥2.60 定 义 为 有 效 值,将CEA<7.76 及NLR<2.60 定义为无效值,按照CEA ≥7.76 及CEA<7.76;NLR ≥2.60 及NLR<2.60;CEA ≥7.76 且NLR ≥2.60,CEA ≥7.76 或NLR ≥2.60,CEA<7.76 且NLR<2.60 分 组 绘 制ROC 曲 线 并 进 行AUC 比较。结果提示CEA 与NLR 两者联合检测的AUC 值高于单独检测。见表5 和图3。
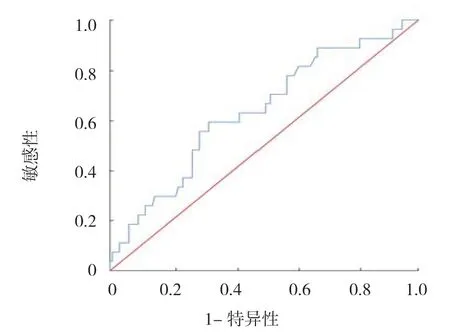
图1 确定NLR 最佳截断值的ROC 曲线

图2 确定PLR 最佳截断值的ROC 曲线

表4 NLR、PLR 与结直肠癌患者临床病理特征的关系

表5 CEA、NLR 及两者联合对结直肠癌远处转移的检验效能

图3 CEA、NLR 及两者联合对结直肠癌远处转移的检验效能
血清肿瘤标志物作为非侵入性肿瘤筛查方法,已被广泛应用于临床诊断和预后评估,为制定个体化治疗方案提供依据。CEA 及CA19-9 均属于非特异性肿瘤相关抗原,在多种肿瘤的诊断中具有重要意义:CEA 表达升高多见于消化道恶性肿瘤,是美国国立综合癌症网络指南中唯一推荐用于结直肠癌常规筛查的肿瘤标志物[14]。TOMITA 等[15]研究发现血清CEA 水平升高的非小细胞肺癌患者,其5年生存率较血清CEA 水平正常的患者下降46.2%。而在乳腺癌患者中,CEA 水平可以作为腋窝淋巴结是否转移的预测指标[16]。CA19-9 与结直肠癌、胰腺癌及胃癌等多种癌症相关,也可见于良性疾病如器官炎症、病理性黄疸等[17]。一项包含2 316 例患者的Meta 分析提示CA19-9 诊断胰腺癌的敏感性及特异性均高达80%[18]。相关研究提示,胃癌患者发生淋巴结及腹膜转移时血清CA19-9 升高,故CA19-9 可在胃癌患者行根治手术前预测其术后是否合并淋巴结转移[19]。炎症与肿瘤进展密切相关,多种恶性肿瘤起源于炎症因子的刺激[20]。NLR 是一种反映抗肿瘤炎症过程与促肿瘤炎症过程的动态平衡指标,其比值增大说明机体抗肿瘤能力下降,炎症反应向促进肿瘤生长的方向发展,从而引起肿瘤侵袭和转移[21-22]。PLR 是一种反映血栓形成和炎症过程的指标,其比值升高可能与肿瘤患者较短的生存期相关[23]。
本研究发现,CEA 及NLR 诊断结直肠癌的ROC曲线下面积分别为0.731 和0.635,说明诊断准确性较高,具有一定临床意义,因此本研究联合诊断分析仅纳入CEA 及NLR 2 项指标。此外,值得一提的是,本研究提示女性结直肠癌患者PLR 值较男性高。然而,目前尚无研究报道肿瘤患者PLR 值与患者性别的相关性,故本结论需要更多大样本,多中心研究的结果以判别其真实性及可靠性。
本文分析CEA、CA19-9 等血清肿瘤标志物及NLR、PLR 等炎症指标在结直肠癌诊断中的作用及与结直肠肿瘤分化程度、淋巴结转移、远处转移的关系。结果显示:①单用肿瘤标志物运用于结直肠癌的诊断时漏诊率较高,且CA19-9 漏诊率(72.78%)高于CEA 漏诊率(49.58%)。②随着肿瘤进展,CEA 及NLR 的数值在分期较晚、肿瘤浸润较深、存在淋巴结或远处脏器转移患者中均升高。③CA19-9 及PLR 的升高提示结直肠癌患者存在远处脏器转移可能,且女性患者可能与高PLR 值相关。④CEA 与NLR 联合检测具有较好地预测结直肠癌远处脏器转移的作用。
综上所述,作为非侵入性检查手段,肿瘤标志物及炎症指标可以互为补充,联合检测,在提高结直肠癌诊断率及预测结直肠癌根治术后患者TNM 分期上具有重要作用。此外,结直肠癌根治术后患者需定期复查费用高昂的结肠镜及CT、MRI 等影像学检查,本研究结论可在患者复查频率的确定上提供指导作用,进而制定经济、高效的个体化治疗方法,在提高结直肠癌患者整体生存率方面具有一定临床意义。

