酢浆草体外抗炎抗氧化检测方法的建立和优化
冯 倩,陈,蔡忠贞,王 琳,白雪梅
(新绎健康科技有限公司生命科技研究院,河北 廊坊 065001)
抗炎效果作为药物作用的重要反应,常被作为药物应用的关键考量指标。目前常用抗炎效果检测方法有2种;第1种是通过脂多糖(LPS)体外刺激小鼠腹腔巨噬细胞建立细胞炎症模型,采用Griess法检测细胞培养上清液中一氧化氮(NO)的含量,采用酶联免疫吸附(ELISA)法检测上清液中肿瘤坏死因子-α(TNF-α)、前列腺素E2(PGE2)的含量,实时荧光定量RT-PCR法检测TNF-α、诱导型一氧化氮合酶(iNOS)及环氧合酶2(COX-2)mRNA表达[1-3],细胞实验操作烦琐,且细胞活性与状态会影响检测结果;第2种是二甲苯致小鼠耳肿胀度和对醋酸诱发的小鼠扭体反应、冰醋酸所致小鼠血管通透性实验模型检测抗炎作用[4-5]。动物实验在体检测,操作复杂,存在个体差异,且由于动物实验所存在的伦理问题及国际上对动物福利的日益关注,发展新的体外实验方法,以减少、优化和替代(reduction,refinement,replacement,3R理论)动物实验成为当前研究的热点[6]。酢浆草[7]抗炎作用虽有诸多研究[8-9],但建立快速、简便的检测方法,实现离体检测,判断药物抗炎活性将成为药物评估的重要手段。本研究中以酢浆草为材料,优化和建立抗氧化活性、蛋白变性抑制活性和酶活性抑制活性的检测方法,对比其不同提取方法的药物活性、不同保存条件及保存效果,实现体外快速、准确对比和筛选药物,判断药物抗炎效果,对于快速评估药物具有重大意义。现报道如下。
1 材料与方法
1.1 仪器与试药
仪器:AB265-S型电子分析天平(梅特勒-托利多仪器有限公司);DE-500g型万能高速粉碎机(浙江红景天工贸有限公司);DH6-903385-Ⅲ型电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司);UV2550型紫外可见分光光度计(日本岛津公司)。
试药:酢浆草(脱水干货,购自河北保定);95%乙醇,70%高氯酸,盐酸(北京化工厂);胰蛋白酶1∶250(北京博奥拓科技有限公司);牛血清白蛋白(BSA,北京科海荣京生物科技公司);酪蛋白(美国Sigma公司);1,1-二苯基-2-三硝基苯肼(DPPH,上海麦克林生化科技有限公司)。
1.2 方法
1.2.1 酢浆草前处理
酢浆草干货用粉碎机粉碎成2 mm大小粉末,密封待用。
1.2.2 提取液制备
醇提水沉法:取40 g酢浆草粉末,精密称定,加入130 mL 95%乙醇,置500 mL三角瓶中浸泡过夜,用500目绢筛滤去残渣,滤液采用0.8μm醋酸纤维滤膜真空抽滤,澄清滤液置玻璃蒸发皿中60℃过夜烘干,加水溶解至10 mL,作为提取原液1号。取提取原液1号3 mL,加水稀释至40 mL(出现颗粒不溶物),采用0.8μm醋酸纤维滤膜真空抽滤,将滤液再加入40 mL水,混匀,再次真空抽滤,除去脂溶性色素(叶绿素、叶黄素、胡萝卜素等),澄清滤液置玻璃比色皿中60℃过夜烘干,加20 mL水重新悬浮,采用0.8μm醋酸纤维滤膜真空抽滤,即得20 mL醇提水沉提取液2号。
水提醇沉法:取40 g酢浆草粉末,精密称定,加入130 mL水,置500 mL三角瓶中浸泡过夜,用500目绢筛滤去残渣,置玻璃蒸发皿中60℃过夜烘干,加水溶解至15 mL,加入95%乙醇40 mL,用500目绢筛滤去不溶物,采用0.8μm醋酸纤维滤膜真空抽滤,将澄清滤液置玻璃比色皿中60℃过夜烘干,加10 mL水重新悬浮,采用0.8μm醋酸纤维滤膜真空抽滤,除去不溶物,即得10 mL水提醇沉提取原液a号。取提取原液a号3 mL,加水稀释至40 mL(出现颗粒不溶物),采用0.8μm醋酸纤维滤膜真空抽滤,将滤液再加入40 mL水,混匀,再次真空抽滤,澄清滤液置玻璃比色皿中60℃过夜烘干,加20 mL水重新悬浮,采用0.8μm醋酸纤维滤膜真空抽滤,即得20 mL醇提水沉提取液b号。
1.2.3 检测方法
抗氧化性成分:参考DPPH[10]法检测、优化和改进。用无水乙醇配置0.1 mmol/L的DPPH溶液,避光保存。将2 mL测试样品溶液及2 mL DPPH溶液加入同一试管中,摇匀,室温下暗处静置30 min后测定其在517 nm波长处的样品吸光度,测定前采用相应样品用蒸馏水1∶1稀释后调零,同时测定2 mL DPPH溶液与2 mL蒸馏水混合反应后的对照吸光度,采用蒸馏水调零。自由基清除能力以清除率表示。清除率(%)=(对照吸光度-样品吸光度)×100/对照吸光度。
蛋白变性抑制成分:参考抑制透明质酸酶能力测定方法[11]优化和改进。1 mL测试样品溶液加入1 mL 1%牛血清白蛋白,37℃反应20 min,57℃热蛋白变性20 min,反应液在660 nm波长处测定吸光度,做3个平行样。对照组测试液用0.9%氯化钠溶液代替,对照组用0.9%氯化钠溶液调零。测试样品用测试液1 mL加0.9%氯化钠溶液1 mL调零,排除样品色素干扰问题。计算抑制比率。抑制比率(%)=(对照吸光度-样品吸光度)×100/对照吸光度。
酶活性抑制成分:参考抑制白蛋白变性能力测定方法[12]优化和改进。0.06 mg胰蛋白酶加入1 mL 20 mmol/L Tris HCl缓冲液(pH=7.4)加入1 mL测试样品,37℃反应5 min,加入1 mL 0.8%酪蛋白,37℃反应20 min,加入2 mL 70%高氯酸终止反应,离心,上清液用Tris HCl稀释100倍后于210 nm波长处测定吸光度。对照组测试液用Tris HCl缓冲液代替,对照组用缓冲液稀释100倍调零。测试样品用测试液+4 mL缓冲液后稀释100倍调零。20 mmol/L Tris HCl配制方法,0.242 g Tris溶解至50 mL水中,后用HCl调pH至7.4,加水定容至100 mL。0.8%酪蛋白配制方法,0.8 g酪蛋白加水100 mL,定容至100 mL。同法计算抑制比率。
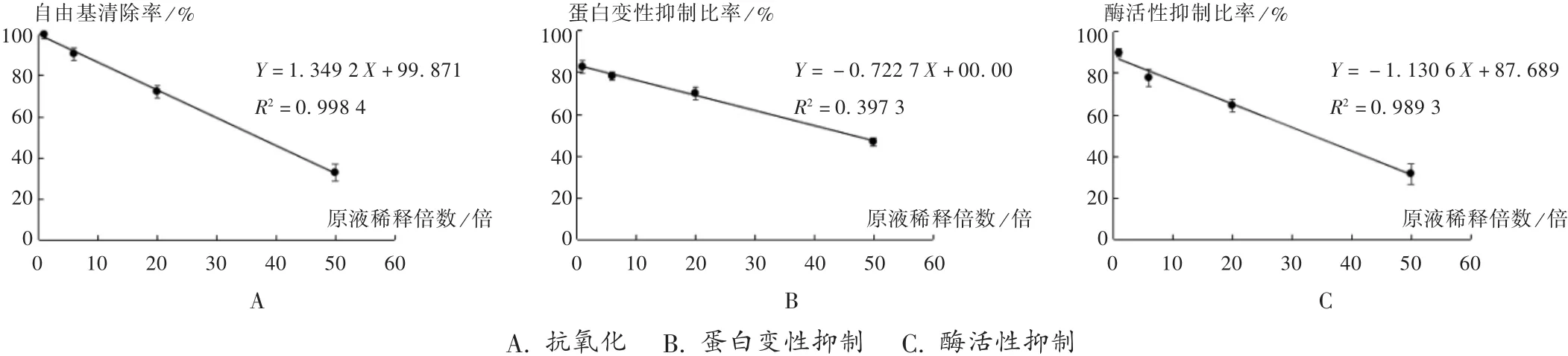
图1 不同浓度酢浆草提取液活性检测
2 结果
2.1 酢浆草不同浓度提取液活性
通过优化检测方法的操作条件和背景噪音去除方法,在传统检测方法的基础上获得了可用于药物活性检测的更佳方法,检测不同稀释度的酢浆草醇提水沉提取液抗氧化性、蛋白变性抑制、酶活性抑制成分。结果见图1,抑制比率与稀释度呈线性关系,表明检测方法能很好地反映相应组分的含量变化,可用于药物有效成分的定量分析。
2.2 不同提取方法对酢浆草有效成分的影响
药物溶剂提取法是选用适当的溶剂将中药化学成分从药材中提取出来。醇提水沉法先用适宜浓度的乙醇提取药材成分,回收乙醇后,加适量水搅匀,静置,冷藏,沉淀完全后滤除。药材以乙醇为溶剂提取,可避免淀粉、蛋白质、黏液质等成分浸出,加水处理后可除去醇提液中树脂、脂溶性色素等杂质。应用此法应慎重,避免醇溶性有效成分水溶性差而被除去。水提醇沉法中药水提浓缩液中,加入乙醇,使其达到不同含醇量,某些药物成分在乙醇溶液中溶解度降低,析出沉淀,固液分离后水提液得以精制。两者在有机溶剂使用量和提取效果上有一定差异,对比差异详见表1。可见,2种提取方法对酢浆草抗氧化、蛋白变性抑制和酶活性抑制影响差异不大。
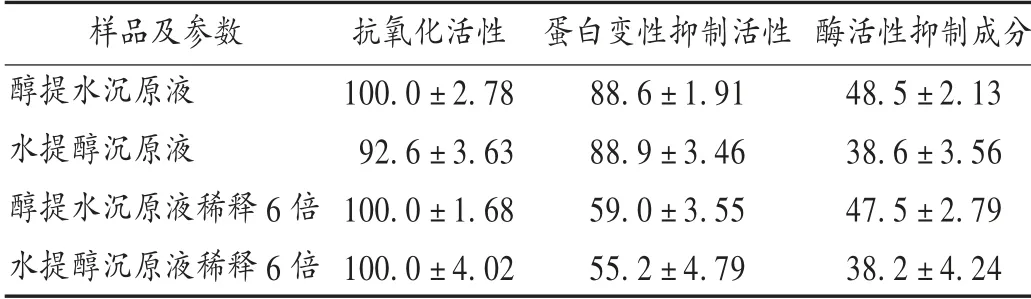
表1 不同提取方法对酢浆草抗氧化活性、蛋白变性抑制及酶活性抑制成分比较(X±s,%)
醇提水沉和水提醇沉成分高效液相色谱(HPLC)图比较见图2。可见,2种提取物出峰位置基本一致,水提取物的峰面积较95%乙醇提取物大,表明2种提取方法在成分含量上有一定差异。但抗氧化作用、酶活性抑制和蛋白变性抑制效果相差不大,可能与2种提取液有效成分含量均处于上限有关,但醇提水沉法操作更简便。
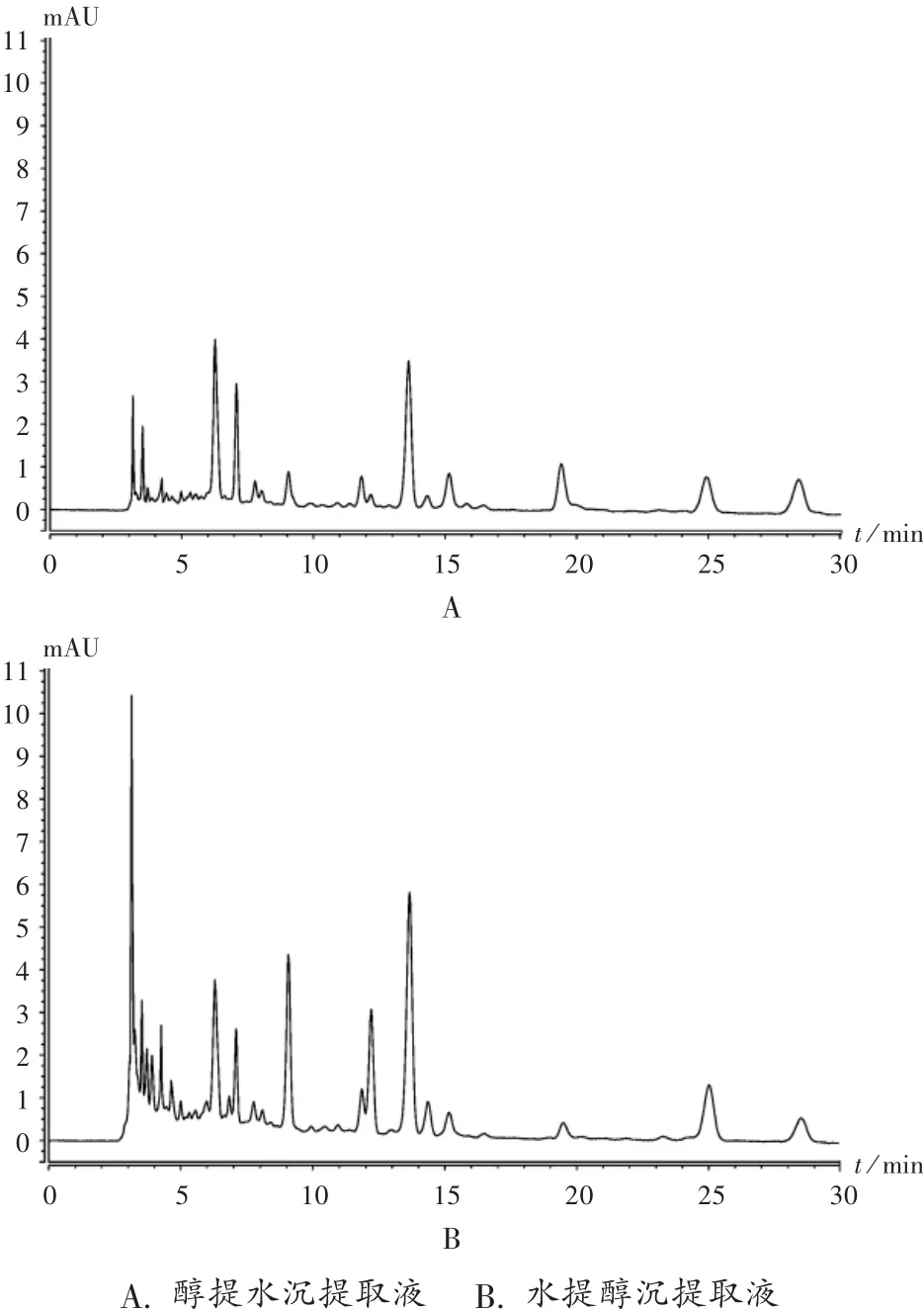
图2 酢浆草提取液高效液相色谱图
2.3 酢浆草提取液保存条件及效果
提取液的保存方法和效果可影响后续分析和使用,保存方法包括4℃冷藏和室温25℃。对醇提水沉提取液的保存效果进行检测,结果见图3。可见,蛋白变性抑制成分在不同保存条件3 d时均下降40%,7 d时无活性;酶活性抑制成分在冷藏时下降比室温条件慢,在7 d时分别下降30%和60%;抗氧化成分在2种保存条件下均有较高活性,性状稳定。室温长时间保存有一定活性成分损失,最佳使用时间在3 d内,推荐冷藏保存。
3 讨论
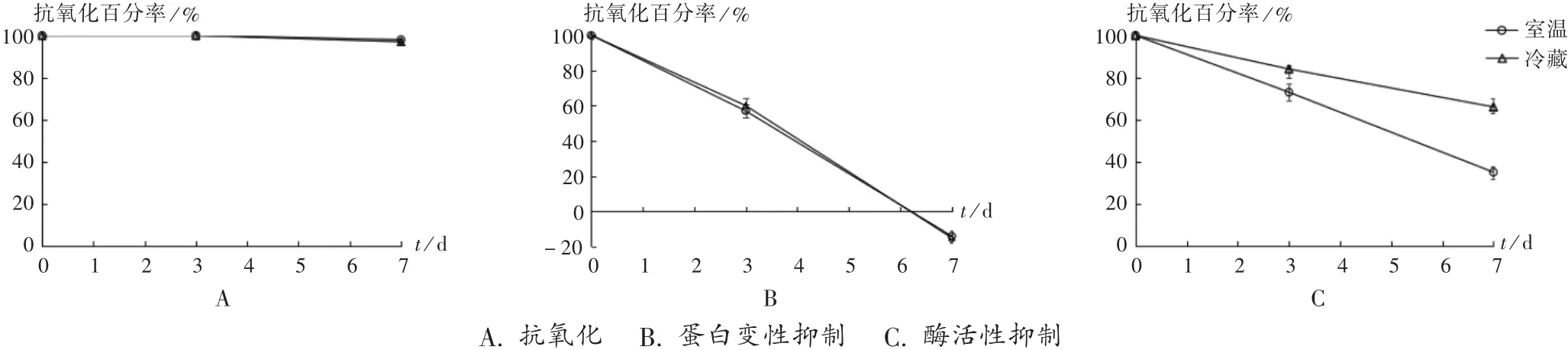
图3 酢浆草提取液不同保存条件活性比较
DPPH法广泛用于定量测定生物试样和食品的抗氧化能力[10],是根据DPPH自由基有单电子,在517 nm波长处有强吸收,醇溶液呈紫色的特性。当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用分光光度计进行快速定量分析。蛋白变性效果通过检测牛血清白蛋白在高温变性后的吸光度变化来计算,检测样品与蛋白作用后引起蛋白变性效果发生的变化,以对照组与样品组吸光度的差异来计算样品对蛋白变性抑制的效果,该方法操作简单,且稳定可控。
蛋白酶在一定条件下不仅能水解蛋白质的肽键,也能水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及脂类化合物作为底物来测定蛋白酶的活力。以酪蛋白为底物可测定微生物蛋白酶水解肽键的活力,经蛋白酶作用后降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽则沉淀,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸溶液中的肽的数量与酶的数量和反应时间成正比。在210 nm波长下测定溶液吸光度的增加,就可计算酶的活力。
本研究中以酢浆草为原料,建立了抗氧化、蛋白变性抑制、酶活性抑制成分检测方法,用于快速体外检测药物抗炎活性。DPPH法检测抗氧化活性具有快速、简便、经济、反应液稳定、数据重复性好等优点,易实现高通量筛选。酶活性抑制成分检测和蛋白变性抑制成分检测方法具有操作简便、反应条件易控、数据可靠等特点。从3个维度对酢浆草抗炎成分进行体外快速检测,安全可靠,为药物抗炎活性评估提供了更便捷的方法。
炎症的基本病理变化通常概括为局部组织的变质、渗出和增生[13]。炎性反应将炎症细胞输送到炎症局部,渗出白细胞是炎性反应最重要的特征,白细胞通过释放酶、化学介质和毒性自由基等,引起组织损伤,并可能延长炎症过程。这一系列的炎性反应伴随着自由基产生、酶释放、酶活性增加、蛋白变性等生化反应。
本研究中建立的药物抗氧化、蛋白变性抑制活性、酶活性抑制检测方法,与炎症发生过程中的主要生化反应相对应,检测结果显示,酢浆草提取液具有100%抗氧化活性、90%蛋白变性抑制活性和50%酶活性抑制活性。抗氧化和蛋白变性抑制尤其对其抗炎效果的发挥具有积极作用,因此,本研究中所建立的药物抗炎抗氧化活性体外快速检测方法可用于抗炎药物批量筛选和快速鉴定。

