新型内质网应激诱导蛋白 TRIM25 在乳腺癌细胞中的作用研究
陶诗诗 陈 亮
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
1 引 言
乳腺癌是最常见的恶性肿瘤,因其术后复发和恶性转移率高已成为危害女性健康的最主要的疾病之一[1]。多方面研究表明,全球范围内乳腺癌的发病率迅速增加。就中国而言,每年新增患者数量和死亡数量分别占全世界的 12.2% 和 9.6%[2]。经过不断研究,目前已经筛选出许多肿瘤相关基因,并对其生物功能进行了深入探索,这使得人们对乳腺癌的发病机制有了更多了解[3]。尽管早期乳腺癌术后 5 年生存率可达 80%[2],但术后的远端复发和肺转移使乳腺癌总生存率并不乐观。随着全基因组测序技术的成熟、精准医疗概念的提出以及肿瘤靶向药物的应用,临床上乳腺癌的诊断和治疗都取得了一定进展。靶向治疗已逐步替代以手术、化疗、放疗为主的治疗方案,同时原来的经验治疗也正朝个体化治疗方向发展。因此,进一步挖掘乳腺癌细胞生长和转移过程中的标志性癌基因,并揭示其在乳腺癌发生发展中的调控机制是这种新治疗模式发展的关键所在,这将为完善乳腺癌基因靶点治疗策略奠定基础。
内质网是维持细胞正常功能的重要细胞器,人体 1/3 蛋白质都是在内质网中合成的,同时它也是蛋白质修饰和运输的主要场所[4-5]。当内质网受到缺氧或营养缺失等某些刺激时,会发生功能紊乱,从而导致蛋白错误折叠,这种现象称为内质网应激[6]。内质网应激会启动一系列信号通路,其中未折叠蛋白反应(Unfolded Protein Response,UPR)是被激活的主要调控机制之一。它通过促进错误折叠蛋白快速降解,反馈调节内质网功能,在一定程度上减弱内质网应激并逐渐恢复内质网稳态[7-8]。其中,内质网稳态对于维持细胞的正常生理功能至关重要。研究发现,虽然实体肿瘤通常处于长期慢性缺血、缺氧等应激微环境中,但却能正常存活和增殖。这是由于大部分肿瘤细胞已进化出应对内质网应激的更强能力,它们通过加速细胞内错误折叠蛋白的降解来恢复内质网稳态从而促进自身存活[9]。
TRIM(Tripartite Motif Family Protein)家族蛋白又被称为三基序蛋白,目前人们已经发现的 TRIM 家族蛋白质有 70 多种。该家族成员的 N 端都有一个保守的锌指结构域,使得大多数 TRIM 家族蛋白具有 E3 泛素连接酶活性,因此它们主要通过调控目的蛋白降解发挥功能[10-11]。由于内质网应激时会产生大量错误折叠蛋白,因此推测 TRIM 家族蛋白很可能参与内质网应激,并通过降解这些错误折叠蛋白发挥其调控作用,从而影响细胞存活。此外,许多研究表明 TRIM 家族蛋白与肿瘤的发生发展密切相关,如 TRIM33 可降解细胞核中β-catenin 蛋白达到抑癌效果[12];TRIM24 通过激活癌基因的转录促进前列腺癌发展[13];TRIM37 在乳腺癌中通过参与单泛素化过程调控组蛋白表达发挥功能[14]。本文作者团队的研究[15-16]发现,TRIM 家族蛋白中的 TRIM11 能够增强肿瘤细胞中的错误折叠蛋白和聚集体降解,最终导致肿瘤发生。据此进一步推测在肿瘤细胞中,TRIM 家族蛋白可能通过参与内质网应激来影响细胞的存活,最终实现调控肿瘤生长的目的。但目前关于 TRIM 家族蛋白在内质网中的作用几乎未知,仅有一次关于TRIM13 能够定位到内质网并参与内质网相关蛋白降解(Endoplasmic Reticulum Associated Protein Degradation,ERAD)过程的报道[17],而该蛋白如何发挥功能的作用机制尚未有相应研究。
本文作者团队就此对 TRIM 家族蛋白进行了内质网应激表达变化筛选发现,与对照组相比,TRIM25 在内质网应激时表达水平显著上调,因此将 TRIM25 锁定为研究目标,并推测TRIM25 是内质网应激的负反馈调节因子,拟探究敲低 TRIM25 对乳腺癌细胞的影响。TRIM25也叫雌激素受体指蛋白(Estrogen-Responsive Finger Protein,EFP),它在细胞中的表达受雌激素调控,并参与雌激素相关肿瘤,如乳腺癌、卵巢癌及子宫内膜癌的发生发展过程。统计表明,TRIM25 的高表达与乳腺癌不良预后密切相关[18-20]。因此,本研究旨在通过研究TRIM25 对乳腺癌细胞 MCF7 内质网应激过程的影响并分析其与乳腺癌患者预后的关系,为发现新的乳腺癌治疗靶点提供理论依据。
2 材料与方法
2.1 材料
人源乳腺细胞 MCF 10A、MCF7、MDAMB-231 均购自美国标准生物品收藏中心(ATCC);二甲基亚砜(DMSO)、霍乱毒素(Cholera Toxin,CTX)、毒胡萝卜素(Thapsigargin,TG)和衣霉素(Tunicamycin,TM)均购自美国 Sigma-Aldrich 公司;DMEM 培养基、磷酸盐缓冲液均购自美国 Hyclone 公司;胰酶、胎牛血清、青霉素和链霉素均购自美国 Gibco 公司;DMEM/F12 培养基和 MEGM SingleQuots™ 试剂盒购自瑞士 Lonza 公司;马血清购自美国 Invitrogen 公司;RT-qPCR 试剂购自北京全式金生物技术有限公司,所有引物均由生工生物工程(上海)股份有限公司合成;细胞裂解液 RIPA 购自上海碧云天生物技术公司;蛋白酶抑制剂苯甲基硫酰氟(Phenylmethanesulfonyl Fluoride,PMSF)购自上海罗氏制药有限公司;磷酸酶抑制剂购自美国Thermo Fisher Scientific 公司;lipofectamine 3000转染试剂购自美国 Invitrogen life 公司;TRIM25抗体、ER stress antibody kit 均购自美国 CST(Cell Signaling Technology)公司;β-tubulin、HRP antimouse 和 HRP anti-rabbit 抗体均购自 Proteintech中国公司;FITC 凋亡检测试剂盒购自美国BD(Becton,Dickinson and Company)公司。ECL化学发光仪(GE,Amersham Imager AI600);CO2细胞培养箱(美国 Thermo Scientific 公司);细胞操作台(苏州净化设备有限公司)。
2.2 方法
2.2.1 细胞培养
本实验选用 MCF 10A、MCF7、MDAMB-231、293T 细胞开展实验。其中,MCF7 10A 用含 5% 马血清、MEGM SingleQuots™ 试剂以及 100 ng/mL 霍乱毒素的 DMEM/F12 培养基进行培养;其余细胞均用含 10% 胎牛血清、1% 双抗的 DMEM 高糖培养基进行培养,培养条件为 37 ℃、5% CO2。
2.2.2 内质网应激时 TRIM25 表达量的检测
为研究 TRIM25 蛋白在乳腺癌细胞 MCF7 处于内质网应激时的表达变化情况,分别从 mRNA和蛋白水平进行检测。首先,将 MCF7 细胞以60% 的密度接种于 6 孔板中,培养过夜后,分别替换为含 DMSO、5 μg/mL TM、1 μmol TG 的培养基,并继续培养 6 h。然后,弃去培养液,加适量磷酸盐缓冲液(Phosphate Buffered Solution,PBS)洗去残余培养液,随后每孔加 1 mL Trizol,室温放置 5 min,使细胞充分裂解后,将细胞裂解液转移至 RNAse-free 的 1.5 mL 离心管提取 RNA。另外,设置同上处理的 3 个孔,加DMSO、TM 及 TG 后继续培养 12 h,弃去培养液,加适量的 PBS 洗去残余培养基,之后每孔加 500 μL PBS,小心将细胞刮下并将细胞液转移至新的 1.5 mL 离心管中,提取蛋白。最后,分别采用实时荧光定量 PCR 和蛋白免疫印迹检测各组 TRIM25 表达量。
2.2.3 敲低 TRIM25 对内质网应激及 UPR 信号通路影响的检测
(1)稳定敲低 TRIM25 的 MCF7 细胞系构建
本实验使用 PLKO.1、VSVG、DR8.91 慢病毒体系进行基因敲低。首先,设计 TRIM25 的短发夹 RNA(short hairpin RNA,shRNA),并将shRNA 插入表达载体 PLKO.1 以构建 PLKO.1-shRNA 重组质粒。然后,包装慢病毒,将 293T细胞以 60% 密度接种于 10 cm 培养皿中,培养12 h 后,质粒 PKOL.1/PLKO.1-shRNA、VSVG、DR8.91 按质量比为 9∶1∶10 转染 293T 细胞,培养 18 h 更换成 7 mL 含 30% 血清和 1% 双抗的DMEM 培养基,并继续培养 24 h(此过程大量病毒将被分泌到培养基中)。最后,收集培养液以1 250 r/min 在 4 ℃ 下离心 5 min,上清液使用45 μm 滤膜过滤收集滤液至无菌储存管中。至此病毒液收获完成,可继续换液收病毒 1~2 次。
接下来,用上述包装好的病毒感染 MCF7细胞,并用含嘌呤霉素的培养基筛选稳定转染细胞系。具体地,先将 MCF7 细胞以 60% 密度接种于 6 孔板中,培养过夜,弃培养液,每孔加入 1 mL 培养基、1 mL 病毒液、8 μg/mL polyberen,感染 24 h。然后,换成含 1.5 μg/mL嘌呤霉素的培养基进行筛选培养,每天换液,连续筛选 4 天(此过程成功感染的细胞将会存活),再换成含 0.015 μg/mL 嘌呤霉素的培养基扩大培养存活细胞。最后,通过实时荧光定量 PCR和蛋白免疫印迹分析该细胞系中 TRIM25 表达情况。同时,将经验证的正常表达 TRIM25 对照组(sh Negative Control,shNC)和稳定敲低TRIM25(shTRIM25-1、shTRIM25-2)的 MCF7 细胞系继续培养,便可用于后续实验。
(2)内质网应激下游基因表达及 UPR 信号通路的检测
分别从上述构建的 MCF7 细胞系中提取RNA 和蛋白质,在 mRNA 水平检测内质网应激情况及 UPR 信号通路下游基因表达,并在蛋白质水平检测 UPR 信号通路中的关键蛋白。比较shNC、shTRIM25-1、shTRIM25-2 中各基因及蛋白的表达变化,并分析 TRIM25 敲低对内质网应激和 UPR 信号通路的影响。
2.2.4 细胞凋亡检测
为研究 MCF7 细胞中敲低 TRIM25 对内质网应激诱导的细胞凋亡的影响,将 shNC、shTRIM25-1、shTRIM25-2 以 60% 的密度接种于12 孔板中,培养过夜后分别替换为含 DMSO、5 μg/mL TM、1 μmol TG 的培养基,继续培养12 h。随后收集细胞,按 FITC 凋亡检测试剂盒说明书操作,同时设置 3 个补偿实验组:空白对照(不染)、50 μmol H2O2处理 12 h(单染 FITC)、65 ℃ 水浴 20 min(单染 PI),通过流式细胞分析仪检测各组细胞凋亡率。
2.2.5 不同乳腺细胞系中 TRIM25 表达量的检测
分别提取 MCF 10A、MCF7、MDA-MB-231细胞蛋白质,通过蛋白免疫印迹检测各细胞系中TRIM25的蛋白表达水平。
2.2.6 TRIM25 与乳腺癌患者生存期相关性的分析
通过在线数据库 UALCAN(http://ualcan.path.uab.edu/index.html)查询正常乳腺组织和原位乳腺癌组织样本中TRIM25的蛋白量表达差异;随后通过在线分析数据库 SurvExpress((http://bioinformatica.mty.itesm.mx:8080/Biomatec/SurvivaX.jsp)查询乳腺癌患者的生存期与 TRIM25表达量的关系。进一步探讨 TRIM25 表达水平的高低与乳腺癌及乳腺癌患者生存期相关性。
2.2.7 统计学分析
使用 SPSS17.0 软件处理实验数据,实验结果均以“平均值±标准差”表示,组间差异采用双侧t检验进行分析。其中,** 表示P<0.01;*** 表示P<0.001。
3 结果与分析
3.1 内质网应激诱导乳腺癌细胞 MCF7 中 TRIM25蛋白表达上调
本实验使用内质网应激阳性诱导剂 TM 和TG 处理 MCF7 细胞 6 h 以诱导细胞产生内质网应激,同时将 TM、TG 的溶剂 DMSO 作为对照处理同样时间,收集细胞检测 TRIM25 和内质网应激标志物葡萄糖调节蛋白 78(78 kDa Glucose-Regulated Protein,GRP78/Bip)的 mRNA 水平。由图 1(a)可知,与 DMSO 处理组相比,TM、TG 处理组内质网应激标志物 GRP78/Bip mRNA水平显著上升,同时 TRIM25 mRNA 水平也显著上升。此外,由于蛋白表达比 mRNA 变化反应慢,故从 TM、TG 处理细胞 12 h 后收集细胞检测 TRIM25 和内质网应激标志物 GRP78/Bip的蛋白水平可知(如图 1(b)),与 DMSO 处理组相比(以β-tubulin 为内参),TM、TG 处理组内质网应激标志物 GRP78/Bip 蛋白水平大幅上升,同时 TRIM25 蛋白水平也大幅上升。以上结果表明,内质网应激情况下,乳腺癌细胞MCF7 可诱导 TRIM25 mRNA 和蛋白表达水平显著上升。
3.2 TRIM25 敲低诱导内质网应激并激活 UPR信号通路
通过实时荧光定量 PCR 检测 MCF7 细胞系稳定敲低 TRIM25 的效果。由图 2(a)可知,与 shNC 相比,shTRIM25-1 和 shTRIM25-2 中TRIM25 的 mRNA 表达水平显著降低;直接反映细胞内质网应激程度的 GRP78/Bip 水平显著上升,表明在 MCF7 中敲低 TRIM25 可诱导细胞产生内质网应激。

图1 内质网应激时 TRIM25 在乳腺癌细胞 MCF7 中的表达变化Fig.1 Changes of TRIM25 expression in breast cancer cells MCF7 under ER stress
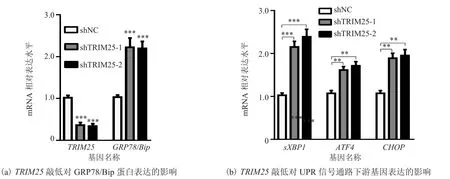
图2 TRIM25 敲低对内质网应激及 UPR 信号通路下游基因表达的影响Fig.2 Effects of TRIM25 knockdown on ER tress and expression of downstream gene in UPR signaling pathway
未折叠蛋白反应(UPR)是由内质网应激所激活的一种内质网蛋白质量控制体系。该体系相关信号通路的活化,能够反馈调节内质网功能,对于恢复内质网稳态具有重要作用。通过检测 UPR信号通路中sXBP1、ATF4、CHOP基因的 mRNA水平发现,与对照组相比,敲低 TRIM25 后这 3个基因的 mRNA 表达显著升高(图 2(b))。该结果表明,乳腺癌细胞 MCF7 中敲低 TRIM25 可激活 UPR 信号通路。
3.3 TRIM25 敲低促进 UPR 通路关键蛋白的激活
通过免疫印迹,初步检测上述 TRIM25 稳定敲低细胞系中 UPR 信号通路关键蛋白的变化。结果显示,内质网应激标志蛋白 GRP78/Bip 明显上调,UPR 通路下游的磷酸化 eIF2α上调但总eIF2α不变,磷酸化 JNK 明显上调而总 JNK 无明显变化(图 3),表明 TRIM25 蛋白敲低后明显激活 eIF2α及 JNK 等 UPR 关键信号通路。该结果进一步说明 TRIM25 的缺失能够诱导内质网应激并激活 UPR 通路。
3.4 TRIM25 敲低显著促进内质网应激诱导的细胞凋亡

图3 TRIM25 敲低对 UPR 信号通路关键蛋白表达的影响Fig.3 Effects of TRIM25 knockdown on expression of the key protein in UPR signaling pathway
内质网应激诱导的细胞凋亡是一条重要的细胞凋亡途径,而 JNK 是目前已知的促进内质网凋亡途径的关键分子之一。由上述结果推测,敲低 TRIM25 很可能参与内质网应激诱导的细胞凋亡。本文使用 DMSO、TM 及 TG 分别处理TRIM25 敲低细胞系,12 h 后通过流式细胞仪检测各组细胞凋亡情况。结果显示,与对照组相比,TRIM25 的缺失导致 DMSO 处理的细胞凋亡率显著增高,并能导致内质网应激药物处理的细胞凋亡率有极显著上升(如图 4),表明敲低TRIM25 显著促进内质网应激诱导的乳腺癌细胞MCF7 凋亡。

图4 TRIM25 敲低对内质网应激诱导细胞凋亡的影响Fig.4 Effects of TRIM25 knockdown on endoplasmic reticulum stress induced cell apoptosis
3.5 乳腺原发上皮转化为乳腺癌细胞过程伴随TRIM25 蛋白水平上调
通过免疫印迹检测不同乳腺细胞系 MCF 10A、MCF7 和 MDA-MB-231 中 TRIM25 的蛋白水平。其中,MCF 10A 为正常乳腺上皮细胞;MCF7 为原位乳腺癌细胞;MDA-MB-231 为恶性高转移乳腺癌细胞。结果表明,乳腺原发上皮转化为乳腺癌细胞过程伴随 TRIM25 蛋白水平上调(如图 5),提示 TRIM25 蛋白在乳癌细胞癌性转化过程中发挥重要功能。
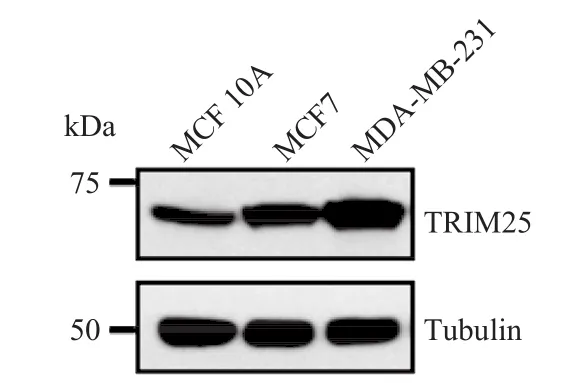
图5 不同乳腺细胞中 TRIM25 的表达量差异Fig.5 The expression of TRIM25 in different breast cells
3.6 TRIM25 高表达显著降低乳腺癌病人生存期
利用 CPTAC 数据库查询正常乳腺组织和原位乳腺癌组织中TRIM25的蛋白表达量并分析发现:与正常组织(n=18)相比,TRTM25 在原位乳腺癌组织(n=125)中的表达水平有显著性上调(P<0.001),如图 6(a)所示。
此外,为分析 TCGA 数据库中浸润性乳腺癌患者 TRIM25 表达量与生存期的关系,将患者分为 TRIM25 高表达(n=481)和低表达(n=481)两组,并比较两组间患者的总生存率。结果显示,在 TRIM25 高表达组中乳腺癌患者的生存期显著降低(图 6(b)),表明 TRIM25 的表达水平与乳腺癌病人的生存期负相关。

图6 生物信息学分析 TRIM25 表达量与乳腺癌患生存期关系Fig.6 Bioinformatics analysis of TRIM25 expression and survival of breast cancer patients
4 讨 论
乳腺癌的发病过程是极其复杂的,虽然靶向治疗给乳腺癌患者带来了极大的希望,但由于人们对其分子机制的研究至今仍处于探索阶段。目前可作为临床诊断、靶向治疗以及预后标志的有效分子靶点还很缺乏,因此寻找新的乳腺癌关键基因是乳腺癌研究的重要内容。
目前,大部分研究焦点集中在那些可能与乳腺癌发生发展直接相关的靶基因上,希望能寻找到新的治疗靶点,为临床治疗提供新思路。近来内质网应激诱导肿瘤细胞凋亡逐渐成为一个新的研究方向,揭示该过程中重要蛋白的作用引起了人们的关注。已有报道称 TRIM13 定位于内质网,在内质网应激过程中通过其螺旋卷曲结构域诱导细胞自噬[21],但 TRIM 家族其他成员参与内质网应激过程还未有相关报道。本文利用内质网应激诱导阳性药物 TM、TG 体外处理细胞,通过实时荧光定量 PCR 检测发现多种 TRIM 家族蛋白在内质网应激时表达量有显著变化,其中TRIM25 变化尤为显著,因此推测 TRIM25 是参与内质网应激过程的重要蛋白。故设计图 7(a)实验思路探究 TRIM25 与乳腺癌发生发展的关系。
大量研究表明,TRIM25 所属的 TRIM 家族蛋白与肿瘤的发展密切相关。例如,TRIM11 高表达可增强肿瘤细胞降解错误折叠蛋白的能力,从而促进肿瘤细胞存活[16];TRIM28 在早期肺癌中具有抑制肿瘤细胞增殖的功能[22];TRIM32 通过负调节 p53 功能促进肿瘤发生[23]。TRIM25 同样在多种肿瘤的发生中扮演着重要角色,如促进胃癌[24]、肺癌[25]的发展。此外,更有多项研究表明,TRIM25 作为一种雌激素受体,参与调节雌激素相关肿瘤的进展,与乳腺癌的关系尤为密切。在乳腺癌恶化过程中,TRIM25 的表达量显著上调促进其靶蛋白肿瘤抑制因子 14-3-3σ的水解,从而加剧乳腺癌的恶性转化[26-27]。有报道称 TRIM25 是一个转录调控因子,其活性的改变在一定程度上决定了乳腺癌的转移表型。Walsh等[28]通过系统生物学方法确定了 TRIM25 是乳腺癌转移的关键决定因素。以上研究暗示 TRIM25在乳腺癌的临床治疗中具有潜在的重要性,这与本文的研究结果一致,但目前关于 TRIM25 如何调节乳腺癌进展的分子机制尚不清楚。因此,揭示 TRIM25 与乳腺癌之间的新型调控机制,可为未来临床上乳腺癌的早期诊断和临床治疗提供新思路和理论支持。

图7 实验流程及 UPR 信号通路示意图Fig.7 The diagram of experemental scheme and UPR signaling pathway
本文研究发现,TRIM25 是一种新型的内质网应激诱导蛋白。当乳腺癌细胞 MCF7 处于内质网应激时,其表达显著上调。此外,TRIM25 敲低会诱导内质网应激、激活 UPR 信号通路并显著促进内质网应激诱导的 MCF7 细胞凋亡(如图 7(b))。生物信息学分析表明,TRIM25 高表达与乳腺癌患者的生存率较低相关。鉴于以上结果,初步判断 TRIM25 参与内质网应激调节乳腺癌细胞生长,有望成为乳腺癌临床诊断的指标和治疗的新靶点。
本研究也存在一定局限性,如只检测了TRIM25 敲低对乳腺癌细胞的影响,缺少对TRIM25 过表达的研究。有报道称在前列腺癌的研究中发现,TRIM25 靶向 ERG(转录因子家族Ets 相关基因)癌基因,使该基因发生多聚泛素化降解[29]。这表明 TRIM25 在各种癌症中的作用具有两面性,可作为癌基因也可以作为抑癌基因发挥作用;检测 TRIM25 对细胞凋亡影响的同时还可检测对细胞迁移、侵袭能力的影响。因此,要更深入探明 TRIM25 的生物学功能还需进一步研究。
5 结 论
TRIM25 是一种新型的内质网应激诱导蛋白,它可通过参与内质网应激诱导细胞凋亡来调控乳腺癌细胞的存活,这是一种新的肿瘤细胞调控体系。其中,随着乳腺癌细胞恶性程度的加剧,TRIM25 表达量显著上升,导致乳腺癌患者生存率明显降低。本研究结果提示,TRIM25 与乳腺癌的发生发展有密切关系,有望成为乳腺癌治疗和预后的潜在靶点。
——疾病防治的新靶标

