不典型肺结核球与周围型小肺癌的MRI鉴别诊断
漆婉玲,何玉麟,夏青,黎斌,余秋月
南昌大学第一附属医院影像科,江西南昌 330006; *通讯作者 何玉麟 173386424@qq.com
肺结核球(pulmonary tuberculoma,PT)为继发性肺结核的一种特殊类型,其病理改变是干酪样坏死物质被类上皮肉芽组织或纤维瘢痕组织包裹。PT 在影像学上分为典型和不典型两大类:典型PT 表现为肺上叶尖后段或下叶背段含钙化结节,伴卫星灶,CT容易诊断;不典型PT(atypical pulmonary tuberculoma,APT)的影像表现不具备上述征象,易误诊。周围型小肺癌(small peripheral lung cancer,SPLC)指发生于肺段以下支气管且直径≤3 cm 的肺癌[1]。当癌灶直径>3 cm 时,其恶性程度和增殖转移能力增强,预后更差[2]。APT 及SPLC 临床表现无特异性,易被混淆。本研究应用MRI 多序列成像、DWI 及多期增强扫描技术,比较两种病灶的形态学表现、信号及强化特点等;同时采集病灶的信号值参数,定量分析两者的特性,为临床提供辅助诊断方法。
1 资料与方法
1.1 研究对象 收集2015 年10 月—2017 年12 月南昌大学第一附属医院经手术、穿刺活检或治疗性诊断确诊的APT、SPLC 患者各20 例。APT 患者中,男14 例,女6 例;年龄26~71 岁,平均(48.15±11.22)岁。SPLC 患者中,男13 例,女7 例;年龄28~72 岁,平均(57.65±11.43)岁。两组患者年龄差异有统计学意义(P<0.05),性别差异无统计学意义(P>0.05)。患者临床症状以咳嗽、咳痰最多见,其余以不同程度的呼吸道症状就诊,或体检偶然发现。纳入标准:①行胸部X 线或CT 检查发现APT 或SPLC 疑似者;②病灶最大径线≤3 cm;③无心、肝、肾功能障碍;④无放化疗史。排除标准:①有MRI 检查禁忌证;②各种原因导致的MRI 扫描图像质量差、伪影大,影响图像分析及诊断。
1.2 MRI 检查 所有患者均行Siemens 1.5T Avanto 系统18 通道体部高分辨相控阵线圈扫描,取仰卧位、头先进,扫描范围从双肺尖至膈肌水平。常规MRI 平扫参数:①冠状位T2WI:HASTE TR 1000 ms、TE 90 ms,视野(FOV)360 mm×320 mm,层厚5.5 mm、间距1 mm、层数18,激励次数1;②轴位T1WI:GRE(压脂用SPAIR)TR 160 ms,TE 4.9 ms,FOV 380 mm×360 mm,层数30;③轴位T2WI:FSETR 2200 ms,TE 90 ms。轴位DWI:EPI TR 1500 ms,TE 82ms、激励次数2,自由呼吸状态下以2 个不同的b 值(0、800 s/mm2)扫描。增强扫描采用VIBE-T1WI 序列,经肘静脉注射对比剂Gd-DTPA(剂量0.2 ml/kg、速度2.5 ml/s)后15 s、30 s、60 s、5 min、30 min 进行屏气扫描,部分延迟至60 min。
1.3 图像分析 所有MRI 图像信息传输至西门子后处理工作站。由2 名经验丰富的影像科副主任医师进行测量:①观察病灶的形态学改变及强化特点;②记录病灶在T1WI、T2WI、DWI 及表观扩散系数(ADC)图上的信号强度,并以胸壁肌肉及胸髓信号为参照标准分为4 个等级:低(≤肌肉信号)、稍低(介于肌肉与胸髓信号之间)、等(等于胸髓信号)、高信号(>胸髓信号)[3];③T1WI、T2WI 信号值、ADC值、强化峰值及强化增值的测量均取病灶所在最大层面,置于信号相对均匀的实性部位,取平均值作为最终测量值,并比较两组间的数值差异。
1.4 统计学方法 采用SPSS 21.0 软件,两组性别、病灶部位及伴随征象等计数资料组间比较采用X2检验;年龄、病灶直径、T1WI、T2WI 信号值、强化峰值及强化增值等计量资料以±s表示,组间比较采用独立样本t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 MRI形态学特点 APT患者病灶直径1.1~2.8 cm,平均(1.81±0.51)cm;SPLC 患者病灶直径0.9~2.8 cm,平均(1.96±0.55)cm,组间比较,差异无统计学意义(P>0.05)。APT 组11 例病灶位于尖后段,3 例位于背段,6 例位于其他肺段;SPLC 组分别为12 例、4 例、4 例。两组患者病灶好发部位差异无统计学意义(P>0.05)。SPLC 组出现分叶征、血管集束征、胸膜凹陷征的比例显著高于APT 组,差异有统计学意义(P<0.05);毛刺征比例高于APT 组,空洞征比例低于APT 组,差异均无统计学意义(P>0.05)。见表1。
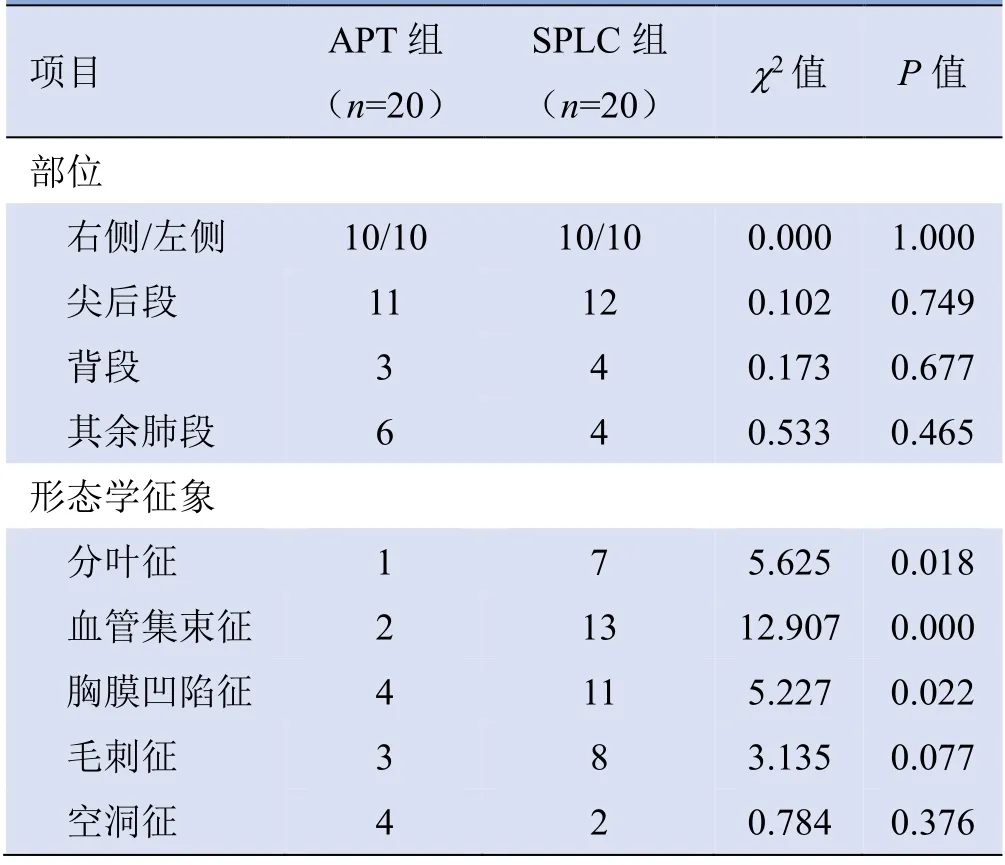
表1 APT 组及SPLC 组患者MRI 形态学情况比较(例)
2.2 信号特征平扫信号强度 9 例APT 患者T1WI呈等信号,7 例呈稍低信号,4 例呈外高内低信号;11 例T2WI 呈等信号,5 例呈高信号,4 例呈外高内低信号;13 例DWI 呈高信号,7 例呈等信号(图1、2)。15 例SPLC 患者T1WI 呈稍低信号,5 例呈等信号;12 例T2WI 呈高信号,7 例呈等信号,1 例呈外高内低信号;15 例DWI 呈高信号,5 例呈等信号(图3、4)。其中两类病灶间T1WI 呈稍低或外高内低信号、T2WI 呈高信号,差异有统计学意义(P<0.05),见表2。
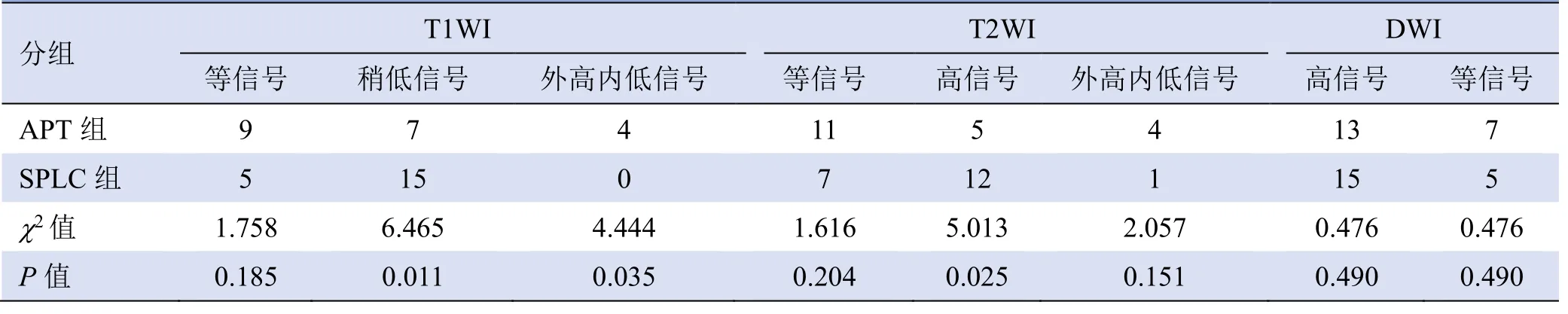
表2 APT 组及SPLC 组患者平扫信号特点(n=20,例)
SPLC 患者T2WI 信号值、强化峰值及强化净增值均高于APT 患者,而ADC 值低于APT 患者,差异均有统计学意义(P˂0.05)。APT 患者T1WI 信号值略高于SPLC 患者,差异无统计学意义(P>0.05),见表3。
表3 APT 组及SPLC 组患者信号、强化值定量比较(±s)
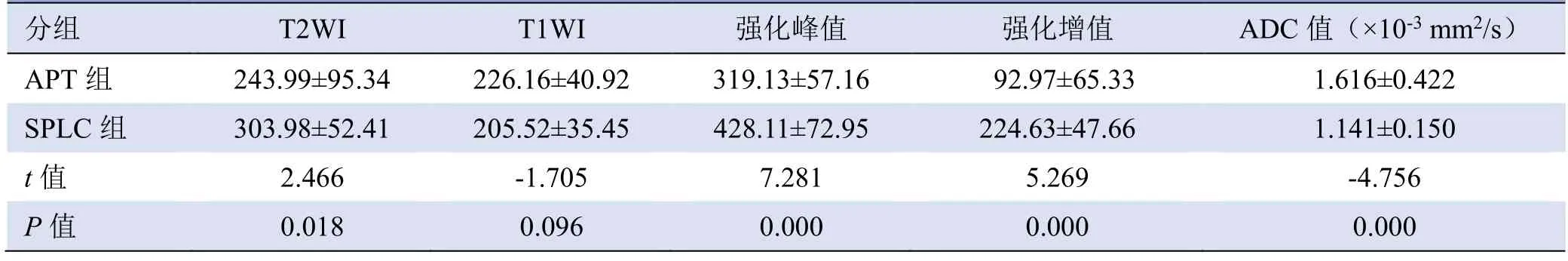
表3 APT 组及SPLC 组患者信号、强化值定量比较(±s)
?
2.3 强化特征 APT 患者中,18 例呈薄壁环形强化(壁厚度≤2 mm),包括早期无强化或轻度环形强化,延迟期明显环形强化13 例(图1、2),早期明显环形强化,延迟期持续强化4 例及强化程度降低1 例;1 例呈不均匀延迟强化;1 例早期呈均匀较明显强化,延迟期强化程度降低。SPLC 患者中,13 例呈不均匀强化(图3、4),5 例呈均匀强化,2 例呈环形强化。增强早期均呈较明显强化,而延迟期13 例呈持续强化(图3),7 例强化程度降低(图4)。
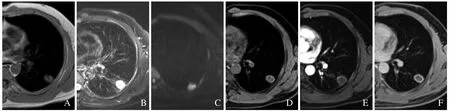
图1 男,40 岁,左肺下叶背段结核球。SE/T1WI 示病灶呈等信号(A);FSE/T2WI 示病灶呈高信号(B);b=800 mm/s2 时DWI呈等信号(C);FSE/T1WI 呈外高内低信号(D);增强扫描动脉期无明显强化(E);延迟期(30 min)呈薄壁环形强化(F)
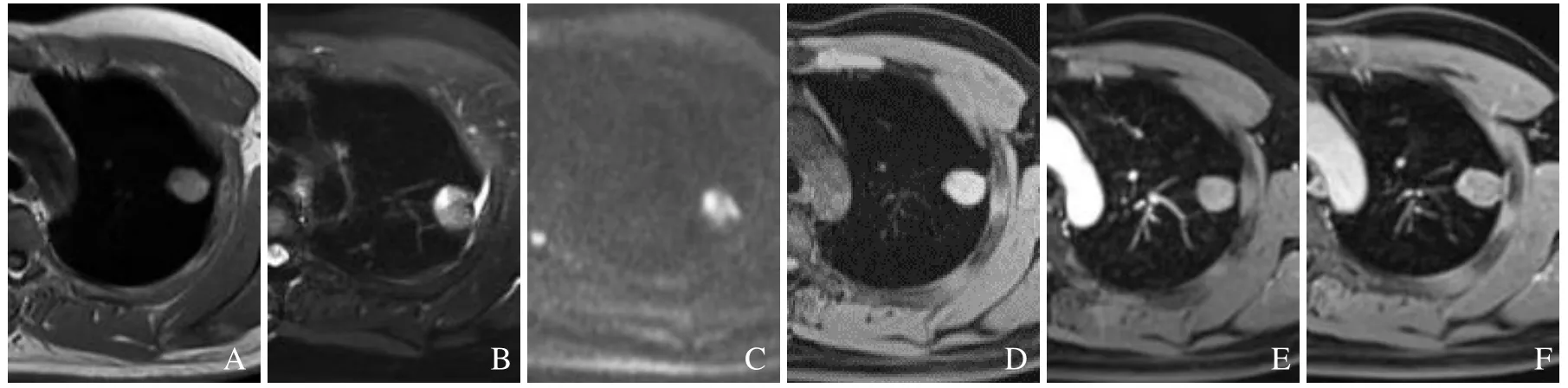
图2 男,32 岁,左肺上叶尖后段结核球。SE/T1WI 示病灶呈高信号(A);FSE/T2WI 示病灶呈等信号,见胸膜凹陷征(B);b=800 mm/s2 时DWI 呈高信号(C);FSE/T1WI 呈高信号(D);增强扫描动脉期无明显强化(E);延迟期(30 min)呈薄壁环形强化(F)
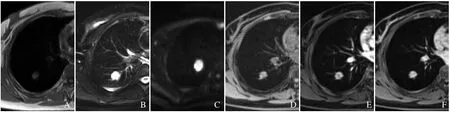
图3 女,46 岁,右肺下叶浸润性腺癌。SE/T1WI 示病灶呈等信号(A);FSE/T2WI 示病灶呈高信号(B);b=800 mm/s2 时DWI 呈高信号(C);FSE/T1WI 呈等信号(D);增强扫描呈明显不均匀持续强化(延迟45 min,E、F)
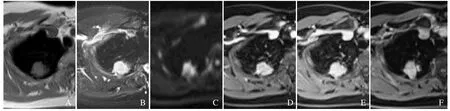
图4 女,52 岁,右肺上叶尖段浸润性腺癌。SE/T1WI 示病灶呈稍低信号(A);FSE/T2WI 示病灶呈等信号,见分叶及胸膜凹陷征(B);b=800 mm/s2 时DWI 呈不均匀高信号(C);增强扫描动脉期、肺实质期呈不均匀明显强化(D、E);延迟期(30 min)强化程度稍降低(F)
3 讨论
3.1 APT 与SPLC 的主要形态学表现与区别 两类患者的发病部位及大小无显著差异;而其伴随征象(分叶征、血管集束征及胸膜凹陷征)差异有统计学意义。①分叶征:分叶越明显,肿瘤恶性程度越高[2]。本研究中,7 例SPLC 患者见分叶,低于文献报道,推测其原因为SPLC 患者尚处于低度恶性阶段[4]。仅1 例APT 患者出现分叶征,其原因为多个干酪样肉芽肿融合所致[5];其余APT 均呈圆形。②血管集束征:本研究中,13 例SPLC 患者出现该征象,由肿瘤血管代偿性增粗所致;2 例APT 纤维增生反应牵拉邻近血管所致血管集束征。③胸膜凹陷征:结节直接侵犯或病灶内成纤维反应,使其与胸膜之间形成喇叭口状间隙,内有生理性液体积聚[6]。本研究中4 例APT 患者出现此征象,而SPLC 患者中出现11 例,发生率高于前者。两组患者毛刺征及空洞征发生率差异无统计学意义。①毛刺征:本研究3 例APT 患者见粗长毛刺影,可能是病灶炎症、纤维反应所致;8 例SPLC 患者见短毛刺影,其原因是肿瘤细胞沿血管、淋巴管或肺泡浸润生长。②空洞征:本研究2 例SPLC 患者见不规则形空洞,洞壁欠光整;4 例APT 患者见空洞,其 中2 例呈偏心裂隙样,偏向引流支气管的位置,2 例呈 类圆形,壁薄而光滑。
3.2 MRI 平扫成像及病理特征 APT 患者T2WI 信号多种多样,取决于各个病理阶段组织成分的含量及分布。早期为增生性结核肉芽肿,相应地在T2WI 上呈高信号;随后病灶中心出现干酪样物质,边缘有炎症细胞浸润及包膜形成,表现为外高内低信号;后期干酪样物质液化、坏死,被周围增生的纤维组织包裹,呈外低内高信号[7-8]。本研究9 例APT 患者T1WI 呈等信号、7 例呈稍低信号、4 例呈外高内低信号;11 例T2WI 呈等信号、5 例呈高信号、4 例呈外高内低信号。由此可知,临床最常见的类型中央为干酪样物质伴或不伴液化坏死,周围为肉芽肿包膜。肺癌的MRI信号高低与其组织学类型及肿瘤内部水含量、蛋白质状态等关系密切[9]。SPLC 患者中,15 例T1WI 呈稍低信号,5 例呈等信号;12 例T2WI 呈高信号,7 例呈等信号,1 例呈外高内低信号,信号多不均匀。因此,SPLC 患者MRI 信号表现呈一定的规律性,呈稍长T1 长T2 信号。肉眼观察SPLC 患者T1WI 信号强度低于APT,其原因为PT 内部为含有类脂质的干酪样物质导致T1WI 信号偏高;T2WI 高于APT,可能与SPLC 患者病灶内含水量及蛋白质状态有关。APT患者T1WI 信号值稍高于SPLC 患者,但差异无统计学意义;SPLC 患者T2WI 信号值高于APT,差异有统计学意义。DWI 图中肉眼信号强度对于病变的鉴别诊断意义有限,但其独特的ADC 值定量分析对于两者的鉴别具有重要作用[10]。
3.3 MRI 强化特点及病理特征 随病程的迁延,本研究APT 患者病灶的强化及病理特征表现不同:①18 例患者表现以坏死为主型,即内部为干酪样坏死物质,无血供,而周围是类上皮肉芽或纤维瘢痕组织形成的包膜,含较多的毛细血管。MRI 具有极高的软组织分辨力,故增强扫描呈中央无强化的偏低信号区、边缘明显强化的高信号环。其中17 例环形强化程度随时间延长而逐渐增加,其原因为较多的纤维组织和炎症细胞浸润使得血管通透性增大,对比剂进入和退出均变慢,呈“慢进慢出”型;仅1 例环形强化于延迟期程度稍减退。②1 例呈不均匀多发小结节状延迟强化,边缘见分叶,从而误诊为SPLC。③1 例APT 患者早期呈均匀较明显强化,延迟期强化程度降低,对应的病理表现为炎症细胞居多。因此,薄壁延迟环形强化对APT 的诊断有较高的特异性。肺癌由肺动脉、静脉、支气管动脉及新生肿瘤血管在不同病理阶段供血,因新生血管基底膜欠完整、通透性大,Gd-DTPA 分子更易进入肿瘤组织中及血管外间质,故强化明显[11-12]。本研究13 例SPLC 患者呈不均匀强化,内部有不同程度的坏死,5 例呈均匀强化。该18 例病灶早期均呈较明显强化,延迟期11 例呈持续强化、7 例强化程度减低,提示大部分SPLC 患者的强化模式呈“快进慢出”型;2 例呈不规则持续环形强化,环内壁欠光整,其原因在于病灶中央为不规则空洞无强化,边缘为实性部分或伴有炎症,故强化明显,导致其中1 例误诊为结核。SPLC 患者的强化峰值及强化增值均高于APT 患者,差异均有统计学意义。在强化程度方面SPLC 明显高于APT;在强化方式方面,SPLC 多呈不均匀强化,APT 多呈薄壁环形强化,MRI 显示该征象更为敏感和清晰,有助于诊断[13]。
总之,APT 与SPLC 患者临床表现缺乏特异性,易混淆。由于MRI 具有多参数、多序列、极高的软组织分辨力等优势,可以为两者的鉴别诊断提供更多的信息,在APT 和SPLC 的鉴别中具有重要价值。

