Stanford A型急性主动脉夹层合并新发脑梗死的影像学特征及预后
弓文清,刘艳,周玲,刘珍,魏梦绮,郑敏娟*
1.空军军医大学西京医院超声医学科,陕西西安 710032;2.空军军医大学西京医院放射科,陕西西安 710032; *通讯作者 郑敏娟 zhengmj@fmmu.edu.cn
Stanford A 型急性主动脉夹层(acute aortic dissection,AAD)是一类危重大血管疾病。部分患者以突发昏迷或其他神经系统症状起病,并不出现典型的胸背痛症状,病情更加凶险且极易误诊[1-2]。据国际主动脉夹层注册中心(IRAD)统计数据显示,AAD 患者脑梗死的发病率接近6%,严重影响患者的预后[3-4]。因此,进一步了解AAD 合并脑梗死患者的影像学特征非常重要。本课题组前期研究发现AAD 合并脑梗死患者与主动脉弓部分支累及密切相关,颈动脉多普勒证实弓部血管受累可导致入颅血流量明显减低,超声评估入颅血流量(颈内动脉与椎动脉)变化可预警新发脑梗死的发生[5]。然而,AAD 合并脑梗死患者的预后、好发部位分布、梗死体积变化与分支累及是否相关等均尚未明确。本研究以上述问题为切入点,进一步探讨AAD 合并脑梗死患者的影像学特征及预后,为临床诊治提供参考依据。
1 资料与方法
1.1 研究对象 连续收集2016 年5 月—2017 年2 月空军军医大学西京医院急诊收入并转心外科治疗的45 例急性AAD 患者的超声心动图、颈部血管超声及临床资料,所有病例均经过CT 血管成像(CTA)及超声确诊,手术前行头颅MRI 检查确认有无新发脑梗死。
分组依据:①根据夹层是否累及主动脉弓分支血管分为累及组及未累及组;②根据患者生存状况分为存活组与死亡组。
纳入标准:CTA 与超声确诊为AAD 患者,扩散加权成像(DWI)呈高信号。排除AAD 合并陈旧性脑梗死患者。
1.2 仪器与方法 超声检查主动脉弓部分支:采用Philips iU 22 彩色多普勒超声仪,L9-3 血管探头(频率3.0~9.0 MHz)及心脏探头S5-1(1~5 MHz)。受检者取平卧位或侧卧位,充分暴露颈部及心前区。连接心电图并记录血压。记录和观察心脏各切面及颈部血管长短轴,彩色多普勒评估心功能及血流速度等参数。
1.3 头颅MRI 检查 采用西门子1.5T 或3.0T MR仪,患者取仰卧位,使用头颅线圈,嘱患者在检查过程中保持静止状态,检查过程中严禁晃动头部,对所有患者的头部进行SE 或快速SE 序列多层面扫描,主要包括T1WI、T2WI、FLAIR 等序列及DWI 检查,所有患者从发病时间至MR 检查时间为3 h~3 d。根据Pullicino 公式[6]计算脑梗死体积。

1.4 统计学方法 应用SPSS 21.0 软件,计量资料以±s表示,组间比较采用独立样本t检验;计数资料组间比较采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 研究对象临床特征 共纳入AAD 合并脑梗死患者45 例,其中男35 例,年龄(54.5±1.6)岁,高血压患者占62.2%,33.3%的患者合并神经症状或肢体障碍(表1)。
2.2 AAD 合并脑梗死患者主动脉分支血管累及特征 45 例AAD 合并脑梗死患者中,32 例(71.1%)夹层累及主动脉弓分支血管,主要受累血管为无名动脉(66.7%)和右颈总动脉(53.3%)。其中40.0%的患者主动脉弓分支继发夹层合并血栓(表1,图1)。
2.3 AAD 患者脑梗死灶部位及大小 AAD 患者脑梗死以多发灶为主(73.3%,33/45),45 例患者共出现149 处梗死灶,右侧79 处(53.0%),左侧70 处(47.0%),两侧差异无统计学意义(P>0.05)。病灶最好发于基底节区(21.5%,32/149),其次以额叶(16.8%,25/149)、顶叶(16.8%,25/149)、侧脑室旁(16.1%,24/149)(χ2=93.121,P<0.01)。脑梗死灶平均体积为(0.7±0.1)cm3,累及组和未累及组脑梗死灶体积差异无统计学意义(P>0.05,表2、图2)。
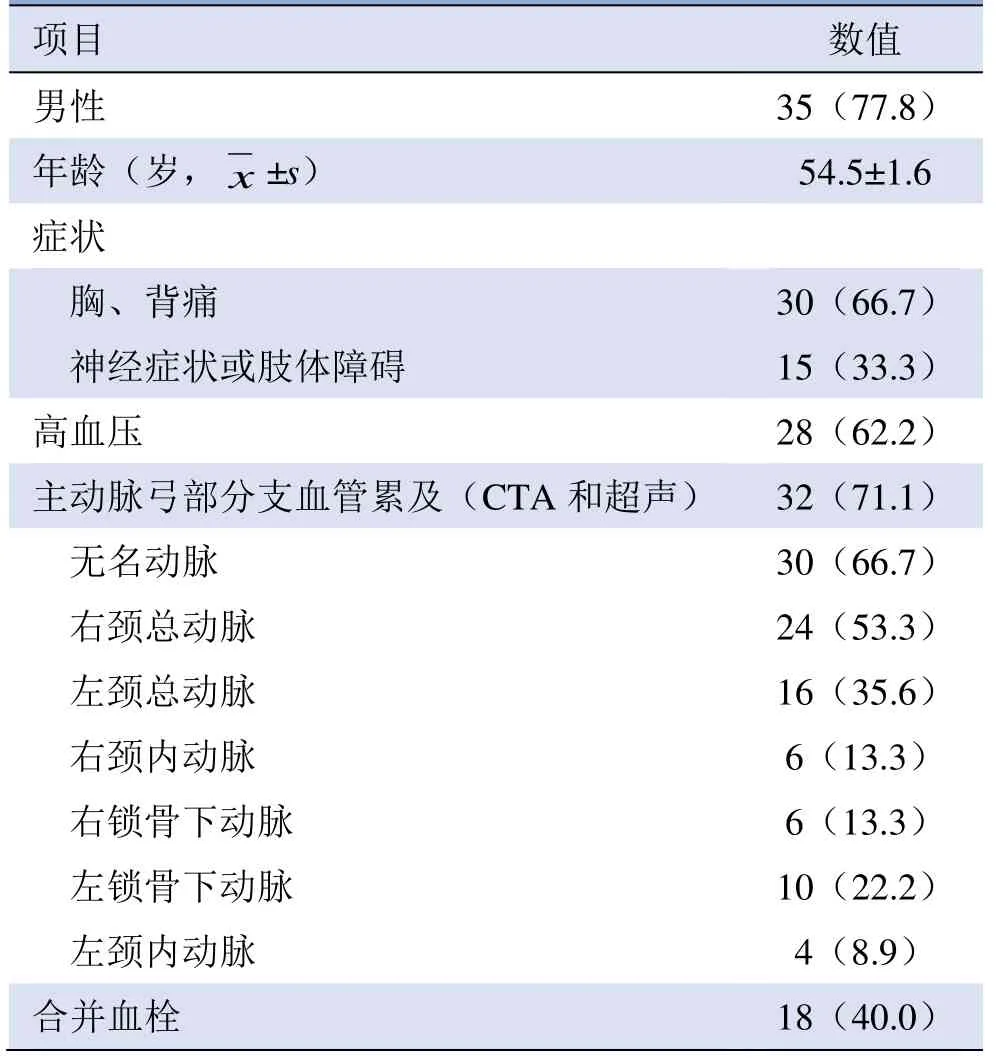
表1 45 例AAD 合并脑梗死患者一般资料及弓部血管累及情况[例(%)]
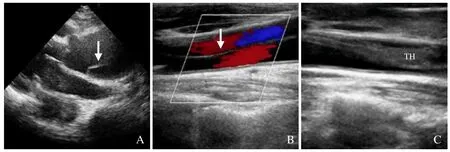
图1 A 型主动脉夹层(AAD)主动脉弓部分支累及超声图像。A. AAD 升主动脉内撕脱内膜(箭);B.右颈总动脉继发夹层撕脱内膜(箭);C.右颈总动脉夹层合并血栓(TH)
2.4 AAD 合并脑梗死患者死亡及预后 45 例AAD 患者中,8 例确诊后放弃治疗(其中未累及组1 例,累及组7 例)。37 例患者经Chi-square 检验分析两组围术期死亡率,结果显示累及组病死率为60.0%(15/25),高于未累及组的25.0%(3/12),差异有统计学意义(P=0.046)。
住院治疗的37 例AAD 患者分为死亡组和存活组,与存活组比较,死亡组的平均梗死灶范围较大[(1.18±0.25)cm3比(0.54±0.12)cm3,P=0.014];脑梗死病灶数目较多(4.40±0.53 比3.00±0.33,P=0.025);死亡组额叶、基底节区的梗死灶数目较多(P<0.05)(表2、3)。
3 讨论
急性AAD 是致命的血管急症,24 h 病死率高达25%[7]。本课题组前期研究表明,随着升主动脉夹层撕裂内膜延伸,弓部分支血管受累的几率增加,脑供血不足,脑梗死的发生风险也随之增加[5]。近年研究报道AAD 是脑梗死的高危因素,应引起临床重视[8-10]。
本研究结果显示,AAD 合并脑梗死患者以中年男性多见,该群体中主动脉弓部分支累及率高达71.1%,最易受累的是无名动脉(66.7%)和右颈总动脉(53.3%),是主动脉弓部最靠近心脏的分支血管,与易损斑块的好发部位一致,可能与解剖和血流流场压力分布有关。主动脉突发夹层引起弓部血流急剧变化,对入颅血流量的影响首当其冲,这一现象已得到证实[5]。
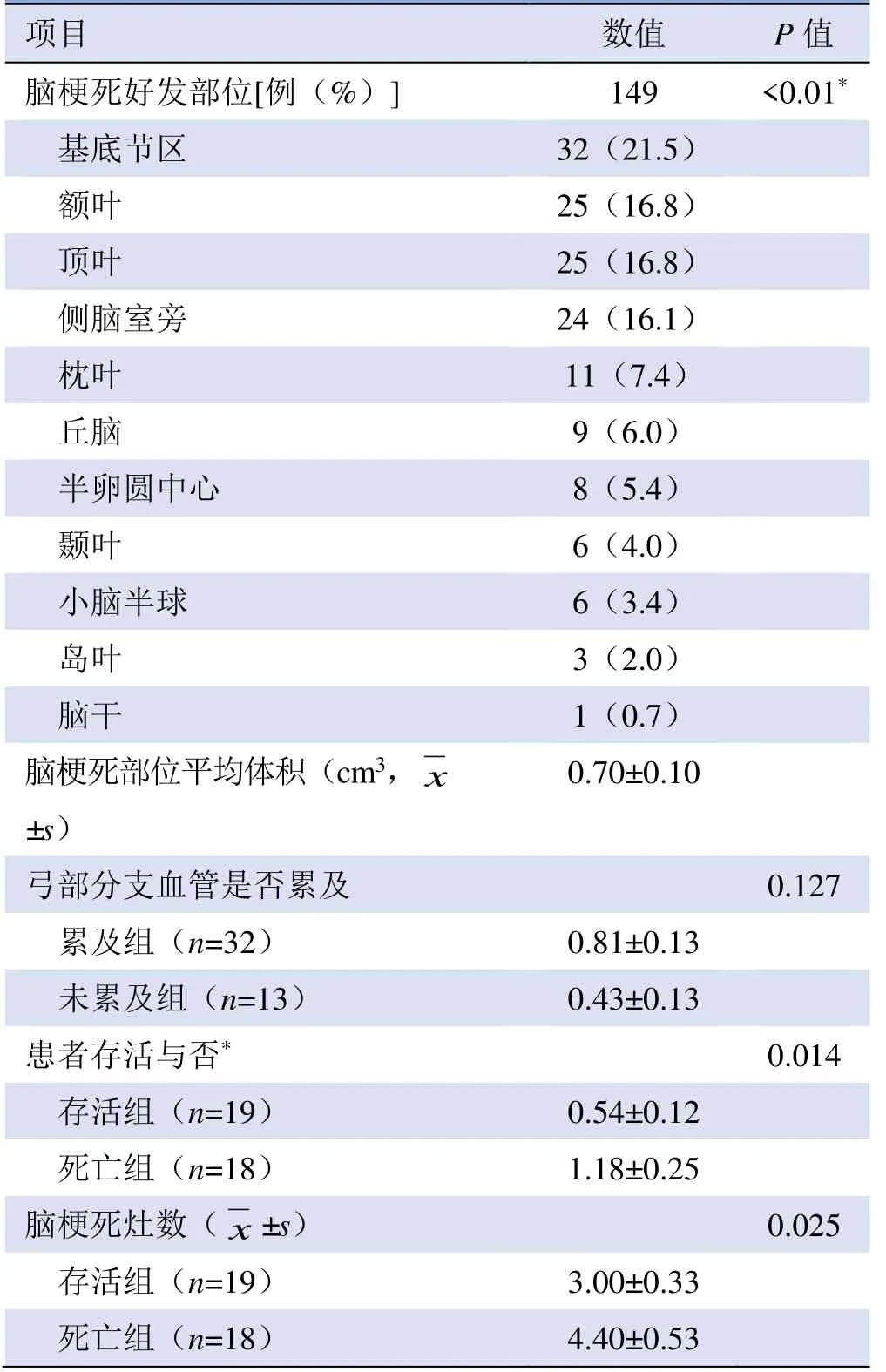
表2 45 例AAD 合并脑梗死患者149 处梗死部位及体积
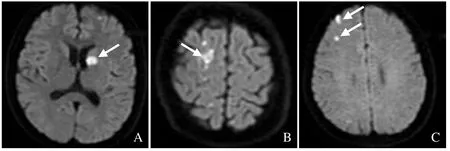
图2 AAD 合并脑梗死患者梗死灶部位。A~C 分别为左侧基底节区、右侧顶叶、右侧额叶脑梗死灶(箭)
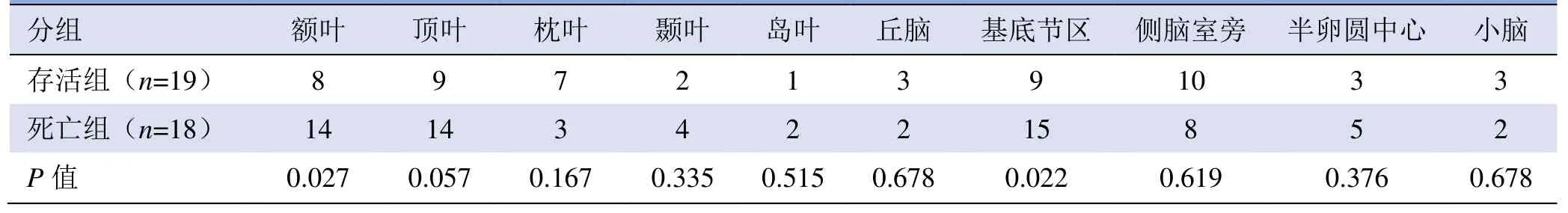
表3 AAD 合并脑梗死患者124 处梗死部位分布及数目
头颅MRI 检查显示,多数患者为多发病灶,双侧半球脑梗死部位可见于额叶、顶叶、枕叶、颞叶、侧脑室旁、基底节区、小脑等,最好发于基底节区(21.5%)。分析AAD 夹层合并脑梗死可能的发病机制为,①血流动力性梗死:AAD 患者主动脉弓部分支累及,脑血流频谱异常,脑供血不足,故出现血流动力学梗死-分水岭区皮质下型(侧脑室旁、基底节区)梗死[11]。②栓塞性梗死:部分AAD 患者颈总动脉或颈内动脉颅外段继发夹层合并血栓,破损的内中膜导致远端脑血管栓塞发生,从而出现皮质及小脑多发性梗死,特别是小脑、枕叶、颞叶内下部梗死。
通过比较不同组别患者脑梗死体积发现,尽管AAD 合并脑梗死患者的平均梗死灶体积并不大且无明显差异,但弓部分支累及组患者的围术期病死率仍高于未累及组(60.0%比25.0%,P=0.046),提示主动脉弓部分支累及是AAD 合并脑梗死患者围术期死亡的危险因素,与本课题组前期研究结果一致[12]。
比较存活与死亡患者梗死灶大小、梗死灶数目及梗死灶不同部位的发生率,发现死亡患者的脑梗死病灶大小、数目显著高于存活组,且额叶、基底节区的梗死灶数目较多,提示梗死范围越大,部位越凶险,病灶数目越多,死亡风险越高。因此,临床确诊ADD后,需行颈部血管超声检查,如合并主动脉弓部分支异常者,必须提高警惕,及时采取手术及相应措施,预防脑梗死发生或范围扩大,降低死亡率,改善患者的预后。

