低表达衰老标记蛋白30对高钙状态下人晶状体上皮细胞增殖和氧化的影响
李松蔓,韩子豪,Aint Thu Thu Win,陈 曦,梁 皓
0引言
衰老标记蛋白30(senescence marker protein 30,SMP30),亦称Regucalcin(RGN),是一种与衰老相关的钙调节蛋白[1]。研究报道,SMP30在白内障患者晶状体上皮细胞(lens epithelial cells,LECs)中的含量高于正常人,但其在60岁以上白内障患者中的含量低于60岁及以下患者[2],而SMP30下调导致人LECs衰老及凋亡程度加剧[3-4],提示SMP30含量减少可能与白内障形成有关。持续高钙导致钙稳态丧失是白内障的关键致病因素[5],然而,SMP30作为一种钙调节蛋白,其在高钙/钙紊乱状态下对人LECs影响的文献报道较少。本研究通过体外构建高钙培养状态,模拟发生白内障时人LECs的病理状态,同时合成人SMP30靶向基因RGN的RNA干扰(RNA interference,RNAi)序列,下调SMP30在人LECs系SRA01/04中的表达,研究细胞增殖、氧化指标的改变,探讨SMP30在白内障形成中的作用。
1材料和方法
1.1材料人LECs系SRA01/04(广州吉妮欧生物科技公司),慢病毒包装细胞人肾上皮细胞系293T、病毒包装辅助质粒pHelper1.0质粒、pHelper2.0质粒(上海吉凯基因化学技术有限公司);RPMI 1640培养基、0.25%胰蛋白酶、胎牛血清(美国Gibco公司),青霉素、链霉素(美国Sigma公司),磷酸缓冲盐溶液(phosphate buffer saline,PBS,北京索莱宝科技有限公司),总RNA提取试剂盒(美国Axyen公司),逆转录试剂盒(Takara公司,RR047A),BrdU-Elisa试剂盒(瑞士Roche公司),总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(WST-1法)、氧化型谷胱甘肽/总谷胱甘肽(oxidized glutathione/total glutathione,GSSG/T-GSH)试剂盒(南京建成生物工程研究所);细胞培养超净台(新加坡艺思高科技有限公司),二氧化碳恒温培养箱(美国Thermo Scientific公司),倒置相差显微镜(日本Olympus公司),Real time PCR仪器(Agilent公司),酶标仪(瑞士Tecan公司)。
1.2方法
1.2.1细胞培养SRA01/04细胞用含体积分数10%的胎牛血清、100U/mL青霉素和100μg/mL链霉素(pH 7.4)的RPMI 1640培养基培养,并置于环境为37℃、含体积分数5% CO2和95%空气的细胞培养箱中培养。
1.2.2构建RGN-RNAi慢病毒表达载体
1.2.2.1设计并合成short hairpin RNA(shRNA)引物根据NCBI Genebank中人RGN基因(NM_152869.3)mRNA序列,遵循RNAi序列设计原则,设计3条RNAi靶点序列用于干扰SMP30靶向基因RGN的表达,同时以Scramble序列作为阴性对照,BLAST分析排除其他非特异同源性序列。实验分组如下:实验组(RGN表达干扰组1~3,knock down group 1~3,KD1~3),阴性对照组(空载体组,negative control group of knock down,NCKD),空白对照组(SRA01/04细胞组,blank control group,CON)。3条RNAi靶点序列分别为:KD1(RGN-RNAi-1):ACCTGAAGCTGGTGGAATT;KD2(RGN-RNAi-2):TGTGAAGTTGCCTGTTGAT;KD3(RGN-RNAi-3):ACCGCAGAAGTGTTTACAA。Scramble序列(NCKD)为:TTCTCCGAACGTGTCACGT。将上述4段序列分别设计合成shRNA寡核苷酸单链,每对由正义链和反义链组成(表1),在5’和3’端分别加入Age Ⅰ和EcoRⅠ酶切位点,在退火后形成含短发夹结构的小片段双链DNA(double-stranded DNA,dsDNA)。
1.2.2.2 RGN-RNAi慢病毒载体的构建与鉴定通过T4 DNA连接酶,将Age Ⅰ+EcoR Ⅰ双酶切线性化成功的慢病毒载体GV248(框架结构:hU6-MCS-Ubiquitin-EGFP-IRES-puromycin)和上述dsDNA混合进行连接反应。随后将连接好的重组质粒转化感受态的大肠杆菌,用含氨苄青霉素培养基选择阳性克隆,对单菌落进行扩增培养,最后进行菌落PCR及DNA测序鉴定,验证重组克隆中插入片段序列是否与设计的目标序列一致。其中,通用引物为:上游5’-CCATGATTCCTTCATATTTGC-3’,下游5’-ATGTCCTTCTGCTGATACTGGG-3’。
1.2.2.3 RGN-RNAi慢病毒颗粒的包装与质检选择测序正确的菌液转接于10mL的LB液体培养基中,37℃培养24h,通过天根无内毒素质粒小提中量试剂盒抽提合格的质粒。取对数生长期的慢病毒包装细胞293T细胞接种于10cm细胞培养皿中(细胞密度:5×106个/15mL),置于细胞培养箱中培养约24h,待细胞密度达70%~80%时用于感染。感染前用无血清的培养基培养293T细胞2h。将提取合格的GV248载体质粒20μg、pHelper1.0质粒15μg、pHelper2.0质粒10μg及相应体积的吉凯感染试剂均匀混合,调整使混合液总体积为1mL,室温孵育15min。将混合液缓慢滴入293T细胞培养液中,轻混匀避免将细胞吹起,置于细胞培养箱培养。6h后移除含感染混合液的培养基,用10mL PBS轻洗培养皿一次,缓慢加入20mL含体积分数为10%胎牛血清的培养基。继续培养细胞48~72h后收集293T细胞上清液,4℃、4 000g离心10min,0.45μm滤器过滤、收集上清液,再次4℃、8 000g离心2h,移除液体并保留沉淀,加入吉凯病毒保存液重悬充分溶解沉淀,4 000g高速离心5min,按要求分装上清。最后对慢病毒进行质检和病毒滴度检测。
1.2.3 RGN-RNAi慢病毒感染SRA01/04细胞
1.2.3.1慢病毒感染细胞的预实验用完全培养基制备密度为2×103个/每孔的SRA01/04细胞悬液,取100μL/孔加入96孔板,继续培养24h。分别制备含50μg/mL Polybrene(助感染剂)的完全培养基[P(M)];含50μg/mL Polybrene的感染增强剂(enhanced infection solution,Eni.S.)[P(E)],各200μL;用Eni.S.将病毒稀释成三种滴度:1×108、1×107、1×106TU/mL,各50μL。在每孔细胞融合度为20%~30%时,根据表2分别更换培养液和加入病毒液进行细胞感染:A组:常规培养基+病毒;B组:常规培养基+病毒+ P(M);C组:Eni.S.+病毒;D组:Eni.S.+P(E)+病毒。混匀后继续培养8~12h,观察细胞形态并更换培养基。在感染约3~4d、细胞绿色荧光表达丰度较高、感染效率约80%且细胞状态良好时,所对应的感染条件及感染复数(multiplicity of infection, MOI)可用于后续正式感染SRA01/04细胞的实验。由于此慢病毒含有嘌呤霉素抗性基因,故可在感染3~4d后往完全培养基中加入适量嘌呤霉素以筛选目标基因稳定表达的细胞。
表1 针对人RGN基因序列设计的寡核苷酸单链

No5 STEMPLOOPSTEMP3 shRNA-KD1-FCcggcaACCTGAAGCTGGTGGAATTCTCGAGAATTCCACCAGCTTCAGGTtgTTTTTgshRNA-KD1-RaattcaaaaacaACCTGAAGCTGGTGGAATTCTCGAGAATTCCACCAGCTTCAGGTtgshRNA-KD2-FCcggacTGTGAAGTTGCCTGTTGATCTCGAGATCAACAGGCAACTTCACAgtTTTTTgshRNA-KD2-RaattcaaaaaacTGTGAAGTTGCCTGTTGATCTCGAGATCAACAGGCAACTTCACAgtshRNA-KD3-FCcggcaACCGCAGAAGTGTTTACAACTCGAGTTGTAAACACTTCTGCGGTtgTTTTTgshRNA-KD3-RaattcaaaaacaACCGCAGAAGTGTTTACAACTCGAGTTGTAAACACTTCTGCGGTtgshRNA-NCKD-FCcggTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTTgshRNA-NCKD-RaattcaaaaaTTCTCCGAACGTGTCACGTTCTCTTGAAACGTGACACGTTCGGAGAA
表2 感染预实验分组和感染条件
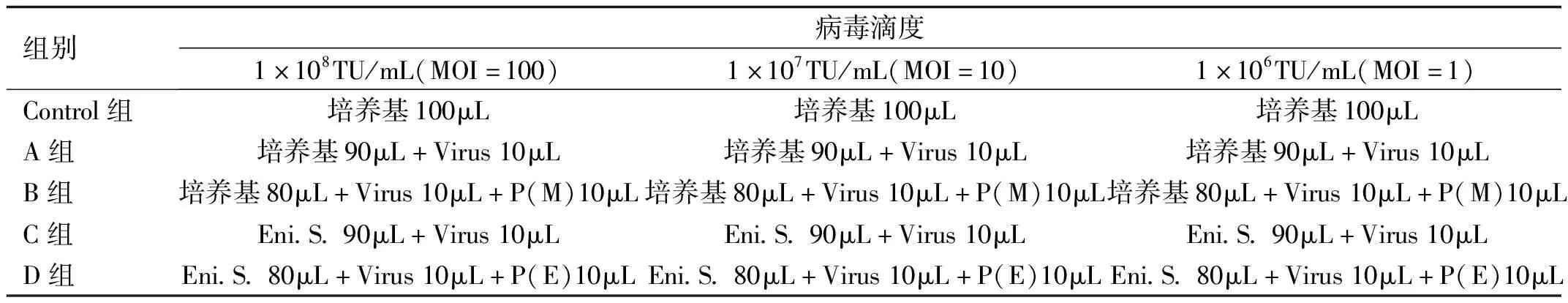
组别病毒滴度1×108TU/mL(MOI=100)1×107TU/mL(MOI=10)1×106TU/mL(MOI=1)Control组培养基100μL培养基100μL培养基100μLA组培养基90μL+Virus10μL培养基90μL+Virus10μL培养基90μL+Virus10μLB组培养基80μL+Virus10μL+P(M)10μL培养基80μL+Virus10μL+P(M)10μL培养基80μL+Virus10μL+P(M)10μLC组Eni.S.90μL+Virus10μLEni.S.90μL+Virus10μLEni.S.90μL+Virus10μLD组Eni.S.80μL+Virus10μL+P(E)10μLEni.S.80μL+Virus10μL+P(E)10μLEni.S.80μL+Virus10μL+P(E)10μL
1.2.3.2 RT-PCR筛选干扰效果佳的RGN-RNAi慢病毒载体选取各组适量感染成功的细胞,常规消化、离心收集细胞沉淀,通过总RNA提取试剂盒收集细胞内RNA,用逆转录试剂盒将RNA逆转录为cDNA,最后用Real time PCR 仪器检测各组感染SRA01/04细胞中相对RGN mRNA的表达情况。内参基因和目的基因引物由吉凯基因设计合成,RGN-F:5’-GGTCGCTAGACCACAAAATCT-3’,RGN-R:5’-CTAAACGAATCACTCTTCCTCC-3’,扩增片段大小为210bp;内参基因引物为GAPDH-F:5’-TGACTTCAACAGCGACACCCA-3’,GAPDH-R:5’-CACCCTGTTGCTGTAGCCAAA-3’,扩增片段大小为121bp。反应体系为20μL。反应参数:95℃预变性30s,95℃变性15s,60℃复性延伸30s,进行40次循环;熔解曲线为95℃ 5s,60℃ 60s,95℃ 5s continuous,最后50℃ 30s结束反应。采用2-△△Ct法计算基因表达的相对比值。
1.2.4 RGN-RNAi对高钙状态下细胞增殖和氧化应激的影响
1.2.4.1构建SRA01/04细胞高钙培养状态参考课题组前期研究结果[6],用含15mmol/L CaCl2的完全培养基处理SRA01/04细胞24h模拟白内障形成时细胞外高钙/钙紊乱的病理状态。在后续实验中,将选用RGN-RNAi干扰效果最佳的实验组、NCKD组及CON组在此状态培养后,进行细胞增殖活力和氧化指标的检测。
1.2.4.2 BrdU-Elisa法检测高钙状态下的细胞增殖活力按细胞量2×103个/孔均匀接种于96孔板,在高钙培养状态下,于细胞贴壁后第1、4d检测细胞增殖活力。参照BrdU-Elisa试剂盒操作说明,用培养基以1∶100稀释BrdU原液,在检测前每孔加入10μL稀释后的BrdU试剂,作用8h。吸弃上述液体,室温避光,分别加入FixDenat试剂(200μL/孔)和10% BSA(200μL/孔)进行固定及封闭各30min;用Anti-BrdU-POD工作液(200μL/孔)孵育90min。用无菌双蒸水按1∶10稀释washing Buffer,每孔加入200~300μL,洗板3次,待干。随后在空的细胞板外盒中加入无菌双蒸水,将待测培养板放入其中,无菌双蒸水没过培养孔,待干。室温避光,加入substrate solution(100μL/孔)作用5~30min,待液体变成蓝色,加入10% H2SO4(50μL/孔),使用酶标仪检测单波长为450nm时的OD值。
1.2.4.3高钙状态下细胞氧化指标的检测检测细胞内SOD活性及GSSG/T-GSH水平以反映细胞抗氧化及氧化水平的变化。SOD活性用总SOD测定试剂盒(WST-1法)检测,细胞常规消化、离心收集细胞沉淀,用500μL PBS轻洗细胞2次,离心收集细胞沉淀,加入500μL PBS轻吹匀,在冰水浴下超声碎解细胞,将该原液稀释成梯度浓度样本待用,用酶标仪读取测定OD450nm,核酸微量检测仪测定样本蛋白浓度,计算SOD活力。GSSG/T-GSH水平用GSSG/T-GSH试剂盒检测,细胞处理步骤同前,加入500μL试剂4(试剂盒自带)混匀后在冰水浴下超声碎解细胞,酶标仪测出OD450nm数值,计算GSSG/T-GSH比值。
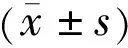
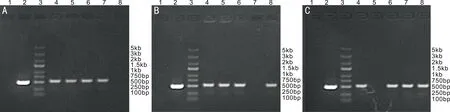
图1RGN-RNAi载体阳性克隆的PCR鉴定A:RGN-RNAi-1;B:RGN-RAi-2;C:RGN-RNAi-3。1:以ddH2O为空白对照模板,拟鉴定体系无污染;2:以未插入靶向基因的空载体为阴性对照模板,拟证明扩增过程无假阳性现象;3:Marker;4~8:RGN-RNAi转化子鉴定。
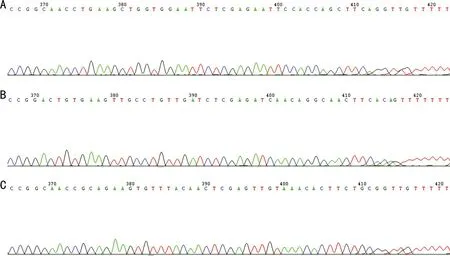
图2RGN-RNAi重组质粒测序结果A:RGN-RNAi-1;B:RGN-RNAi-2;C:RGN-RNAi-3。
2结果
2.1 RGN-RNAi慢病毒载体的鉴定菌落PCR鉴定结果显示,连接入shRNA片段的阳性克隆片段大小为542bp,没有连接入shRNA片段的空载体克隆片段大小为508bp,结合PCR电泳图初步证实阳性克隆的目的基因片段已正确插入GV248慢病毒载体(图1)。选取连接成功的克隆进行测序分析,结果提示3组慢病毒载体均有已设计的目的基因片段,其序列和设计的人RGN寡核苷酸序列完全相同(图2),再次证实目的基因片段已插入GV248载体中,重组RGN-RNAi慢病毒载体构建成功。
2.2 RGN-RNAi慢病毒包装与滴度测定本研究所使用的GV248慢病毒载体携带增强型绿色荧光蛋白(enhanced green fluorescence protein,eGFP)基因,是一种广泛用于细胞内靶蛋白分子定位和功能观察的报告基因,故可通过观察细胞内GFP的表达情况分析感染结果。将携带靶向基因的GV248载体质粒、病毒包装辅助质粒(pHelper1.0载体质粒+pHelper2.0载体质粒)同时感染293T细胞,收集、浓缩、纯化病毒。用荧光法测定滴度,取10μL浓缩后的病毒采用10倍梯度稀释后感染293T细胞,根据稀释倍数及GFP的表达情况,可见荧光细胞数随稀释倍数的增加而减少,RGN-RNAi-1、RGN-RNAi-2、RGN-RNAi-3三种慢病毒的滴度分别为8×108、1×109、1×109TU/mL,提示均有大量质粒转入293T细胞,病毒包装成功(图3)。
2.3 RGN-RNAi慢病毒感染SRA01/04细胞预实验结果表明,细胞贴壁率达到约20%时,以MOI=5为基础,配置含适量的慢病毒及5μg/mL助感染试剂的完全培养基,培养细胞约16h后更换为普通完全培养基,约72h后荧光显微镜观察可见感染细胞有GFP表达,感染效率接近80%,且细胞生长状态良好,感染细胞多次传代形态均一且性状稳定,提示细胞感染成功。后续实验以细胞5×104个/孔均匀接种于6孔板进行正式感染,用于增加每次感染细胞的数量,接种体积为2mL/孔,换液体积为1mL/次(图4)。
2.4 RGN-RNAi对SRA01/04细胞RGN基因表达的影响RGN-RNAi慢病毒以优化条件感染SRA01/04细胞后,收集RNA样品,应用Real time PCR检测SMP30靶向基因RGN mRNA表达水平的变化,结果显示,CON组、NCKD组、实验组(KD1~3)细胞RGN mRNA相对表达量分别为0.95±0.08、1.00±0.03、0.07±0.01、0.40±0.06、0.26±0.04,差异有统计学意义(F=191.734,P<0.001;n=3);CON组和NCKD组细胞RGN mRNA的表达水平差异无统计学意义(P=0.26),提示慢病毒空载质粒感染对SMP30靶向基因RGN的表达无特异性的影响;与NCKD组相比,实验组(KD1~3)细胞RGN mRNA水平均有不同程度降低(均P<0.001),实验组(KD1~3)的敲减效率分别为93%、60%、74%,故选择干扰效果最佳的KD1组shRNA片段进行后续实验。
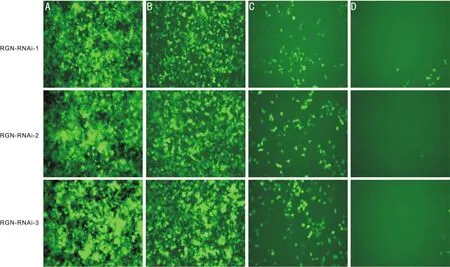
图3RGN-RNAi慢病毒感染293T细胞后的滴度测定荧光图(×100)A:1μL病毒原液;B:0.1μL病毒原液;C:0.01μL病毒原液;D:0.001μL病毒原液。
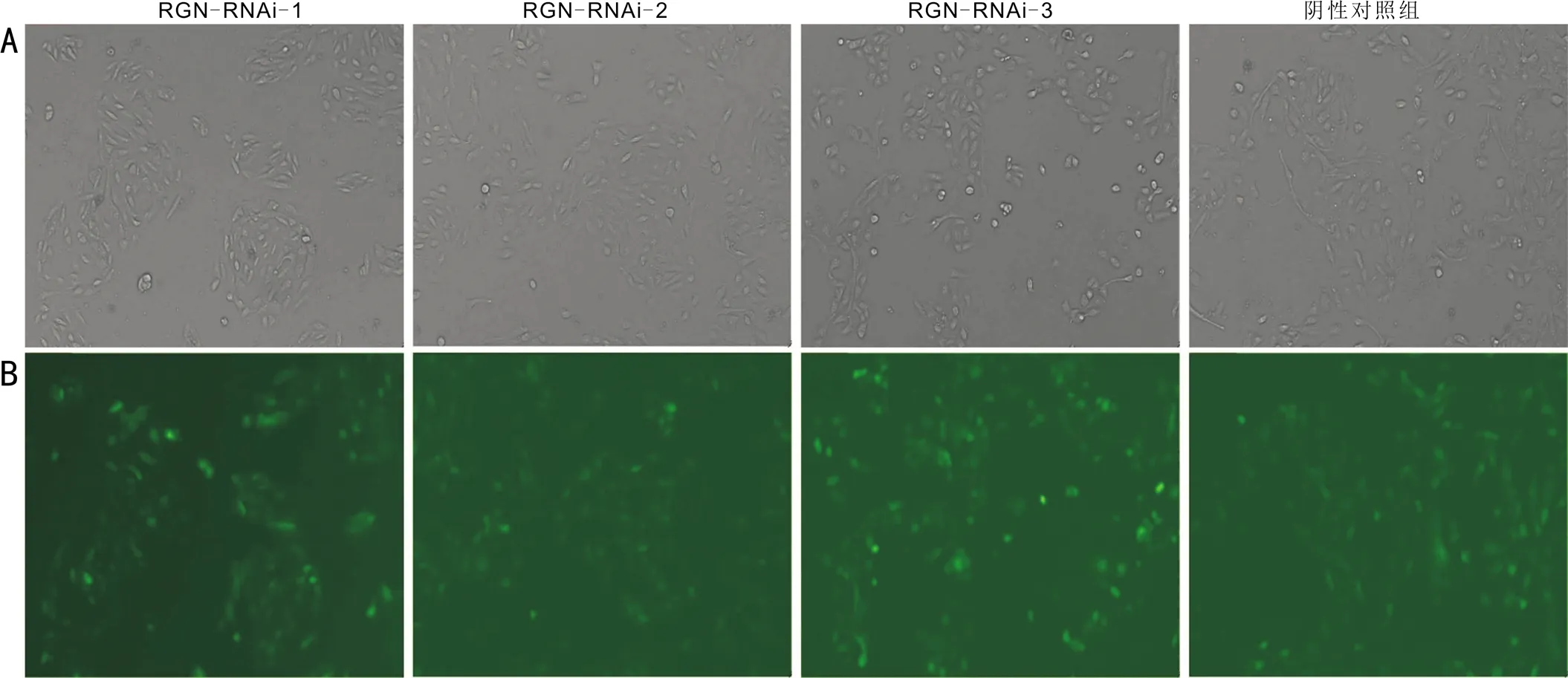
图4RGN-RNAi慢病毒感染SRA01/04细胞(×100)A:光学显微镜下观察;B:荧光显微镜下观察。
2.5 RGN-RNAi对高钙状态下SRA01/04细胞增殖的影响本研究以第4d与第1d OD450nm的比值(ODday4/ODday1)表示各组细胞的相对增殖活力。Brdu-Elisa检测结果显示,高钙状态下,CON组、NCKD组、实验组(KD1)细胞相对增殖活力分别为2.96±0.25、2.95±0.08、2.42±0.08,差异有统计学意义(F=11.37,P=0.01;n=3);实验组(KD1)细胞相对增殖活力低于CON组和NCKD组(均P=0.01),但CON组和NCKD组之间差异无统计学意义(P=0.97)。
2.6 RGN-RNAi对高钙状态下SRA01/04细胞氧化应激的影响SOD活性检测结果显示,高钙状态下,CON组、NCKD组、实验组(KD1)细胞SOD活力分别为26.33±1.04、31.10±2.24、11.69±0.52U/mg,差异有统计学意义(F=57.81,P=0.01;n=3);实验组(KD1)细胞SOD活力低于CON组和NCKD组(均P<0.001),但CON组和NCKD组之间差异无统计学意义(P=0.07)。
GSSG/T-GSH水平检测结果显示,高钙状态下,CON组、NCKD组、实验组(KD1)细胞GSSG/T-GSH水平分别为20.05±2.45、15.93±3.47、70.80±2.34,差异有统计学意义(F=357.63,P<0.001;n=3);实验组(KD1)细胞GSSG/T-GSH水平高于CON组和NCKD组(均P<0.001),但CON组和NCKD组之间差异无统计学意义(P=0.12)。
3讨论
SMP30基因定位于X染色体的11.3~11.23区域,由7个外显子和6个内含子组成,有研究发现,SMP30与一种编码Regucalcin蛋白的cDNA相同,两者均随机体衰老而逐渐减少,不受性别因素影响,故认为两者为同一种蛋白,其靶向基因符号为RGN。SMP30每分子蛋白质存在6~7个Ca2+高亲和结合位点,其在肝、肾等组织细胞内钙稳态、细胞增殖、氧化应激、凋亡等方面发挥调控作用,故SMP30是一种具备多重保护作用的钙结合蛋白及钙信号转导蛋白,提示其在机体内的表达水平可能与衰老相关性疾病的分期相关,SMP30或许可作为机体衰老、疾病发生和进展的潜在性标记物[7-10]。
近年研究发现,SMP30与白内障密切相关。在临床研究中,SMP30在年龄相关性白内障患者晶状体前囊膜周边部的LECs表达强,中央部表达弱,SMP30低表达区域出现人LECs衰老及凋亡程度加剧[3-4]。在体外正常培养状态下,下调SMP30可使人LECs系SRA01/04细胞增殖活性下降、凋亡率增加[11]。动物模型研究,在紫外线B照射诱导下,SMP30基因敲除小鼠由于内源性维生素C生成障碍而较野生型小鼠及维生素C喂养型KO小鼠更易出现晶状体混浊[12]。提示SMP30可能是LECs内的一种保护性蛋白,其含量下降可能诱导/加速白内障的形成。
RNAi是一种广泛应用于基因功能研究的基因阻断技术,构建shRNA载体是目前RNAi最常用的方法之一,慢病毒载体能够产生表达高滴度shRNA的慢病毒,通过慢病毒载体介导RNAi,即结合慢病毒载体高效、整合的优点与RNAi的特性,可长期、稳定地抑制靶向基因的表达,并传代到子代细胞中,是构建理想的实验细胞模型的常见技术,其在白内障基础研究中的应用也愈加广泛[13-14]。故本研究以慢病毒为载体,利用shRNA抑制人SMP30靶向基因RGN的表达,最终成功构建干扰SMP30表达效果佳、感染SRA01/04效率高的shRNA慢病毒载体,以SMP30低表达人LECs系SRA01/04细胞为基础开展系列研究。
关于白内障病因学的基础研究表明,持续高钙和氧化损伤状态是白内障重要的发病因素。既往国内外学者通过含高浓度Ca2+的培养液培养透明晶状体和LECs发现,晶状体混浊与体外Ca2+浓度的增加相关,细胞外异常的高钙浓度可使LECs钙稳态丧失,最终导致白内障[15-16]。此外,Ca2+超载又可破坏线粒体、内质网等钙、氧化调节相关细胞器结构,加聚钙紊乱及氧化应激程度,并形成恶性循环[17-18]。SOD活力和GSSG/T-GSH水平能间接反映细胞抗氧化损伤能力和氧化应激程度。故本研究结合前期研究结果,选用15mmol/L CaCl2配制高钙培养基,培养SRA01/04细胞24h,通过体外构建高钙培养状态,用于模拟白内障形成过程中人LECs出现高钙/钙紊乱的病理状态。我们发现,在高钙培养状态下,下调SMP30的表达,可导致SRA01/04细胞增殖活力及抗氧化能力减弱,细胞内氧化应激程度加剧。有文献报道,SMP30/Regucalcin作为一种钙调节蛋白,可通过增加细胞肌浆网Ca2+-ATP酶(SERCA)活性、线粒体Ca2+-ATP酶活性和ATP依赖性Ca2+摄取加速肌质网和线粒体中Ca2+的摄取,以维持细胞内钙稳态和增加细胞存活率的作用[19-21]。由此我们分析,在高钙诱导细胞损伤的状态下,SMP30在SRA01/04细胞中可能也具有调节Ca2+信号转导有关的酶活性、维持细胞钙稳态的作用,当SMP30含量减少,其对SRA01/04细胞的保护作用减弱,使细胞易处于各种损伤因素所致的Ca2+异常波动的环境,加剧细胞内钙紊乱及氧化损伤的程度,导致细胞增殖活力下降或细胞死亡,最终诱导白内障的形成或发展。
综上所述,高钙培养状态下,shRNA慢病毒载体介导的SMP30低表达SRA01/04(人LECs)细胞增殖活力及抗氧化应激能力减弱,提示增加细胞外Ca2+浓度模拟人LECs在白内障形成的病理状态条件,SMP30的存在可能在一定程度上延缓了SRA01/04细胞应激损伤进程,具有调控细胞增殖和抗氧化损伤的保护作用。虽已有研究报道高表达SMP30在人LECs系中具有增加细胞生存率、抗凋亡、抑制活性氧、延缓紫外线损伤等作用[11,22],但本实验从另一角度开展低表达SMP30对人LECs作用的初步研究,为未来探索SMP30在人LECs和晶状体中的作用提供了新的实验基础。然而,关于SMP30在人LECs内可能参与钙调控信号通路的具体机制等内容尚未明确,有待后期进一步研究。
- 国际眼科杂志的其它文章
- Effects of sunlight on the eye
- Histopathological analysis of the correlation between uveal melanomas and retinal tissue
- Curcumin alleviates LPS-induced retinal inflammation by inhibiting PI3k/Akt signaling pathway
- 灯盏花素通过调节Bcl-2和Bax表达拮抗高糖诱导的RPE细胞损伤
- 455~470nm波长的面阵蓝光对SD大鼠视网膜组织结构的影响
- 先天性视网膜色素上皮肥大的研究现状

