灯盏花素通过调节Bcl-2和Bax表达拮抗高糖诱导的RPE细胞损伤
刘海峰,赵永厚,高 源
0引言
糖尿病的发生是在遗传的基础上,糖尿病患者体内长期高血糖状态导致多元醇代谢通路异常,蛋白激酶C激活,糖基化血红蛋白和多元醇代谢产物因机体代谢障碍而逐渐堆积,氧化应激增强、细胞因子失衡等多因素共同参与、互相作用,破坏了视网膜生理屏障并启动了氧化应激损伤[1-2]。灯盏花素(scutellarin)主要活性成分是灯盏乙素,具有抑制炎症反应、减轻组织水肿、改善微循环、抗氧化、扩张血管的作用[3]。本研究通过构建高糖条件下视网膜色素上皮(retinal pigment epithelial,RPE)细胞氧化损伤模型,探讨灯盏花素对RPE细胞的保护作用和机制。
1材料和方法
1.1材料灯盏花素(美国Sigma公司,纯度>99%),人RPE细胞(美国ATCC公司),DMEM/F12(1∶1)培养基(武汉博士德生物工程有限公司),CCK-8试剂盒(北京索莱宝科技有限公司), H2DCFDA荧光探针(江苏凯基生物公司),Hoechst 33258染色试剂盒(北京百奥莱博公司),Bcl-2和Bax抗体(上海碧云天生物技术有限公司)。
1.2方法
1.2.1 RPE细胞的培养选取加入青-链霉素和10%胎牛血清的DMEM/F12作为培养基,37℃、饱和湿度、5% CO2培养箱中进行RPE细胞培养(本实验中的RPE细胞为传代第6代)。
1.2.2 RPE细胞分组依据灯盏花素浓度不同,分为四组:对照组RPE细胞以正常培养液(葡萄糖浓度为5.5mmol/L)孵育36h;高糖组RPE细胞培养液内葡萄糖浓度为30mmol/L,细胞孵育时间为12h[4];灯盏花素低浓度组先以1μmol/L灯盏花素孵育细胞24h,PBS冲洗细胞3次,以换液方式在葡萄糖浓度为30mmol/L的培养液继续孵育12h;灯盏花素高浓度组先以10μmol/L灯盏花素孵育细胞24h,PBS冲洗细胞3次,以换液方式在葡萄糖浓度为30mmol/L的培养液继续孵育12h。
1.2.3细胞划痕实验观察RPE细胞的迁移性以1×105/mL的密度将RPE细胞接种到6孔板,按上述方法处理细胞并分组,待细胞贴壁融合后24h,用2μL加样枪头比着直尺在培养板中间垂直划痕,PBS冲洗划下的细胞,加入无血清的DMEM/F12继续培养,在48h时间点进行取样、拍照记录。实验重复3次。
1.2.4 CCK-8法测定细胞增殖RPE细胞培养于96孔板内,每孔200μL,细胞密度为1×105个/mL,按实验分组处理,弃去原有培养液,将已配制含10% CCK-8的培养基以换液的形式加入,接种后的96孔板37℃培养箱中继续培养4h,用480nm吸光度进行检测。
1.2.5流式细胞技术检测RPE细胞内活性氧表达用不含EDTA的胰酶消化RPE细胞后制备细胞悬液,1 000r/min离心5min并收集细胞,预冷的PBS洗涤细胞3次,收集细胞并用100μL缓冲液重悬细胞,加入5μL Annexin-V和10μL PI,轻轻混匀,避光反应10min后再次加入100μL缓冲液,1h内用流式细胞仪检测细胞凋亡率。
1.2.6细胞凋亡的形态学观察细胞经相应处理后用PBS洗涤细胞2次,4%多聚甲醛固定细胞10min后PBS充分冲洗固定液,加入2μL Hoechst 33258染色液,避光反应10min后PBS充分冲洗,倒置荧光显微镜下观察并拍照。
1.2.7 Western Blot检测Bcl-2和Bax蛋白表达水平收集细胞并提取总蛋白,10 000r/min离心10min后取上清,行10% SDS-聚丙烯酰胺凝胶电泳,转膜后5%脱脂奶粉4℃封闭2h,加羊抗兔多克隆一抗(稀释浓度1∶1 000 )过夜,室温下孵育鼠抗羊二抗(稀释浓度1∶2 000)1h,ECL化学发光法自显影并采集图像,观察Bcl-2和Bax的Western Blot条带变化。
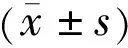
2结果
2.1细胞划痕实验检测高糖下RPE细胞的迁移性四组RPE细胞迁移率比较,差异有统计学意义(P<0.05,表1)。拍照记录可见,对照组RPE细胞形态规则,48h后划痕仍清晰可见;高糖组培养的RPE细胞划痕在48h时基本消失,且细胞状态不佳,死亡和变形细胞增加,高糖组RPE细胞迁移率与对照组比较,差异有统计学意义(P<0.05);灯盏花素低浓度组和灯盏花素高浓度组RPE细胞形态较高糖组改善(图1),细胞迁移率较高糖组增加,与高糖组比较差异均有统计学意义(P<0.05),其中灯盏花素高浓度组RPE细胞迁移率与灯盏花素低浓度组RPE细胞迁移率比较,差异有统计学意义(P<0.05)。
2.2灯盏花素对RPE细胞活力的影响四组RPE细胞存活率比较,差异有统计学意义(P<0.05,表1)。对照组RPE细胞存活率与高糖组比较,差异有统计学意义(P<0.05)。1、10μmol/L灯盏花素孵育RPE细胞后,细胞存活率分别提高到61.06%±5.59%和79.81%±7.04%,与高糖组比较差异有统计学意义(P<0.05);灯盏花素高浓度组RPE细胞存活率与灯盏花素低浓度组比较,差异有统计学意义(P<0.05)。
2.3 RPE细胞内ROS的变化以细胞数为纵坐标,相对荧光强度为横坐标,可测定活细胞ROS的相对表达量。检测结果显示,四组RPE细胞内ROS变化比较,差异有统计学意义(P<0.05,表1)。对照组ROS主峰位于基线左侧,细胞内ROS表达较低;高糖组ROS主峰向基线右侧移位,细胞内ROS表达增加;1、10μmol/L灯盏花素干预后,RPE细胞内ROS主峰逐渐向基线左侧移位,细胞内ROS表达逐渐降低(图2);灯盏花素高浓度组RPE细胞内ROS相对表达量与灯盏花素低浓度组比较,差异有统计学意义(P<0.05)。
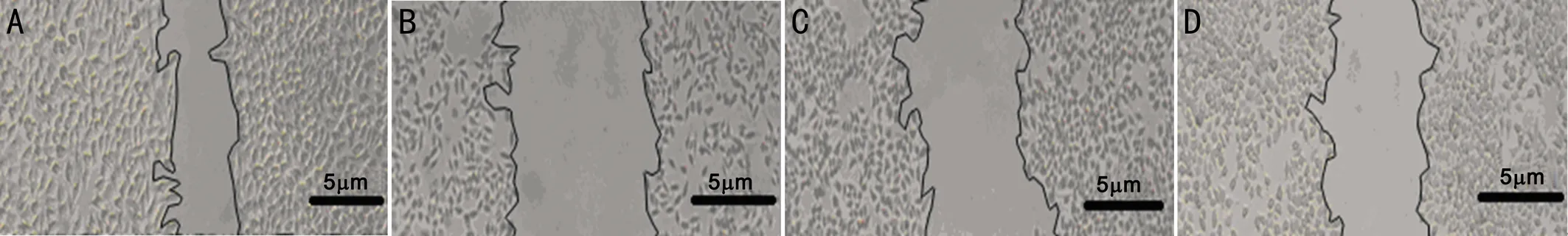
图1RPE细胞划痕实验(×200)A:对照组;B:高糖组;C:灯盏花素低浓度组;D:灯盏花素高浓度组。
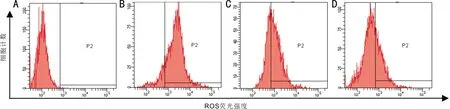
图2流式细胞技术检测RPE细胞内ROS改变A:对照组;B:高糖组;C:灯盏花素低浓度组;D:灯盏花素高浓度组。
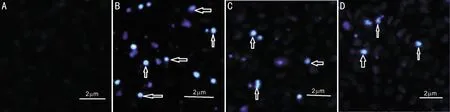
图3灯盏花素对高糖诱导RPE细胞凋亡的影响(箭头示凋亡细胞)(×200)A:对照组;B:高糖组;C:灯盏花素低浓度组;D:灯盏花素高浓度组。

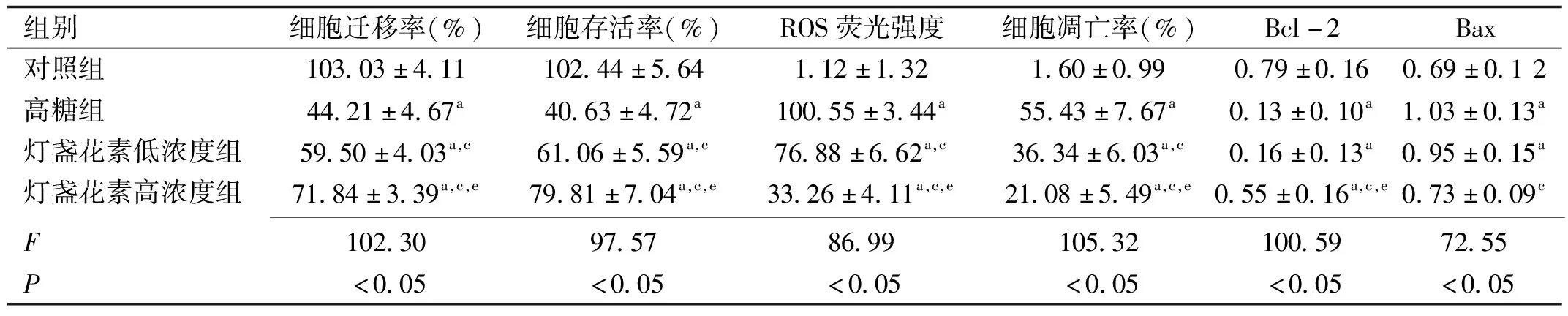
组别细胞迁移率(%)细胞存活率(%)ROS荧光强度细胞凋亡率(%)Bcl-2Bax对照组103.03±4.11102.44±5.641.12±1.321.60±0.990.79±0.160.69±0.12高糖组44.21±4.67a40.63±4.72a100.55±3.44a55.43±7.67a0.13±0.10a1.03±0.13a灯盏花素低浓度组59.50±4.03a,c61.06±5.59a,c76.88±6.62a,c36.34±6.03a,c0.16±0.13a0.95±0.15a灯盏花素高浓度组71.84±3.39a,c,e79.81±7.04a,c,e33.26±4.11a,c,e21.08±5.49a,c,e0.55±0.16a,c,e0.73±0.09c F102.3097.5786.99105.32100.5972.55P<0.05<0.05<0.05<0.05<0.05<0.05
注:aP<0.05vs对照组;cP<0.05vs高糖组;eP<0.05vs灯盏花素低浓度组。
2.4灯盏花素对RPE细胞凋亡的影响四组RPE细胞凋亡率比较,差异有统计学意义(P<0.05,表1)。在Hoechst 33258染色剂作用下,活细胞细胞核呈弥散均匀荧光,凋亡细胞的细胞核或细胞质呈现致密浓染的颗粒状高荧光。荧光显微镜下,对照组背景荧光暗黑色,细胞核均匀染色,未见明显凋亡细胞;高糖组部分细胞核呈致密浓染的亮蓝色高荧光;1、10μmol/L灯盏花素处理后凋亡细胞数量逐渐减少(图3),灯盏花素高浓度组细胞凋亡率与灯盏花素低浓度组比较,差异有统计学意义(P<0.05)。
2.5 Bcl-2和Bax蛋白表达水平检测四组RPE细胞中Bcl-2和Bax蛋白表达水平比较,差异有统计学意义(P<0.05,表1,图4)。Bcl-2蛋白在高糖组中的表达明显降低,与对照组相比差异有统计学意义(P<0.05)。低、高浓度灯盏花素组Bcl-2蛋白表达逐渐升高,其中高浓度灯盏花素组Bcl-2蛋白表达与高糖组比较,差异有统计学意义(P<0.05);灯盏花素高浓度组Bcl-2蛋白相对表达量与灯盏花素低浓度组比较,差异有统计学意义(P<0.05)。Bax蛋白在高糖组中的表达明显升高,与对照组相比差异有统计学意义(P<0.05);灯盏花素干预可降低Bax蛋白的表达,其中高剂量灯盏花素组Bax蛋白表达的相对表达量与高糖组相比,差异有统计学意义(P<0.05)。

图4灯盏花素对RPE细胞内Bcl-2和Bax表达的影响。
3讨论
随着糖尿病的进展,其并发症开始出现,如糖尿病视网膜病变、周围神经病变、糖尿病肾病、糖尿病足溃疡、心血管疾病等[5]。其中,糖尿病肾病和视网膜病变是慢性高血糖引起的主要微血管并发症,其发生原因与晚期氧化应激的诱导、促炎微环境的建立以及糖基化终产物增多有关[6-7]。
有研究显示,灯盏花素在治疗糖尿病肾病和周围神经病变方面均有疗效,其作用机制与降低组织氧化应激水平、抑制炎症反应和调节血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达有关[8-9]。在眼部,有学者采用雾化灯盏花素注射液方法治疗糖尿病视网膜病变,发现该方法具有延缓糖尿病视网膜病变进程、改善患者视功能和提高生活质量的作用。此外,灯盏花素注射液在治疗中心性浆液性脉络膜视网膜病变、视网膜中央静脉阻塞方面均有临床疗效[10-11]。关于灯盏花素对RPE细胞保护作用的研究并不多见,国内学者王竞男等[12]通过建立大鼠糖尿病模型,观察灯盏花素对大鼠视网膜组织中VEGF表达的影响,结果显示灯盏花素可以有效降低VEGF表达,从而推测灯盏花素可以延缓糖尿病视网膜病变病程。
有学者对糖尿病大鼠视网膜进行深入研究,结果显示过氧化氢酶、谷胱甘肽过氧化物酶、谷胱甘肽还原酶和超氧化物歧化酶表达明显下调,而超氧化物明显增加,说明糖尿病大鼠视网膜组织氧化应激程度明显增加[13-14]。本实验使用30mmol/L浓度的葡萄糖建立了RPE细胞高糖氧化应激模型,结果显示30mmol/L浓度的葡萄糖引起RPE细胞活力降低,给予1、10μmol/L灯盏花素作用后,细胞活力增加。
H2DCFDA是一种可渗透细胞的荧光探针,用于检测细胞内的ROS生成。本实验采用流式细胞技术观察高糖对RPE细胞的氧化损伤程度,结果显示高糖对RPE细胞氧化损伤有明显刺激作用,灯盏花素有效抑制了RPE细胞内ROS含量。
Hoechst 33258染色剂能与细胞核DNA结合并呈现蓝色荧光。凋亡的细胞核浓染,荧光增强,呈致密颗粒和(或)块状高荧光;非凋亡细胞呈暗蓝色低荧光。本实验中,高糖组中亮蓝色荧光明显增多,证实高糖可以诱发RPE细胞凋亡,灯盏花素低剂量组和灯盏花素高剂量组中凋亡细胞比例逐渐降低。
Bcl-2在氧化应激介导的细胞凋亡反应中起重要作用,是调节线粒体凋亡途径的重要分子,具有潜在的抗凋亡作用[15]。Bax表达水平的高低直接反映细胞凋亡程度,Western blot结果显示,高糖组细胞中Bcl-2蛋白表达明显降低,Bax蛋白表达明显增加,提示高糖诱导了RPE细胞凋亡,灯盏花素通过改变Bcl-2和Bax蛋白的表达发挥抗细胞凋亡作用。
综上所述,灯盏花素能够有效抑制高糖诱导的RPE细胞凋亡,为糖尿病视网膜病变的治疗靶点研究提供了理论支持。

